рефераты конспекты курсовые дипломные лекции шпоры
Реферат Курсовая Конспект
- Физика
- /
- Лекции
- /
- КВАНТОВАЯ 3
Волновые функции и квантовые числа
Волновые функции и квантовые числа - Лекция, раздел Физика, КВАНТОВАЯ 3 Собственные Функции Уравнения Шрёдингера Для Атома, Т....
Собственные функции уравнения Шрёдингера для атома, т.е. Ψ-функции содержат, как выяснилось, три целочисленных параметра – n, l, m :
Ψ = Ψnlm( r, θ, φ )
n - главное квантовое число ( то же, что и в выражениях для Еп )
п = 1; 2; 3; …
l – орбитальное (азимутальное) квантовое число, определяющее модуль орбитального момента импульса движущегося в атоме электрона.
В квантовых состояниях с заданным значением главного квантового числа п орбитальное квантовое число может иметь следующие значения:
l = 0; 1; 2; 3; … ; (п – 1).
Стационарные волновые функции Ψnlm( r ,θ, φ), описывающие различные квантовые состояния атома, являются собственными функциями не только оператора полной энергии 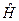 , но и оператора квадрата момента импульса
, но и оператора квадрата момента импульса 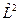 , т.е.
, т.е.
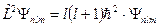 .
.
Следовательно, в любом квантовом состоянии атом обладает определённым значением квадрата момента импульса.
Орбитальное квантовое число l однозначно определяет модуль орбитального момента импульса движущегося в атоме электрона:
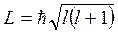
Данное условие квантования момента импульса не совпадает с квантованием момента импульса в теории Н.Бора ( 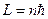 ).
).
Принципиальное отличие этих соотношений состоит в том, что в квантовой теории возможны состояния с L = 0 , а при классическом описании движения электрона в атоме по определённой орбите в любом состоянии атом должен обладать ненулевым моментом импульса.
Эксперименты подтверждают существование квантовых состояний атома с нулевыми орбитальными моментами. Следовательно, опыт подтверждает, что только отказ от классического траекторного способа описания движения электрона в атоме позволяет правильно рассчитать и предсказать свойства атома.
Вероятностный способ описания движения частиц является единственно правильным способом описания свойств атомных систем – таков вывод современной физики.
Если атом переходит из одного квантового состояния в другое с испусканием (поглощением) фотона излучения, то возможны лишь такие переходы, для которых орбитальное квантовое число l изменяется на единицу. Это правило, согласно которому для оптических переходов 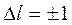 , называется правилом отбора. Наличие этого правила обусловлено тем, что фотон уносит или вносит не только квант энергии, но и вполне определённый момент импульса, изменяющий орбитальное квантовое число электрона всегда на единицу.
, называется правилом отбора. Наличие этого правила обусловлено тем, что фотон уносит или вносит не только квант энергии, но и вполне определённый момент импульса, изменяющий орбитальное квантовое число электрона всегда на единицу.
т - магнитное квантовое число
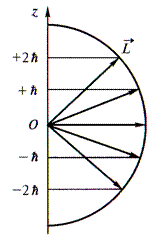
В квантовом состоянии с заданным значением орбитального квантового числа l магнитное квантовое число может принимать ( 2l + 1 ) различных значений из ряда:
т = 0;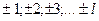
Физический смысл магнитного квантового числа т вытекает из того, что волновая функция Ψnlm( r, θ, φ), описывающая квантовое состояние электрона в атоме водорода, является также и собственной функцией оператора проекции импульса 
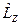
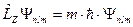 .
.
Из определения собственной функции (см. Лекцию 7 ) получаем
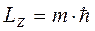
Эту формулу называют формулой пространственного квантования.
– Конец работы –
Эта тема принадлежит разделу:
КВАНТОВАЯ 3
Лекция Ядерная модель атома частиц на атомах металлической фольги обосновал... Лекция Волновые функции и квантовые... Энергетический спектр электрона в атоме водорода...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Волновые функции и квантовые числа
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов