Связки, содержащие от двух до шести шаров, максимально удалённых друг от друга. - раздел Химия, УСТРОЙСТВО ВЕЩЕСТВА Рассмотрим Молекулы С Четырьмя Электронными Парами, Находящимися В Вершинах ...
Рассмотрим молекулы с четырьмя электронными парами, находящимися в вершинах тетраэдра. В молекуле CF4 (тип АХ4) все пары принадлежат химическим связям, поэтому атомы фтора также расположены в вершинах тетраэдра. В молекуле NF3 (тип АХ3Е) одна пара электронов азота не участвует в образовании связи, так что молекула имеет форму треугольной пирамиды. Наконец, молекула F2O (тип АХ2Е2) с двумя неподеленными электронными парами имеет угловую форму.
МОЛЕКУЛЫ, КОТОРЫЕ СУЩЕСТВУЮТ ТОЛЬКО В ВОЗБУЖДЁННОМ СОСТОЯНИИ
Если сближать друг с другом два атома гелия (электронная конфигурация 1s2), общая энергия всё время повышается: при любом расстоянии она больше, чем сумма энергий изолированных атомов. Это означает, что молекула Не2 из таких атомов образоваться не может.
Если же один из атомов возбудить и перевести 1s-электрон на 2s-ypoвень, то такой атом способен соединиться с невозбуждённым во вполне устойчивую (с энергетической точки зрения) молекулу. Правда, молекула в возбуждённом состоянии живёт недолго: примерно через 10-8 секунд после образования она испустит квант света и перейдёт в основное состояние, в результате чего немедленно распадётся на атомы.
Молекулы, которые могут существовать только в возбуждённом состоянии, называют эксимерами (от лат. excito— «возбуждаю»). К ним относятся многие двухатомные молекулы, например Не2, Ne2, Ar2, XeF, KrF, Hg2. Энергия, выделяющаяся при электронных переходах в подобных молекулах, используется в мощных эксимерных лазерах, работающих в ультрафиолетовом и видимом диапазоне.
В молекуле С=О атомы связаны тройной связью: две из этих связей образованы по обменному механизму, а третья — по донорно-акцепторному.
Теория Льюиса позволяет не только описать распределение электронов в молекулах, но и рассчитать так называемые эффективные заряды на атомах. Для этого электронный «колхоз» временно «разгоняют», электроны, участвующие в химической связи, делят поровну между атомами, подсчитывают общее число электронов каждого атома и сравнивают его с числом валентных электронов до образования связи. В молекуле СО на долю углерода приходится пять электронов (два своих и три из шести общих), тогда как в свободном атоме углерода — четыре электрона. Лишний электрон означает, что эффективный заряд на атоме углерода в моле-
Все темы данного раздела:
ИЗ ЧЕГО СДЕЛАН МИР
У ИСТОКОВ
АТОМИСТИЧЕСКОЙ
ТЕОРИИ
Современные понятия элемента, атома и простого вещества, молекулы как совокупности связанных между собой атомов сформировались сравнитель
Самая важная информация.
телец, которые находятся в беспрерывном движении, притягиваются на небольшом расстоянии, но отталкиваются, если одно из них плотнее прижать к другому. В одной этой фразе... содержится невероятно
О природе вещей». Издание 1563 г.
С помощью атомистической теории древние философы пытались объяснить разнообразие форм материального мира. Например, логично было предположить, что существуют разные «сорта» атомов, отличающиеся р
Форма атомных орбиталей.
не имеющих заряда нейтронов (n; от лат. neutrum — «ни то, ни другое»). Только ядро атома водорода состоит из единственного протона. Число протонов в ядре (Z) определяет атом
От порядкового номера элемента.
При переходе от твёрдого состояния вещества к газообразному взаимодействие между частицами ослабевает.
Справа — термометр конца XIX в. со шкалами по Реомюру и Цельсию.
чем в жидком. Одним из исключений является вода, плотность которой при нормальном давлении выше плотности льда.
Большинство твёрдых веществ находится в кристаллической форме: их ча
Кристаллического (1) и аморфного (2) вещества.
«НЕОБЫЧНЫЕ» СОСТОЯНИЯ МАТЕРИИ
Плазма— электрически нейтральный, сильно ионизированный газ, состоящий из положительно заряженных ионов, электронов и нейтральных молекул.
Плазменная горелка.
материалы называются ситаллами. Они обладают ценными механическими, оптическими и электрическими свойствами, которые можно целенаправленно менять, изменяя химический состав стёкол.
ВОЛШЕБНОЕ ЧИСЛО ХИМИКОВ
ВНАЧАЛЕ БЫЛА СТЕХИОМЕТРИЯ...
Выдающийся немецкий философ Иммануил Кант как-то заметил, что в некоторых ветвях естественных наук истинной науки столько, сколько в них математики. Эти слов
Давление газа обусловлено ударами молекул о стенки сосуда.
«ПОДШТАННИКИ ИЗ ХЛОРА»
В 30-х гг. XIX в. французский химик Жан Батист Дюма (1800— 1884) исследовал реакцию замещения водорода хлором в органических соединениях. В частности, при хлорирова
Вильгельм Оствальд.
содержаться одинаковое число молекул. То есть измеряя массу веществ в граммах, химики как бы оперировали молекулами.
Так в химии появилась величина, которую называли грамм-молекулой или м
Фридрих Август Кекуле.
Основные понятия химии — «атом» и «молекула». Атомов известно лишь немногим более 100 видов, а вот молекул — свыше 18 млн. Столь богатое разнообразие обусловлено тем, что атомы разных элементов, в
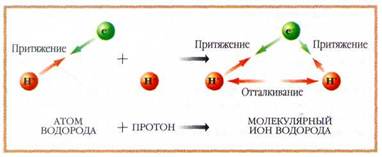
Силы, действующие в молекулярном ионе H+2 при его образовании из атомов.
куле СО равен -1. Молекула в целом электронейтральна, поэтому заряд на атоме кислорода равен +1.
Следует заметить, что истинные заряды на атомах почти всегда меньше эффективных. Так, в мо
Поверхности равной электронной плотности молекулы этилена С2Н4: 1 — 0,002; 2 — 0,2; 3 — 0,36.
поэтому она отражает размеры и форму электронного облака.
Во-вторых, карты электронной плотности отражают изменение распределения электронов при образовании химической связи из атомов. Ч
Электронные облака молекул метана СН4 и аммиака NH3.
химической связи наиболее интересно поведение последних.
Для описания электронов в атоме используют понятие атомной орбитали (АО), которая характеризует вероятность нахождения электрона
Сеть водородных связей в воле. Красные кружки — атомы кислорода, белые — атомы водорода, синие линии обозначают водородные связи.
единённых связью. Её можно измерить экспериментально. Обычно длина ковалентной связи составляет 0,1—0,2 нм. Самая короткая связь — 0,074136 нм — в молекуле дейтероводорода HD. Длина вандерваальсов
Образование водородной связи между молекулами воды.
нанометров (рекорд принадлежит атомам гелия Не...Не — 6,20 нм).
Прочность химической связи определяется энергией связи, т. е. энергией, которая необходима для того, чтоб
Кристаллическая структура вюрцита ZnS.
между ними лишь в численных значениях параметров решётки.
Известна и другая модификация углерода с гомодесмической структурой — так называемый гексагональный алмаз, или лонсдейлит. Здес
Основные типы кристаллических решёток металлов в виде шаровых упаковок: 1 — медь, 2 — магний, 3 — железо.
кристалл, если быстро — множество мелких кристаллов. вещества, состоящие из одного кристалла, называют монокристаллическими (пример — алмаз), а из множества мелких — поликристаллическими (таковы
Кристаллические структуры нафталина С10Н8 (1), серого селена (2) и нитрила бора BN (3).
Шаровые упаковки содержат в себе пустоты, имеющие вполне определённые очертания. Так, в структурах меди и магния есть пустоты, окружённые четырьмя шарами (тетраэдрические пустоты) и, кроме того,
ФИЗИЧЕСКИЙ ПРОЦЕСС И ХИМИЧЕСКАЯ РЕАКЦИЯ
Если бы миллионы разнообразных веществ, а следовательно, и тела, из них состоящие, не претерпевали никаких изменений, мир был бы скучным и застывшим, лишённым движения, развития. К счастью, мир
Реакцию.
Химические превращения, как правило, протекают с выделением или поглощением энергии, обычно в виде теплоты (за исключением немногочисленных термонейтральных реакций, имеющих нулевой тепловой эффек
При горении магниевой ленты на воздухе электроны от атомов магния переходят к атомам кислорода: 2Mg+О2=2MgO.
низмах. Можно с уверенностью говорить: химия жизни — это процессы окисления-восстановления.
ЧТО ЖЕ ТАМ ПРОИСХОДИТ?
В ходе химических превращений одни химические
В процессе окислительно-восстановительной реакции окислитель восстанавливается, а восстановитель окисляется.
элемента в простых веществах равна нулю. У элементов, входящих в состав сложных веществ, степень окисления обычно выражается целыми числами, но известны и дробные значения, например C3
Растворы ферроина и бромата калия до (слева) и после (справа) прибавления серной кислоты.
свободного азота (2N+5+10е®N02), а с тяжёлыми металлами (слабыми восстановителями) — только до NO2 (N+5+e ®N+4).
Наконец,
ЕГО ВЕЛИЧЕСТВО РАСТВОР
«Corpora non agent nisi fluida» — «тела (вещества) не реагируют, если они не растворены». Так считали в древние времена алхимики, и в этом изречении есть значительная доля истины. Если, наприме
Всем, кто пьёт сладкий чай, известно, какой замечательной растворимостью в горячей воде обладает сахар.
растворялось бы любое вещество. Поиски алкагеста прекратились, когда люди наконец догадались, что такое вещество просто не в чем будет держать: ведь по определению оно должно растворять любую по
Растворимость газов в воде при атмосферном давлении в зависимости от температуры.
понижение температуры замерзания DТз раствора не зависит от химической природы растворённого веществ
Растворённые в океанской воде соли понижают температуру плавления льда.
РАСТВОР — ИДЕАЛЬНЫЙ ГАЗ?
В популярных книгах по ботанике описывается такой эксперимент. В широкой части моркови нужно высверлить отверстие вдоль её оси, вставить туда стеклянную трубку с
Сванте Август Аррениус.
приобретено в отношении к пониманию растворов, — писал он, — мне кажется, можно оставить в стороне гипотезу об особом виде диссоциации — на ионы, совершающейся с электролитами при образовании сла
Растворы иода в воде, этаноле, бензоле и четырёххлористом углероде.
ЧТО ТАКОЕ ПРОИЗВЕДЕНИЕ РАСТВОРИМОСТИ, ИЛИ КАК ПУТЕШЕСТВУЮТ ИОНЫ
В разбавленных растворах плохо растворимых солей устанавливается равновесие между твёрдым кристаллическим осадком и ионам
Осадки хлорида, бромида и иодида серебра.
только найти вещество, которое снизит концентрацию в растворе хотя бы одного из её ионов.
Эти рассуждения можно проиллюстрировать эффектной цепочкой превращений, в которых участвуют ион








Новости и инфо для студентов