рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Справа — термометр конца XIX в. со шкалами по Реомюру и Цельсию.
Реферат Курсовая Конспект
Справа — термометр конца XIX в. со шкалами по Реомюру и Цельсию.
Справа — термометр конца XIX в. со шкалами по Реомюру и Цельсию. - раздел Химия, УСТРОЙСТВО ВЕЩЕСТВА Чем В Жидком. Одним Из Исключений Является Вода, Плотность Которой При Нормал...
чем в жидком. Одним из исключений является вода, плотность которой при нормальном давлении выше плотности льда.
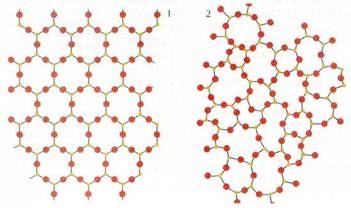
Большинство твёрдых веществ находится в кристаллической форме: их частицы — молекулы, атомы или ионы — расположены в строгом порядке, образуя регулярную пространственную структуру — кристаллическую решётку. Поэтому при переходе жидкости в твёрдое состояние молекулы ведут себя подобно солдатам, получившим команду к построению.
Вместе с тем частицы в кристаллической решётке не неподвижны, они постоянно совершают колебательные движения. Если частицы, расположенные на поверхности твёрдого вещества, приобретают энергию, достаточную для преодоления силы притяжения остальных частиц в кристалле, то они «улетают», образуя пар. Все твёрдые вещества имеют определённое давление пара, хотя оно обычно очень мало, особенно для ионных кристаллов. Так, для NaCl давление пара, равное всего 0,001 мм рт. ст.
ТЕКУТ ЛИ ОКОННЫЕ СТЁКЛА?
Обычное оконное стекло по своему строению не кристаллическое вещество, а жидкость, только очень вязкая. Лишь при сильном нагревании стекло начинает заметно течь. При этом температуры плавления, которая характеризует тела кристаллического строения, у стекла не существует: размягчение по мере повышения температуры происходит постепенно. Вещества с подобными свойствами так и называются — стеклообразные, или просто стёкла.
Однако до сегодняшнего дня никто не замечал, чтобы оконное стекло стекало в сторону подоконника. Если бы стекло хоть в малейшей степени было текучим, люди не могли бы строить современные мощные оптические телескопы, такие, например, как самый крупный в мире телескоп в чилийской пустыне Атакама, названный «Очень большим оптическим». Диаметр его зеркала 8,2 м. Точность шлифовки зеркала исключительно высока, малейшие деформации стекла недопустимы.
С другой стороны, при исследовании средневековых витражей, изготовленных из цветных стёкол, выяснилось: в нижней части они толще, чем в верхней. Некоторые учёные сделали вывод, что это следствие очень медленного, на протяжении многих веков, течения стекла под действием собственного веса, и даже предложили использовать данное свойство для установления времени изготовления старинных стёкол. У химиков существовало поверье, что
длинные стеклянные трубки и палочки нельзя долго хранить в вертикальном положении, так как они постепенно изгибаются. Об этом можно было прочитать ещё в начале XX в. в книге известного немецкого учёного, лауреата Нобелевской премии по химии Вильгельма Оствальда (1853—1932) «Физико-химические исследования».
Английский исследователь Роберт Джон Рэлей (1875—1947), сын знаменитого физика, Нобелевского лауреата Джона Уильяма Рэлея, решил проверить эти утверждения экспериментально. Такая проверка обычно связана с измерением вязкости: зная вязкость, можно рассчитать величину деформации, например, за 10 или 100 лет.
Вязкость — свойство жидкости (или газа) оказывать сопротивление перемещению отдельных слоёв друг относительно друга, а также перемещению твёрдого тела, помещённого в жидкость. В Международной системе единиц (СИ) вязкость имеет размерность Па•с, но на практике распространена внесистемная единица вязкости пуаз (П): 1 П = 0,1 Па•с. Она названа в честь французского физика Жана Луи Пуазейля (1799—1869), который вывел формулу для объёма жидкости V, протекающей за время г по трубе с гладкими стенками длиной l и диаметром R при разнице давлений на концах трубы Dр: V= pDrtR4/8hl, где h — вязкость жидкости.
Однако измерить вязкость стекла при комнатной температуре Рэлей не мог. Оценки, основанные на определении вязкости разогретых выше 500 °С
стёкол, дают для 20 °С значение 1021 П. Для сравнения: вязкость воды при 20 °С равна 0,01 П, глицерина — 15 П, смолы — примерно 108 П. Отсюда следует, что стекло в 10 трлн. раз более вязкая жидкость, чем смола.
В 1923 г. Рэлей провёл следующий опыт. Он взял стеклянный стержень длиной около 1 м и диаметром 5 мм, поместил его в горизонтальном положении на два штыря, вбитых в кирпичную стену, так, чтобы стержень опирался на них только своими концами. К центру стержня был подвешен груз массой 300 г. (Как потом выяснилось, эта нагрузка составляет примерно треть от максимальной: точно такой же стержень ломался от нагрузки чуть больше 1 кг.) Пол тяжестью груза стержень сразу прогнулся на 28 мм в центральной части. И в течение семи лет это значение практически не менялось. К 1930 г., когда опыт завершился, провисание стержня под нагрузкой увеличилось ещё всего на 1 мм, причём это изменение в положении груза относительно стены произошло в первые три года и было вызвано скорее всего деформацией самой стены.
О результатах этого необычного эксперимента Рэлей написал в статье, которую озаглавил «Могут ли стеклянные трубки и стержни изгибаться под действием собственного веса?». Она была опубликована в журнале «Nature» («Природа») в 1930 г. Любопытно отметить, что фамилия автора статьи приведена без инициалов, в отличие от имён других авторов в том же номере. И это
*Процесс перехода твёрдого вещества в пар называют возгонкой или сублимацией. Обратный процесс — кристаллизация из пара.
(0,133 Па), достигается при нагреве кристалла до 567 °С. А чтобы получить такое же давление пара для CaF2, нужна температура 1195 °С. Ещё труднее испаряются некоторые металлы; рекорд принадлежит вольфраму: 0,001 мм рт. ст. при 2975 °С.
С повышением температуры энергия колебаний молекул твёрдого вещества увеличивается, и когда она превышает энергию межмолекулярного притяжения, кристаллическая решётка разрушается — происходит плавление кристалла.
Существуют твёрдые вещества, частицы которых не настолько строго упорядочении:, чтобы образовать правильную кристаллическую решётку. Такие вещества принято называть аморфными (от греч. «аморфос» — «бесформенный»). В отличие от кристаллических, они не имеют определённой температуры плавления, а постепенно размягчаются в некотором интервале температур. К аморфным веществам относятся стекло, природные и синтетические смолы, многие пластмассы.
не опечатка: учёный был лордом. Этот титул Рэлей унаследовал от отца, которому он был пожалован за выдающиеся научные достижения. А лорды-учёные подписывали свои статьи без имени.
Но самое интересное произошло ровно через два месяца после публикации Рэлея. В том же журнале и точно под таким же названием была напечатана статья другого учёного — К. А. Спенсера. Оказалось, он проводил аналогичный эксперимент, с той лишь разницей, что занимался этим делом не для удовлетворения собственного любопытства, а по долгу службы: учёный работал в известной американской фирме «Дженерал Электрик» в лаборатории технологии стекла. Вместо стержня Спенсер использовал прямую стеклянную трубку длиной 1,1 м и диаметром 1 см при толщине стенок 1 мм. Нагрузка в его опыте была более солидной — 885 г, что приближалось к пределу прочности трубки.
Спенсер начал опыт в 1924 г., и трудно сказать, сколько бы он продолжался, если бы исследователь не прочитал статью Рэлея. После этого его терпение не выдержало, хотелось сравнить свои результаты с опубликованными. Итак, через шесть лет после начала опыта Спенсер снял груз. На этот раз изменения были налицо: трубка провисла в центре на 9 мм.
При оценке результатов этого опыта не следует забывать, что нагрузка была близка к предельной и в десятки раз превышала вес самой трубки. Да и опыт продолжался немалое время.
А главное — более поздние эксперименты показали, что подобная деформация не является результатом вязкого течения стекла.
Это доказал тот же Спенсер. Он намотал тонкие стеклянные нити на трубку диаметром 2 см и выдержал их в таком состоянии в течение длительного времени при небольшом подогреве. Когда нити сняли с трубки, они оказались изогнутыми по дуге радиусом около 60 см. Однако когда их поместили на поверхность ртути, где практически нет трения, нити стали выпрямляться — сначала быстро, потом медленнее. Если бы деформация была результатом течения стекла, нити никогда бы не выпрямились!
Причину остаточной деформации стекла выяснили лишь в начале 50-х гг. Оказывается, в нём под влиянием нагрузки происходит медленная диффузия катионов Na+, которых в обычном стекле много. После снятия нагрузки эти катионы постепенно возвращаются к исходному положению, и в конце концов стеклянное изделие вновь принимает прежнюю форму.
Итак, опыты дали однозначный результат: стекло не течёт под нагрузкой и тем более под действием собственного веса.
Почему же тогда стеклянные трубки действительно нередко имели заметный изгиб, а старинные стёкла утолщены в нижней части?
Спенсер нашёл этому довольно правдоподобное объяснение. До того как в самом начале 20-х гг. XX в. был
введён машинный способ вытягивания стеклянных трубок, эту работу делали вручную. Но и самый искусный стеклодув не мог получить идеально прямую трубку длиной до 1 м и более. В лаборатории стеклянные трубки хранили (да и сейчас часто хранят) в вертикальном положении в специальных стойках где-нибудь за шкафом в углу. Химики, разумеется, старались выбирать для себя трубки поровнее, и таким образом происходила естественная отбраковка изогнутых трубок. Так появился (и даже вошёл в некоторые учебники) миф о самоизгибании трубок.
Теперь несколько слов о средневековых витражах. Здесь причина неравномерной толщины стекла ещё интереснее, и связана она со старинной технологией изготовления оконных стёкол. Искусный стеклодув набирал на конец трубки большой, килограмма на четыре, кусок размягчённого стекла и выдувал из него пузырь, который затем сплющивал. Получался на удивление однородный (для ручной работы) диск диаметром метра полтора, с наплывом по краям. Из этого диска и нарезали (от центра к краям) узкие стёкла для витражей. С одной стороны (там, где был край диска) они были немного толще, и при установке такого куска в оконный переплёт его, как правило, размешали толстой частью вниз. Спустя столетия, когда старинная технология изготовления оконного стекла была давно забыта, возникла мысль, что утолщение внизу стекла — это результат его стекания.
*Плавление — процесс переходя твёрдого вещества в жидкость. Обратный процесс называют кристаллизацией из жидкой фазы (расплава).
– Конец работы –
Эта тема принадлежит разделу:
УСТРОЙСТВО ВЕЩЕСТВА
На сайте allrefs.net читайте: "УСТРОЙСТВО ВЕЩЕСТВА".
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Справа — термометр конца XIX в. со шкалами по Реомюру и Цельсию.
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов