рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Дослід 1. Вплив концентрації реагуючих речовин на швидкість реакції в гомогенній системі
Реферат Курсовая Конспект
Дослід 1. Вплив концентрації реагуючих речовин на швидкість реакції в гомогенній системі
Дослід 1. Вплив концентрації реагуючих речовин на швидкість реакції в гомогенній системі - раздел Химия, Хімічна кінетика та рівновага Вплив Концентрації Реагуючих Речовин На Швидкість Реакції В Гомогенній Систем...
Вплив концентрації реагуючих речовин на швидкість реакції в гомогенній системі розглянемо на прикладі реакції між розчинами тіосульфату натрію і сірчаної кислоти. Ця реакція протікає за сумарним стехіометричним рівнянням, яке не відображає дійсного механізму процесу (проміжних стадій), а є загальним виразом для вихідних речовин і продуктів реакції:
Na2S2O3 + H2SO4 = S + H2O + SO2 + Na2SO4
Насправді зазначена реакція відбувається за таким механізмом:
1) Na2S2O3 + H2SO4 = H2S2O3 + Na2SO4
2) H2S2O3 = S + H2O + SO2
Перша з цих реакцій відбувається практично миттєво, а друга повільно. Зрозуміло, що швидкість реакції, яка складається з кількох елементарних стадій, зумовлюється швидкістю перебігу повільнішої з них, тобто в даному випадку другої. Згідно із законом діючих мас, і враховуючи, що концентрація H2S2O3 дорівнює концентрації Na2S2O3, кінетичне рівняння для даного процесу буде мати вигляд:
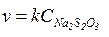
Отже, реакція між розчинами тіосульфату натрію і сірчаної кислоти є бімолекулярною (для її перебігу необхідна молекула Na2S2O3 і молекула H2SO4), але протікає за механізмом реакції першого порядку (швидкість її залежить тільки від концентрації Na2S2O3, причому в першому ступені). Графічно залежність швидкості цієї реакції від концентрації буде виражатися у вигляді прямої лінії.
Виконання роботи. Сірка, що виділяється внаслідок цієї реакції, спочатку утворює з водою колоїдний розчин, який за зовнішнім виглядом нагадує дуже розбавлений розчин мила (ледь помітне помутніння). Необхідно за допомогою секундоміра чи метронома виміряти час від моменту зливання розчинів Na2S2O3 і H2SO4 до виникнення ледве помітного помутніння. Швидкість реакції буде визначатися як величина, обернена до часу, тобто v=1/τ.
На стінках восьми сухих та чистих пробірок проставте олівцем із воску номери: 1, 2, 3, 4, 1а, 2а, 3а, 4а. В останні чотири пробірки(1а-4а) налийте із бюретки (або за допомогою мірних пробірок) по 4 мл спеціально приготовленого розчину сірчаної кислоти. В перші чотири пробірки (1-4) налийте із бюреток (або за допомогою мірних пробірок) вказані в таблиці кількості мілілітрів розчину Na2S2O3 і води. Якщо концентрацію Na2S2O3 в першій пробірці прийняти рівною 1, то в 2-й, 3-й та 4-й вона буде рівна 2, 3 та 4 відповідно.
| № пробірок | Об’єм, мл | Відносна концентрація Na2S2O3 | Час (за секундомі-ром), τ | Швидкість реакції´100, v=100/τ | |
| розчину Na2S2O3 | Н2О | ||||
Влийте розчин з пробірки 1 в пробірку 1а і зараз же ввімкніть секундомір, перемішайте розчини в пробірці (отвір пробірки закрийте великим пальцем і переверніть її декілька разів). Як тільки помітите слабке помутніння розчину в пробірці, вимкніть секундомір. Запишіть результат в таблицю.
Виконайте аналогічні досліди з розчинами пробірок 2-2а, 3-3а та 4-4а.
За одержаними результатами побудуйте на міліметровому папері графік залежності між швидкістю реакції (вісь ординат) і концентрацією (вісь абсцис). Зробіть висновки: якою лінією виражається знайдена залежність, чи повинна ця лінія проходити через початок координат, якого порядку ця реакція?
– Конец работы –
Эта тема принадлежит разделу:
Хімічна кінетика та рівновага
КРИВОРІЗЬКИЙ ТЕХНІЧНИЙ УНІВЕРСИТЕТ... Кафедра хімії...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Дослід 1. Вплив концентрації реагуючих речовин на швидкість реакції в гомогенній системі
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов