СБОРНИК ЗАДАЧ И КОНТРОЛЬНЫЕ ЗАДАНИЯ ПО АНАЛИТИЧЕСКОЙ ХИМИИ
| Министерство образования Республики Беларусь Учреждение образования Международный государственный экологический университет им. А.Д. Сахарова | 
|
Факультет экологической медицины
Кафедра биохимии и биофизики
А.Н. Пырко
СБОРНИК ЗАДАЧ И КОНТРОЛЬНЫЕ ЗАДАНИЯ ПО АНАЛИТИЧЕСКОЙ ХИМИИ
Минск УДК 543(075.8) ББК 24.4Пырко А. Н.
Сборник включает теоретические сведения основ аналитической химии, решения типовых задач, наборы задач для…ВВЕДЕНИЕ
Индустриализация, связанная с развитием химии (аналитическая химия всегда была частью химии, а порой даже основной ее частью), породила достаточно большое количество проблем, решение которых весьма проблематично без химического анализа. Научной основой химического анализа является аналитическая химия. Аналитическая химия наука о методах и средствах определения химического состава вещества.
В последнее время значительно выросли возможности аналитической химии, расширилась область методов анализа, повысилась чувствительность, точность и экспрессность анализа, чаще стали применять компьютеры, возросло внимание к аналитическому контролю. Наблюдается снижение нижнего предела обнаружения с 10-6 – 10-5 М на несколько порядков до наноконцентраций (10-9 М) и ниже.
Причиной всеобщей озабоченности состоянием природной среды является факт обнаружения в экологических системах (в основном в биосфере) значительных антропогенных изменений (вызванных деятельностью человека). Для оценки степени негативных изменений вводится понятие экологического мониторинга — системы наблюдений и контроля за изменениями в составе и функциях различных экосистем. Поскольку химическое загрязнение является основным фактором неблагоприятного антропогенного воздействия на природу, наблюдение и контроль за состоянием окружающей среды предполагает исследования атмосферного воздуха, почвы, водоемов на наличие загрязняющих химических веществ, а также изучение радиационного загрязнения, вызывающих нарушение сложившегося экологического равновесия в природе. Следовательно, в основе экологического мониторинга лежит химический анализ. А целью аналитической химии становится определение концентрации загрязняющих веществ в различных природных объектах.
КЛАССИФИКАЦИЯ МЕТОДОВ АНАЛИЗА
В зависимости от цели анализа различают качественный анализ и количественный анализ.
Цель качественного анализа - обнаружение и идентификация компонентов в анализируемом объекте. Качественный анализ обычно предшествует количественному.
Задача количественного анализа - определение количественного содержания всех или отдельных компонентов анализируемого объекта.
Разнообразие элементов и их соединений вызвало появление различных методов их количественного определения. Методы определения принято делить на: химические; физико-химические; физические;биологические гибридные.
Химические основаны на использовании химических реакций (титриметрические, гравиметрический), физические – на изменении какого-нибудь физического свойства вещества, биологические – на использовании живых организмов в качестве аналитических индикаторов. Примерами биологических методов анализа могут служить микробиологические определения активности антибиотиков, обнаружение некоторых алкалоидов (никотина, атропина).
В основе всех методов определения лежит аналитический сигнaл - измеряемая физическая величина, на основании которой производится количественное определение содержания определяемого компонента. Для каждого метода определения существует своя зависимость аналитического cигнала от количества определяемого вещества, так, в гравиметрии аналитическим сигналом является масса гравиметрической формы, в титриметрических методах - объем стандартного раствора и т. д.
Важнейшими направлениями развития методов аналитической химии является их миниатюризация, автоматизация и упрощение. Преобладающее значение приобретают физико-химические (электрохимические, хроматографические, спектральные) методы.
2. МЕТРОЛОГИЧЕСКИЕ ХАРАКТЕРИСТИКИ МЕТОДОВ АНАЛИЗА
Метрология – наука об измерениях и методах достижения их единства и требуемой точности. Метрологическими характеристиками методов анализа являются:
1. Чувствительность - минимальное количество вещества, определяемое данным методом. Одна из характеристик чувствительности - предел обнаружения или нижний предел обнаружения (НПО).
(ПрО – предел обнаружения) - минимальное количество или минимальная концентрация вещества, которые могут быть достаточно надежно определены данным методом. Чем меньше содержание компонента в анализируемом объекте, тем выше должна быть чувствительность метода и ниже ПрО.
2. Селективность (избирательность) возможность определить данный компонент без помех со стороны других компонентов анализируемого объекта. Если метод дает возможность определить только один компонент без помех со стороны других компонентов, то метод является специфичным. Специфичные реагенты немногочисленны, поэтому, как правило, используют маскирование или предварительное разделение.
3. Точность определения обычно характеризуется относительной погрешностью, или ошибкой определения. Наиболее точными являются «классические» химические методы анализа (0,05 - 0,5%).
4. Воспроизводимость характеризует степень близости друг другу единичных измерений.
5. Правильность характеризует степень отклонения полученного результата от истинного значения.
6. Экспрессность - время, необходимое для проведения анализа.
Ошибки анализа подразделяют на систематические и случайные. Систематические ошибки – это ошибки, обусловленные недостатками применяемого метода анализа. Например, чистотой применяемых реактивов, точностью измерений используемых приборов (инструментальные ошибки). Случайные ошибки обусловлены различного рода случайными причинами, например, резким повышением температуры, попаданием в раствор посторонних веществ.
Чтобы исключить влияние случайных ошибок результат анализа, выполняют несколько параллельных определений. Если при этом получаются близкие результаты, то берут среднее арифметическое. С увеличением числа повторных определений точность среднего арифметического повышается и, таким образом, уменьшается величина отклонения от действительного содержания компонента в анализируемой смеси. Среднее арифметическое рассчитывают как сумму результатов всех определений, деленную на количество определений (n):

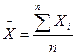 .
.
Разность между отдельным результатом и средним значением называют случайным (единичным) или просто отклонением: di = 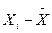
Отклонение результатов отдельных определений от среднего арифметического характеризует воспроизводимость метода и выражается дисперсией:
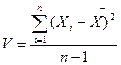 , или стандартным (средним квадратичным) отклонением: S =
, или стандартным (средним квадратичным) отклонением: S =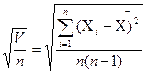 , а также относительным стандартным отклонением:
, а также относительным стандартным отклонением: 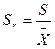 .
.
Однако, хорошую воспроизводимость определений еще нельзя считать достаточным условием точности метода. Последняя указывает только на отсутствие случайных ошибок, и не учитывает систематических.
Ошибки (погрешности) определений выражают различными способами и подразделяют на абсолютные и относительные.
Абсолютная погрешность представляет собой разность между найденным результатом анализа и истинным содержанием определяемого компонента в смеси: 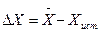 . Относительная погрешность – это отношение абсолютной погрешности к истинному значению измеряемой величины:
. Относительная погрешность – это отношение абсолютной погрешности к истинному значению измеряемой величины:  .
.
Суммарная квадратичная погрешность определяется как корень квадратный из суммы квадратов абсолютной систематической и случайной погрешности:
∆Х = 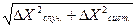
Измеряемая величина (x) не всегда совпадает с определяемой (y), а связана с последней функциональной зависимостью, т.е. y = f(x) .
Очевидно, что погрешность определения ∆у зависит от вида f(x) .
В общем виде: ∆y = ∆x . 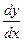 . Например, для функции y = k . lgx абсолютная погрешность определяемой величины ∆y = 0,434 . k .
. Например, для функции y = k . lgx абсолютная погрешность определяемой величины ∆y = 0,434 . k . 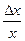 и относительная погрешность
и относительная погрешность 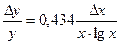 .
.
Значащие цифры и правила округления.
Экспериментальные данные и результаты расчетов в химическом анализе принято выражать только значащими цифрами. Значащими называются все достоверно известные цифры плюс первая из недостоверных, т.е. все результаты следует округлять до первой недостоверной цифры. Значащие цифры в приближённых вычислениях - это все цифры числа, начиная с 1-й слева, отличной от нуля, до последней, за правильность которой можно ручаться. Например, если измерение произведено с точностью до 0,0001 и дало результат 0,0320, то з. ц. будут 3, 2 и 0.
Нули, входящие в состав числа, могут быть как значимыми, так и незначимыми. Если нуль стоит в начале числа и определяет место десятичной запятой, то он незначим. Если нуль находится между другими значащими цифрами, то он значим. Например, число 0,005 имеет одну значащую цифру, а число 5,005 – четыре. Нули, стоящие в конце числа могут быть как значимыми, так и незначимыми. Например, в числе 50,00 – четыре значащие цифры. Нули, стоящие после запятой значимы. В числе 50 может быть одна значащая цифра, если нуль указывает лишь порядок величины, или две, если это число может быть записано как 50±1. Для оценки недостоверности результатов химического анализа необходимо учитывать реальные возможности используемого метода или методики. В качестве статистических критериев может служить стандартное отклонение или доверительный интервал. В случае отсутствия таких сведений, недостоверность принимают равной ±1 в последней значащей цифре. При подсчете значащих цифр не считаются нули с левой стороны числа. Нули стоящие в начале числа всегда незначимы и служат лишь для указания места запятой в десятичной дроби. Нуль считается значащей цифрой, если он расположен между значащими цифрами или стоит правее всех значащих. Так 0,005 – содержит лишь одну значащую цифру. Если в числе 500 одна значащая цифра, то его пишут 5 . 102, две – 5,0 . 102, три – 5,00 . 102. Записи 125000 и 125×103 определяют разные приближенные значения: в первой абсолютная погрешность равна 0.5, во второй - в 1000 раз больше. Результат арифметических действий над приближёнными числами представляет собой также приближённое число. Значимость суммы или разности, а также произведения или частного определяется значимостью числа с наименьшим числом десятичных знаков. Например, значимость суммы из трех чисел 5,8 + 7,95 + 8,321 = 22,071 определяется первым слагаемым, у которого одна значащая цифра после запятой. Сумму следует округлить до 22,1. Произведение 3,5 × 3,93 = 13,755 следует округлить до 13,8. При возведении в степень относительная недостоверность результата возрастает в числа раз равное степени. Так например, некоторая величина а измерена с точностью ±0,01, тогда относительная недостоверность (погрешность) определения числа аn будет ±0,0n. При извлечении корня недостоверность результата, очевидно, уменьшится в число раз равное степени корня, т.е. если n = 1/k, где k – целые числа (степень корня), то относительная недостоверность определения числа аn (величина а измерена с точностью ±0,01) будет равна ±0,0n или ± 0,01/k. При взятии десятичного логарифма недостоверность (как указывалось выше) результата составляет примерно 0,43 от относительной недостоверности исходного числа, поэтому при логарифмировании число значащих цифр обычно увеличивают. При потенционировании (взятии антилогарифма) число значащих цифр уменьшают.
Правила записи приближенных чисел
Для каждого приближенного числа обязательно указывается его погрешность. Запись вида
| a = a* ± Δ(a*) |
означает, что a* является приближенным значением числа a с абсолютной погрешностью Δ(a*). Если же a* является приближенным значением числа a с относительной погрешностью δ(a*), то пишут так:
| a = a * (1 ± δ(a* )). Следует отметить, что в результате исследований на стыке прикладной математики и экспериментальной химии возникла новая отрасль науки – хемометрика (хемометрия), которая занимается применением математических и статистических методов для планирования эксперимента и оптимизации, распознание образцов и др. |
ЗАКОН ЭКВИВАЛЕНТОВ
Эквивалент - это реальная или условная частица вещества, которая эквивалентна: а) одному иону Н+ или ОН- в данной кислотно-основной реакции; б)… Химическое количество эквивалентов вещества – количество молярных масс… Фактор эквивалентности fэкв. — это число, которое обозначает, какая доля реальной частицы эквивалентна одному иону Н+…СВОЙСТВА РАСТВОРОВ
Способы выражения концентрации растворов
0,1 н, Сэкв. (1/5 КМnО4) = 0,05 моль экв./л или 0,05 н. 3. Массовая доля - это отношение массы вещества к массе раствора: w(X) = m (X)/m(раствора). Величина безразмерная или в процентах иногда… 4. Моляльная концентрация – это химическое количество вещества, растворенное в одном килограмме растворителя: Cm = . …Связь различных способов выражения концентрации растворов
Вывод уравнений, связывающих различные выражения концентрации одного и того же раствора. 1) Молярность - массовая доля (СМ - ω). Молярная концентрация – это химическое количество вещества, содержащееся в одном литре раствора: СМ = . Пусть…Ионная сила и рН растворов
Величина ионной силы раствора определяет отличие эффективной (определяемой) (ai) концентрации иона, называемой активностью от истинной (ci). Связь… Можно рассчитать коэффициент активности по формулам Дебая-Хюккеля: -lgfi = 0,5 . zi2 . , если μ < 0,01;Расчет рН растворов разных электролитов
Расчет рН различных растворов. 1) Сильной кислоты: pH = -lg[H+] = -lgСн, где Сн или Сэк., СN -нормальная… 2) сильного основания: рН = 14 + lg[OH-] = 14 + lgСo, где Сo или Сэк., СN - нормальная концентрация основания.Решение типовых задач
Решение: Очевидно, что число эквивалентности оснований, участвующих в реакциях обмена,… Так как в результате химической реакции ионного обмена образовался фосфат кальция Cа3(РO4)2, то очевидно, что в…Задачи для самостоятельного решения
1. К 100 мл 0,1 М раствора серной кислоты прибавили 100 мл 0,4 н раствора гидроксида натрия. Определить рН полученного раствора? Ответ: рН = 13. 2. К 100 мл 0,2 н раствора гидроксида калия прибавили 100 мл 0,4 М раствора уксусной кислоты. Определить рН…ГРАВИМЕТРИЧЕСКИЙ (ВЕСОВОЙ) МЕТОД АНАЛИЗА
Например, эффективным является определение содержания меди в ее сплавах этим методом, в частности, в латуни – сплаве меди с цинком. Взвешенную пробу… Методы отгонки применяют в том случае, если определяемый компонент отгоняется… BaCl2.2H2O = BaCl2 + 2H2O В методах осаждения определяемый компонет выделяют в осадок в виде малорастворимого…Общая характеристика метода
в) простота аппаратурного оформления. Недостатки: а) длительность анализа; б) неприменимость для определения малых концентраций; в) невысокая…Решение типовых задач
равновесие Cd(CN)2 = Cd2+ + 2CN- характеризуется величиной произведения растворимости равному произведению квадрата активности цианид-аниона на… 2. Рассчитать содержание NH4+ в пробе, если после проведения гравиметрического… NH4+ → (NH4)2PtCl6 → Pt масса гравиметрической формы (Pt) составила 0,0243г, а гравиметрический фактор (F)…Задачи для самостоятельного решения
2. Выпадет ли осадок Mg(OH)2, если к 20 мл 0,2 М раствора MgCl2 прибавить 10 мл 2 М раствора NH4OH и 10 мл 1 М раствора NH4Cl? Kд(NH4OH) = 1,76 .… 3. Рассчитать молярную растворимость BaSO4 в воде и сравнить ее с… 4. Рассчитать молярную растворимость AgCl в 1М растворе аммиака. ПР(AgCl)=1,78 . 10-10. b([Ag(NH3)2]+)=1,7 . 107.…Задачи для самостоятельного решения
1. Сколько грамм NaОН необходимо взять чтобы приготовить 250 мл 0,1 н раствора? Ответ: 2,0 г. 2. Сколько грамм 90%-ной серной кислоты надо взять, чтобы приготовить 920 мл 0,1 н раствора этой кислоты? Чему равна…Реакции в титриметрическом анализе
6) раствор титранта должен быть стандартизирован; Классификация титриметрических методов анализа по реакции, лежащей в основе определения: 1)… Н+ + ОН- = Н2О); 2) осадительное титрование (основано на реакциях осаждения);… 6.6 Процесс и способы титрованияЛинейные кривые титрования зависимости величины параметра от концентрации определяемого вещества (Рис.1) , от концентрации титранта (Рис.2), от концентрации как определяемого вещества, так и титранта (Рис.3)
Логарифмические кривые строят в том случае когда величина измеряемого параметра пропорциональна логарифму концентрации определяемого вещества, титранта или продукта реакции титрования (кислотно-основное, окислительно-восстановительное и комплексометрическое титрование).
Построение кривых титрования позволяет: а) выбрать индикатор; б) оценить погрешность титрования; в) наглядно проследить за ходом титрования.
Характерной особенностью кривой титрования является скачкообразное изменение концентрации X при равномерном прибавлении титранта. Максимальное изменение концентрации X происходит вблизи точки эквивалентности.
Точка эквивалентности (т. э.) — это момент титрования, когда к определяемому веществу добавлено эквивалентное количество титранта.
Конечная точка титрования (к. т. т.) - это момент титрования, когда на практике от одной последней капли титранта изменяется цвет индикатора и титрование прекращают.
Точка начала скачка (т. н. с.) - это момент титрования, когда добавлено 99,9% от количества титранта, необходимою для достижения т.э. (т, е. определяемое вещество недотитровано на 0.1%).
Точка конца скачка (т. к. с.) это момент титрования, когда добавлено 100,1% от количества титранта, необходимого для достижения т. э. (т. е. определяемое вещество перетитровано на 0,1%).
Скачок титрования – это отрезок кривой титрования, ограниченный двумя точками, соответствующеми 99,9% и 100,1% оттитрованности определяемого раствора.
Скачок титрования - это область кривой титрования вблизи т. э., в которой происходит резкое изменение значения измеряемого параметра раствора(рН, электродного потенциала (Е), рМе) при небольшом изменении объема добавленного титранта.
Факторы, влияющие на величину скачка титрования: а) концентрации титруемого вещества X и реагента R; б) природа реагирующих веществ X и R (Kдис., Kуст., Е°, ПР);
в) температура.
Расчет концентрации веществ на различных участках кривых титрования
КИСЛОТНО-ОСНОВНОЕ ТИТРОВАНИЕ (МЕТОД НЕЙТРАЛИЗАЦИИ)
Общая характеристика метода
7.2 Индикаторы кислотно-основного титрования Определение к. т. т. в методах кислотно-основного титрования основано на… Интервал перехода окраски индикатора – это интервал изменения значения измеряемого параметра раствора (рН – метод…Таблица 1. Данные расчета зависимости изменения рН раствора при титровании 10 мл 0,1 М раствора соляной кислоты 0,1 М раствором гидроксида натрия от объема добавленного раствора щелочи
| Добавлено 0,1 М NaOH, мл | [H+] моль/л | pH | Добавлено 0,1 М NaOH, мл | [H+] моль/л | pH |
| 0,00 | 0,100 | 1,00 | 9,99 | 10-4 | 4,00 |
| 1,00 | 0,090 | 1,05 | 10,00 | 10-7 | 7,00 |
| 5,00 | 0,050 | 1,30 | 10,01 | 10-10 | 10,00 |
| 9,00 | 0,010 | 2,00 | 10,10 | 10-11 | 11,00 |
| 9,90 | 0,001 | 3,00 |
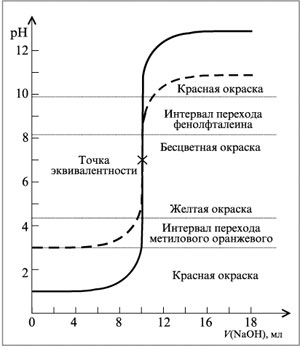
На рис. 4 представлены кривые титрования НСl раствором NaOH.
_____________________________________________________________________________
______ __
__
Рис. 4. Кривые титрования 10 мл 0,1 н раствора НСl раствором 0,1 н NaOH (сплошная кривая) и 10 мл 0,001 н раствора HCl раствором 0,001 н NaOH (пунктирная кривая)
Величина скачка на кривой титрования зависит от концентрации титруемого раствора. Чем больше концентрация, тем больше величина скачка. Так, при титровании 0,1 М раствора скачек включает отрезок кривой 4 – 10 единиц рН, 0,01 М раствора: 5 – 9, 0,001 М раствора: 6 – 8.
Выбор индикатора титрования:
Раствор в т. э. является нейтральным, т. е. титрование желательно вести до рН = 7. Однако анализ кривой титрования (сплошная кривая) показывает, что скачок титрования охватывает область значений рН = 4-10. В таком случае пригодны для титрования все индикаторы, интервал перехода которых находится в указанной области рН. Например, можно использовать фенолфталеин (рН = 8—10), метиловый оранжевый (рН = 3,5-4,5) и другие кислотно-основные индикаторы.
Ошибки титрования.
Пригодность того или иного индикатора для данного титрования можно количественно характеризовать индикаторной ошибкой титрования, возникающей из-за несовпадения рТ и рН в точке эквивалентности. При титровании сильной кислоты сильным основанием и наоборот ошибка может быть водородной или гидроксидной. Водородная, или Н+ -ошибка, возникает, если рТ < 7, гидроксильная – рТ > 7. При титровании сильной кислоты сильным основанием водородная ошибка возникает из-за неоттитрованности кислоты, а при титровании сильного основания сильной кислотой из-за избыточного, по сравнению с эквивалентным, количества добавленной кислоты.
Если объем титруемого раствора увеличивается вдвое, то относительная водородная ошибка рассчитывается по формуле:
δН+ = 2 ,
,
где с – концентрация титруемой кислоты или основания. Относительная гидроксидная ошибка в процентах к исходному количеству кислоты или щелочи составляет:
δОН- = 2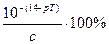 .
.
7.4 Титрование слабой кислоты сильным основанием
Реакция:
СН3СООН + NaOH → CH3COONa + Н2О.
Состав раствора в различные моменты титрования и формулы для расчета рН:
1) до начала титрования. В растворе находится CH3COOH в исходной концентрации. рН определяется диссоциацией слабой кислоты:
рН= -lg 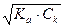 = 0,5 рКа - 0,5 lgCк = 0,5 рКа + 0,5 pCk =
= 0,5 рКа - 0,5 lgCк = 0,5 рКа + 0,5 pCk =  рКа +
рКа +  рСк, где Cк - молярная концентрация уксусной кислоты, pCк =-lgCк.
рСк, где Cк - молярная концентрация уксусной кислоты, pCк =-lgCк.
2) до_т. э. В растворе находятся неоттитрованная CН3COOH, соль
CH3COONa и вода. pH определяется присутствием буферной системы - слабой кислоты и ее соли:
рН=рКк - lg(Ck/Cсоли) = рКк - lg[V0 (CH3COOH) . C0(CH3COOH) – V(NaOH) . C(NaOH)]/ V(NaOH) . C(NaOH) = рКк – lg[(1 – f)/f], где f – степень оттитрованности.
3) в т.э. В растворе находится соль слабой кислоты. рН определяется
гидролизом соли слабой кислоты: pH = 7 + 0,5 . pKк + 0,5 . lgCсоли.
Без учета увеличения объема титруемого раствора: рН = 7 + 0,5 . pKк + 0,5 . lgC0(CH3COOH).
Замечание: При титровании слабого основания сильной кислотой pH = 7 - 0,5 pKосн. - 0,5 . lgCсоли = -lg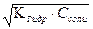
4) после т. э. В растворе находятся CH3COONa и избыток титранта NaOН. pН определяется диссоциацией сильного основания, т.е. расчет осуществляется аналогично как и при титровании сильной кислоты: pH = 14 + lg[OH-]изб. = 14 + lg[V(NaOH) . C(NaOH) - V0 (CH3COOH) . C0(CH3COOH)]/ V0 (CH3COOH).
Например, в таблице 2. приведены данные расчета зависимости изменения рН раствора при титровании 100 мл 0,1 М раствора уксусной кислоты 0,1 М раствором гидроксида натрия от объема добавленного раствора щелочи (без учета изменения первоначального объема раствора в ходе титрования).
Таблица 2. Данные расчета зависимости изменения рН раствора при титровании 100 мл 0,1 М раствора уксусной кислоты 0,1 М раствором гидроксида натрия от объема добавленного раствора щелочи
| Добавлено 0,1 М NaOH, мл | [H+] моль/л | pH | Добавлено 0,1 М NaOH, мл | [H+] моль/л | pH |
| 0,0 | 1,32 . 10-3 | 2,88 | 99,9 | 1,74 . 10-8 | 7,76 |
| 10,0 | 1,74 . 10-4 | 3,76 | 100,0 | 1,32 . 10-9 | 8,88 |
| 50,0 | 1,74 . 10-5 | 4,76 | 100,1 | 1,00 . 10-10 | 10,00 |
| 90,0 | 1,74 . 10-6 | 5,76 | 101,0 | 1,00 . 10-11 | 11,00 |
| 99,0 | 1,74 . 10-7 | 6,76 |
Кривая титрования (сплошная линия) 100 мл 0,1 н раствора СН3СООН 0,1 н раствором щелочи представлена на рис.5 и кривая титрования (пунктирная кривая) более слабой кислоты, чем уксусная (угольная, например).
___________________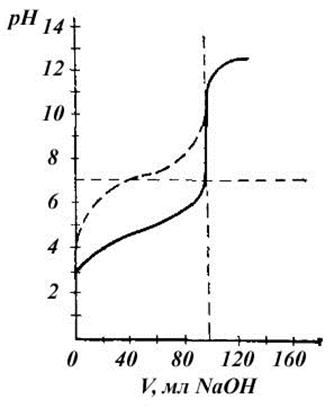
Рис.5. Кривая титрования (сплошная линия) 100 мл 0,1 н раствора СН3СООН 0,1 н раствором щелочи и кривая титрования (пунктирная кривая) более слабой кислоты, чем уксусная (угольная, например)
Выбор индикатора.
Т.э. находится в области рН>7. Скачек на кривой титрования соответствует изменению рН от 8 до 10 (рис.2). Для этого титрования пригоден фенолфталеин. Кроме фенолфталеина можно применять другие индикаторы с интервалами перехода окраски, лежащими в пределах скачка на кривой титрования. Индикаторы, не удовлетворяющие этому условию (метиловый оранжевый, метиловый красный), не пригодны для титрования.
Правильно подобранным является индикатор, интервал перехода окраски которого, полностью входит в границы скачка на построенной кривой титрования
При титровании слабой кислоты может возникнуть гидроксидная (рТ > рН т.э.) или кислотная, обусловленная наличием в растворе неоттитрованной… Гидроксидная ошибка в процентах к исходному количеству кислоты или щелочи… δОН- = 2.Выбор индикатора титрования
Решение типовых задач
б) Определить молярную концентрацию эквивалента титруемого раствора Na3PO4 , если на титрование 100 мл этого раствора понадобилось 300 мл 0,1 М… Решение: а) При титровании соли Na3PO4 раствором НСl в присутствии метилового оранжевого протекает реакция:Задачи для самостоятельного решения
1 Рассчитать рН и степень диссоциации 0,1 М раствора HNO2. Как изменятся эти величины при добавлении к раствору нитрита калия до концентрации 0,5… 2 Рассчитать рН раствора, полученного при сливании 50 мл 0,01 М раствора NH4OH… 3 Рассчитать равновесную концентрацию ионов водорода в растворе, полученном при сливании 20 мл 0,05 М раствора HCl и…МЕТОДЫ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНОГО ТИТРОВАНИЯ
5Fe2+ + MnO4- + 8H+ = 5Fe3+ + Mn2+ + 4H2O протекает в соответствии с уравнением только в присутствии H2SO4. Если для… RT. lnK = E0nF,Перманганатометрия
8.5 Аналитические возможности метода перманганатометрии Перманганатометрически можно проводить определение многих веществ, которые… Окислитель + Fe2+ (избыток) → продукт + Fe3+ + Fe2+(остаток) Fe2+(остаток) + МnО4- + H+ → Fe3+ + …Условия проведения и аналитические возможности метода
Иодометрия - весьма универсальный и очень точный метод, позволяющий проводить определение многих веществ: 1. Окислителей (Сr2О72-, Сu2+, H2O2 и… I2(остаток) + S2O32- → б) Осаждают ион металла в виде хромата,… 8.9 Решение типовых задачЗадачи для самостоятельного решения
1. Определить фактор эквивалентности и молярную массу эквивалента окислителя и восстановителя в реакции: а) I2 + 2S2O32- = 2I- + S4O62- б) 5H2C2O4 + 2MnO4- + 6H+ = 2Mn2+ + 10CO2 + 8H2OОбщая характеристика метода
9.2 Реакции ионов металлов Меn+с ЭДТА Молекула ЭДТА содержит 10 донорных атомов (2 - азота. 8 -кислорода), но обычно… Ме2+ + H2Y2- = МеY2- + 2Н+ В комплексонате две ковалентные полярные связи образуются по обменному механизму (ион…Кривые комплексонометрии и способы установления конечной точки титрования (к. т. т.)
[Men+]/ + [Y4-]/ = [MeYn-4] и равна . Отношение условной (кажущейся) концентрации металла к истинной называется… Коэффициент побочной реакции рассчитывается с использованием констант устойчивости аммиачных комплексов определяемого…Условия проведения комплексонометрического титрования
Решение типовых задач
Решение. В соответствии с законом эквивалентов: n(ЭДТА) = n(Zn) = m(Zn)/M(Zn). Обозначим молярную концентрацию раствора комплексона III (трилона Б) как С(ЭДТА), тогда количество вещества (моль)…Задачи для самостоятельного решения
2. Рассчитать равновесную концентрацию ионов серебра в 1 л раствора, содержащем: а) 0,5 моль AgNO3 и 1 моль KCN; б) 0,1 моль AgNO3 и 0,7 моль NH3.… 3. К 20,00 мл раствора, содержащего алюминий (Al3+), добавили 50,00 мл 0,0108 …ЭЛЕКТРОХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
Любой электрический параметр (потенциал, сила тока, сопротивление и др.), функционально связанный с концентрацией определяемого компонента и… Чувствительные элементы небольших размеров, генерирующие аналитический сигнал,… Сенсор – это первичное устройство, регистрирующее (откликающееся) на определенные свойства окружающей среды и…Классификация электрохимических методов
Электрохимические методы анализа классифицируют по природе определяемого параметра электрохимической ячейки.
1. Потенциометрический метод - измеряемый параметр: потенциал Е, В (вольт).
2. Вольтамперометрический метод - измеряемый параметр: сила тока I, мкА (микроампер).
3. Кулонометрический метод - измеряемый параметр: количество электричества Q, Кл (кулон).
4. Кондуктометрический метод - измеряемый параметр: удельная электропроводность х, (Ом . см)-1.
5. Электрогравиметрический метод -измеряемый параметр: масса m, г.
Основные электрохимические методы
При потенциометрическом титровании в анализируемый раствор порциями добавляют стандартный раствор реагента и следят за изменением потенциала. Вблизи… Вольтамперометрия. Во всех вариантах вольтамперометрических методов используют… Амперометрия. В амперометрии потенциал рабочего (индикаторного) электрода поддерживают постоянным и измеряют…Решение типовых задач
Решение: э.д.с. элемента равно разности электродных потенциалов катода и анода. В данном случае это разность потенциалов электода сравнения и… Известно, что потенциал водородного электрода зависит от концентрации протонов… 0,57 . 10-7 моль/л.Задачи для самостоятельного решения
2. Каково значение ЭДС гальванического элемента - Pt|Sn4+,Sn2+||Fe3+,Fe2+|Pt, если [Sn4+] = [Fe2+] = 0,01 моль/л и [Sn2+] = [Fe3+] = 1 моль/л?… 3. Рассчитать потенциал водородного электрода раствора, содержащего 0,1 моль/л азотистой кислоты HNO2 и такой же…ХРОМАТОГРАФИЧЕСКИЕ МЕТОДЫ
Обычно анализируемый образец состоит не из одного вещества, а из смеси веществ. Одни из них представляют интерес для исследователя, другие являются… Хроматографическое разделение основывается на различии таких свойств веществ,… Если подвижная фаза – газ, то метод называется газовой хроматографией (ГХ), если жидкость – жидкостной (ЖХ); если…Механизмы хроматографического разделения
Рассмотрим основные механизмы распределения веществ между подвижной и неподвижной фазами на примере колоночной хроматографии.
Адсорбционная хроматография. Неподвижная фаза представляет собой твердое вещество, на активных центрах которого адсорбируются молекулы определяемых веществ. Разделение может быть основано на различиях их полярностей: чем полярнее вещество, тем сильнее оно адсорбируется на неподвижной фазе и дольше задерживается на ней.
Распределительная хроматография. Неподвижная фаза представляет собой текучее вещество, нанесенное на твердый носитель или химически связанное с ним. Компоненты смеси, пропускаемой через колонку, разделяются вследствие разной растворимости в неподвижной фазе. Как в газовой, так и в жидкостной распределительной хроматографии используют неподвижные фазы с разной полярностью и другими химическими свойствами, от которых зависит растворимость определяемых веществ. Одна из разновидностей распределительной хроматографии – газожидкостная хроматография (ГЖХ) с жидкой неподвижной фазой и газовой подвижной.
Вытеснительная хроматография. Неподвижная фаза представляет собой твердое пористое вещество. Крупные молекулы разделяемой смеси не проникают в поры и, не задерживаясь в неподвижной фазе, увлекаются растворителем. Молекулы среднего размера застревают в некоторых порах и на какое-то время остаются в неподвижной фазе, а мелкие молекулы проникают во все поры и перемещаются очень медленно. Так происходит разделение молекул по размерам, а следовательно, по молекулярной массе. Методом вытеснительной хроматографии можно разделять вещества с мол. массой от 100 до 100 000 000.
Ионообменная хроматография. Неподвижной фазой является ионит – твердое, практически нерастворимое в воде и органических растворителях вещество, содержащее ионогенные функциональные группы, способные обменивать свои ионы на ионы, присутствующие в подвижной фазе. Для разделения анионов (органических кислот, аминокислот или хлорид-, нитрат-, сульфат-ионов) используются аниониты, содержащие аминогруппу или четвертичный аммоний. В состав катионитов, применяемых для разделения катионов (аминокислот или ионов металлов), входят карбоновые или сульфокислоты.
Гель-хроматография является одним из видов вытеснительной хроматографии и основана на использовании различия в размерах молекул. Неподвижной фазой является растворитель, находящийся в порах геля, а подвижной – сам растворитель. В процессе гель-хроматографирования могут быть отделены крупные молекулы, которые гелем не сорбируются, так как их размеры превышают размеры пор геля, от мелких, которые проникают в поры, а затем могут быть элюированы.
Аффинная хроматография – метод очистки и разделения белков и других биомолекул, основанный на их избирательном взаимодействии с лигандом, ковалентно связанным с инертным носителем. Высокая эффективность разделения основана на образовании прочных комплексов биологических молекул типа ключ - замок: антитело – антиген, фермент – субстрат, гормон – рецептор, т.е. адсорбент-антитело связывает свой антиген, адсорбент-фермент – свой субстрат, адсорбент-рецептор – свой гормон, а остальные молекулы остаются в растворе.
Неподвижная фаза представляет собой специально получаемый сорбент, построенный по схеме: носитель (органический полимер, кремнозем, стекло) связан химической связью с ножкой (аминокислота, амин), которая связана с лигандом – молекулой, которая и связывает родственную молекулу из раствора. Ножка является мостом, связывающим лиганд с носителем. Этот мост нужен для того, чтобы носитель не мешал лиганду принять пространственную конфигурацию, позволяющую образовать прочный комплекс с родственной (копланарной) молекулой, находящейся в смеси.
СПЕКТРОСКОПИЯ
Спектроскопические методы основаны на взаимодействии электромагнитного излучения с веществом, т.е. на определении характеристик поглощаемого,… Основные положения.Электромагнитное излучение характеризуется энергией E,… E = hν= hc/λ, где h – постоянная Планка (6,63 . 10–34 Дж . с), c – скорость светаРис.7. Линейчатый (в), сплошной (б), полосатый спектр (г) и пучок электромагнитного излучения (а)
Диапазон энергий всего электромагнитного спектра очень широк. В табл. 4. приведены общепринятые названия типов излучения, указаны диапазоны их энергий и длин волн (сверху вниз типы излучения расположены в порядке увеличения длины волны излучения), а также типы переходов.
Таблица 4. Электромагнитный спектр
| Излучение | Длина волны | Энергия/Частота | Переход |
| Гамма-лучи | <0,1 Å | >100 кэВ | Ядерный |
| Рентгеновские лучи | 0,1–20 Å | 0,6–120 кэВ | Внутренние электроны |
| Ультрафиолетовое излучение | 1–400 нм | 3 эВ – 1,2 кэВ | Внешние электроны |
| Видимый свет | 400–800 нм | 1,5–3 эВ | Внешние электроны |
| Инфракрасный свет | 0,8–500 мкм | 20–12 500 см–1 | Колебания молекул |
| Микроволновое излучение | 1–300 мм | 1–300 ГГц | Вращение молекул |
| Радиоволны | 0,5–30 м | 10–600 МГц | Ядерный спин |
Методам, чаще всего используемым в аналитической химии, соответствуют ультрафиолетовая (УФ), видимая, инфракрасная (ИК) области, составляющие вместе оптическую область и радиоволны.
Выбор конкретного оборудования – источника излучения, монохроматора, детектора – зависит от длин волн используемого излучения и характера измерений. В УФ- и видимой областях в качестве источников света обычно используют лампы накаливания или лазеры, монохроматором служит щель или призма, а детектором – фотоэлектронный умножитель и блок фотодиодов.
Поглощение в УФ- и видимой областях
I = I0.10-eCl; T =I/I0; D =lg1/T = -lgT =lgI0/I = e.C.l где D – оптическая плотность, I0 и I – интенсивности падающего и прошедшего… Образцы, используемые в абсорбционной спектроскопии в УФ- и видимой областях, – это, как правило, разбавленные…Люминесценция
Поглотив квант энергии электромагнитного излучения частица вещества переходит из основного, самого нижнего по энергии (S0) электронного состояния, в… Рис. 8. Схематическое изображение физического механизма люминесценции: жирными черными горизонтальными линиями…Инфракрасная (ИК) спектроскопия
Таблица 5. Характеристические частоты колебаний некоторых групп
| Группа (тип колебаний) | Волновое число, см–1 |
| O–H (валентные) | 3350–3250 |
| N–H (валентные) | 3460–3280 |
| C–H (валентные) | 2980–2850 |
| C≡C (валентные) | 2300–2100 |
| C=O (валентные) | 1870–1650 |
| C=N (валентные) | 1620–1560 |
| C=C (валентные) | 1645–1615 |
| N–H (деформационные) | 1650–1590 |
| C–H (деформационные) | 1470–1360 |
| O–H (деформационные) | 1440–1260 |
Значения молярных коэффициентов экстинкции для ИК-области меньше, чем для видимой и УФ-областей, поэтому с помощью ИК-спектроскопии можно исследовать или чистые вещества, или очень концентрированные растворы. Жидкости заливают между оптически прозрачными стеклами, где они образуют тонкую пленку, или в кювету, твердые вещества измельчают и суспендируют в оптически прозрачной среде. Растворы исследовать сложнее, чем твердые вещества, поскольку растворитель часто поглощает в этой же области. Чтобы повысить чувствительность и разрешающую способность метода, в современных модификациях используют ИК-спектроскопию с фурье-преобразованием.
Ядерный магнитный резонанс (ЯМР)
Спектр ЯМР представляет собой зависимость интенсивности поглощения от относительной величины σ (химический сдвиг). Значения σ даются в миллионных долях (м.д.; в англоязычной литературе –… Перекрывание и расщепление сигналов существенно усложняют ЯМР-спектры. Для их упрощения используют более сильные…Масс-спектрометрия (МС)
Принцип метода состоит в том, что определяемое вещество переводят в газообразное состояние, ионизируют и образовавшиеся ионы (заряженные фрагменты… Масс-спектр представляет собой зависимость интенсивности сигнала от отношения… Способы ионизации. Выбор способа ионизации зависит от свойств определяемого вещества, матрицы, в которую оно включено,…Химические сенсоры
Сенсор – это первичное устройство, регистрирующее (откликающееся) на определенные свойства окружающей среды и позволяющее регистрировать этот отклик… Бывают физические, химические и биологические сенсоры. Физические определяют такие свойства как температура, давление, ускорение системы и пр.Решение типовых задач
Решение: Уравнение Бугера –Ламберта –Бера: D = ε . CM . l, откуда CM = D/(ε . l ) = 13.4/(13400 . 10) = 10-4 моль/л.Задачи для самостоятельного решения
Ответ: ∆Е = 3,7 . 10-19 Дж = 2,3 эВ = 222 кДж/моль = 53 ккал/моль, СМ = 5 . 10-5 моль/л. 2. Комплекс катиона кобальта с индикатором комплексонометрического титрования… Ответ: ∆Е = 3,1 . 10-19 Дж = 1,9 эВ = 187 кДж/моль = 45 ккал/моль, СМ = 7 . 10-5 моль/л.АНАЛИТИЧЕСКАЯ ПРОБА
Отбор проб веществ разного агрегатного состояния
Получение лабораторной пробы
Пробы можно хранить лишь определенное время - их хранят в холодильнике,…Разложение пробы
1) В воде многие неорганические и органические вещества растворяют. Используют водно-спиртовые и спиртовые растворители. 2) В этом методе чаще используют растворы кислот. Соляную кислоту применяют… 3) В качестве окислителей в этом методе используют азотную кислоту или царскую водку (смесь трех частей соляной и…Дополнение
Основные математические формулы, знание которых необходимо для решения задач по аналитической химии: рХ = -lgX, при этом Х = 10-рХ = 10lgX; логарифм числа 10n равен n т.е. lg10n =… Х-n = 1/Xn; 1/X = X-1, например:Л И Т Е Р А Т У Р А
2. Васильев В.П. Аналитическая химия. Т.2. Физико-химические методы анализа. Москва: Дрофа, 2004. – 383 С. 3. Васильев В.П., Кочергина Л. А., Орлова Т. Д. Аналитическая химия: Сборник… 4. Васильев В.П.,Морозова Р. П., Кочергина Л. А. Аналитическая химия: лабораторный практикум. Москва: Дрофа, 2006. –…ПРИЛОЖЕНИЕ
Константы диссоциации кислот в водном растворе при 250 С.
| Кислота | К1 | К2 |
| HI | 1·1011 | |
| HBr | 1·109 | |
| HCl | 1·107 | |
| H2SO4 | 1·103 | 1,2·10-2 |
| HNO3 | 4,36·10 | |
| HClO4 | 3,8·10 | |
| CCl3COOH | 2,2·10-2 | |
| H2SO3 | 1,58·10-2 | 6,31·10-8 |
| H3PO4 | 7,52·10-3 | 6,31·10-8 |
| HF | 6,61·10-4 | |
| HNO2 | 4·10-4 | |
| HCOOH | 1,77·10-4 | |
| CH3COOH | 1,754·10-5 | |
| H2CO3 | 4,45·10-7 | 4,69·10-11 |
| H2S | 6·10-8 | 1·10-14 |
| HClO | 5,01·10-8 | |
| HCN | 7,9·10-10 | |
| H4SiO4 | 1,6·10-10 | 1,9·10-12 |
| C6H5OH | 1,0·10-10 | |
| H2O | 1,8·10-16 |
Константы диссоциации оснований в водном растворе при 250 С.
| Основание | К1 | К2 |
| KOH | 2,9 | |
| NaOH | 1,5 | |
| LiOH | 0,44 | |
| Ba(OH)2 | 0,23 | |
| Sr(OH)2 | 0,15 | |
| Ca(OH)2 | 4,3·10-2 | |
| Mg(OH)2 | 2,5·10-3 | |
| Fe(OH)2 | 1,2·10-2 | 5,5·10-8 |
| CH3NH2 | 4,2·10-4 | |
| NH3 | 1,7·10-5 | |
| Zn(OH)2 | 1,3·10-5 | 4,9·10-7 |
| Al(OH)3 | 8,3·10-9 | 2,1·10‑9 |
| C6H5NH2 | 3,8·10-10 | |
| Fe(OH)3 | 4,8·10-11 | 1,8·10‑11 |
Произведения растворимости (ПР) (водная среда, 25 oС)
| Вещество | ПР | Вещество | ПР | Вещество | ПР | ||
| AgBr | 5,0.10-13 | AgBrO3 | 5,8.10-5 | Ag2CO3 | 8,7.10-12 | ||
| Ag2C2O4 | 1,1.10-11 | AgCl | 1,8.10-10 | Ag2CrO4 | 1,2.10-12 | ||
| Ag2Cr2O7 | 2,0.10-7 | AgI | 2,3.10-16 | Ag2S | 7,2.10-50 | ||
| Al(OH)3 | 5,7.10-32 | BaCO3 | 4,9.10-9 | BaCrO4 | 1,1.10-10 | ||
| BaSO3 | 8,0.10-7 | BaSO4 | 1,8.10-10 | BaWO4 | 5,0.10-9 | ||
| Be(OH)2 | 8,0.10-22 | Bi(OH)3 | 3,0.10-36 | Bi2S3 | 8,9.10-105 | ||
| CaCO3 | 4,4.10-9 | CaF2 | 4,0.10-11 | Ca(IO3)2 | 1,9.10-6 | ||
| CaSO4 | 3,7.10-5 | CaWO4 | 1,6.10-9 | Cd(OH)2 | 2,2.10-14 | ||
| CdS | 6,5.10-28 | Co(OH)2 | 1,6.10-15 | CoS | 1,8.10-20 | ||
| Cr(OH)3 | 1,1.10-30 | CuCN | 3,2.10-20 | CuCl | 2,2.10-7 | ||
| CuI | 1,1.10-12 | Cu(OH)2 | 5,6.10-20 | CuS | 1,4.10-36 | ||
| Fe(OH)2 | 7,9.10-16 | FeO(OH)* | 2,2.10-42 | FeS | 3,4.10-17 | ||
| Hg2Br2** | 7,9.10-23 | Hg2Cl2** | 1,5.10-18 | Hg2I2** | 5,4.10-29 | ||
| HgS | 1,4.10-45 | KIO4 | 8,3.10-4 | Li2CO3 | 1,9.10-3 | ||
| LiF | 1,5.10-3 | Li3PO4 | 3,2.10-9 | MgF2 | 6,4.10-9 | ||
| Mg(OH)2 | 6,0.10-10 | Mn(OH)2 | 2,3.10-13 | MnS | 2,5.10-10 | ||
| Ni(OH)2 | 1,6.10-14 | NiS | 9,3.10-22 | PbBr2 | 5,0.10-5 | ||
| Pb(BrO3)2 | 1,6.10-4 | PbC2O4 | 7,3.10-11 | PbCl2 | 1,7.10-5 | ||
| PbCrO4 | 2,8.10-13 | PbF2 | 2,7.10-8 | PbI2 | 8,7.10-9 | ||
| Pb(OH)2 | 5,5.10-16 | PbS | 8,7.10-29 | PbSO4 | 1,7.10-8 | ||
| RaSO4 | 4,3.10-11 | SnS | 3,0.10-28 | SrCrO4 | 2,7.10-5 | ||
| SrSO4 | 2,1.10-7 | Tl2CO3 | 4,0.10-3 | TlCl | 1,9.10-4 | ||
| Tl2CrO4 | 1,0.10-12 | Tl2S | 3,0.10-9 | Tl2SO4 | 1,5.10-4 | ||
| Zn(OH)2 | 3,0.10-16 | ZnS | 7,9.10-24 |
Стандартные электродные потенциалы окислительно-восстановительных систем
Константы устойчивости комплексных соединений
Аналитическая химия
1. Аналитическая химия (аналитика) и химический анализ. Классификация методов… 2. Что такое моль и эквивалент вещества, число и фактор эквивалентности? Закон эквивалентов для растворов реагирующих…Варианты контрольных работ
Для успешного выполнения контрольной работы необходимо усвоить теоретический материал и разобраться с решением типовых задач. {В скобках указан раздел, номер условия и решения аналогичнойзадачи}
Вариант 1
1. Электрохимические методы анализа. Индикаторный электрод. Сущность кондуктометрического метода. Какой параметр, зависящий от концентрации определяемого компонента, измеряется?
2. На титрование 100 мл раствора смеси серной и фосфорной кислоты с использованием в качестве индикатора метилового оранжевого пошло 300 мл 0,1 н раствора гидроксида натрия. На титрование 100 мл той же смеси кислот с использованием в качестве индикатора фенолфталеина пошло 400 мл 0,1 н раствора гидроксида натрия. Определить молярные концентрации серной и фосфорной кислот в растворе. { Раздел 7.8, задачи №6 и №4 }
3. Гравиметрический метод. Гравиметрический фактор. Рассчитать минимальную концентрацию хлорид-аниона (Cl-) при которой серебро количественно осадится из раствора в виде хлорида серебра (AgCl)? ПР(AgCl)= 10-10. { Раздел5.5, задача №1 }
4. Хроматографические методы анализа. Газовая хроматография.
5. Спектральные методы. Оптические спектры. Спектры ЯМР, ЭПР. Вырожденные состояния. Закон Бугера-Ламберта-Бера.
6. Сколько грамм а) гидроксида кальция, б) ацетата натрия надо взять, чтобы приготовить два раствора этих веществ по 500 мл каждого и концентрацией 0,001 N (молярная концентрация эквивалентов)? Какова процентная концентрация (массовая доля) данного вещества в каждом растворе (плотность раствора равна единице)? { Раздел6.3, задачи №1 и №2}
7. Определить рН 0,01 М раствора NaOH, а также 0,001 М раствора уксусной кислоты Кд= 10-5. { Раздел 4.4 }
8. Каким будет рН раствора в точке эквивалентности при титровании 0,1 н раствора синильной кислоты HCN (Kд = 10-9 ) 0,1н раствором NaOH.
{ Раздел7.4, пункт 3) }
9. Определить потенциал водородного электрода раствора, содержащего 0,1 моль в литре уксусной кислоты и 0,1 моль уксуснокислого натрия. Кд=10-5
10. Рассчитать потенциал цинкового электрода опущенного в 0,01 М раствор нитрата цинка, содержащего 1,04 моль аммиака в 1л раствора. Константа устойчивости комплексного иона [Zn (NH3)4]+2 равна 1010. E0Zn2+/Zn0 = - 0,8B.
{ Раздел10.3, задача №2, первая половина }
10а Рассчитать потенциал серебряного электрода, опущенного в раствор, на дне которого имеется осадок бромида серебра и 1моль в литре бромистого натрия. ПР (бромида серебра AgBr) = 10-13 , Е0 Ag+/Ag0= 0,8B.
{ Раздел10.3, задача №2, вторая половина }
Вариант 2
1. Электрохимические методы анализа. Электрод сравнения. Сущность кулонометрического метода анализа. Какой параметр, зависящий от концентрации определяемого компонента, измеряется?
2. На титрование 100 мл раствора смеси серной и фосфорной кислоты с использованием в качестве индикатора метилового оранжевого пошло 400 мл 0,1 н раствора гидроксида натрия. На титрование 100 мл той же смеси кислот с использованием в качестве индикатора фенолфталеина пошло 600 мл 0,1 н раствора гидроксида натрия. Определить молярные концентрации серной и фосфорной кислот в растворе. { Раздел 7.8, задачи №6 и №4 }
3. Гравиметрический метод. Гравиметрический фактор. Рассчитать минимальную концентрацию арсенат-аниона (AsO43-) при которой серебро количественно осадится из раствора в виде хлорида серебра (Ag3AsO4)? ПР(Ag3AsO4)= 10-22. { Раздел5.5, задача №1 }
4.Спектральные методы. Основное и возбужденное состояние атомов и молекул. Вырожденные состояния. Электронные спектры. Молярный коэффициент поглощения или коэффициент экстинкции. Что такое спектры поглощения и эмиссионные спектры.
5. Хроматографические методы анализа. Аффинная хроматография.
6. Сколько грамм а) сульфита натрия б) ацетата натрия надо взять, чтобы приготовить два раствора этих веществ по 500 мл каждого и концентрацией 0,001 N (молярная концентрация эквивалентов)? Какова процентная концентрация (массовая доля) данного вещества в каждом растворе (плотность раствора равна единице)? { Раздел6.3, задачи №1 и №2}
7. Определить рН а) 0,0001М раствора HCl, б) 0,1 М раствора аммиака Кд(NH4OH) =10-5. { раздел 4.4}
8. Рассчитать потенциал цинкового электрода опущенного в 0,1 М раствор нитрата цинка, содержащего 1,4 моль аммиака в 1л раствора. Константа устойчивости комплексного иона [Zn (NH3)4]+2 равна 1010 .E0Zn2+/Zn0 = - 0,8B.
{ Раздел10.3, задача №2, первая половина }
9. Каким будет рН раствора в точке эквивалентности при титровании 0,1н раствора синильной кислоты HCN (Kд = 10-9) 0,1н раствором NaOH ?
{ Раздел7.4, пункт 3) }
10. Определить потенциал серебряного электрода опущенного в раствор, содержащий на дне сосуда осадок соли серебра Ag3AsO4 (ПР=10-22) и 0,1М Na3AsO4. E0Ag+/Ag=0,8B. { Раздел10.3, задача №2, вторая половина }
Вариант 3
1. Электрохимические методы анализа. Индикаторный электрод. Сущность амперометрического метода анализа. Какой параметр, зависящий от концентрации определяемого компонента, измеряется?
2. По какой формуле определяется электродный потенциал в точке эквивалентности при окислительно-восстановительном титровании? Жесткость воды. В чем измеряется, как определяется и как устраняется?
3. Гравиметрический метод. Гравиметрический фактор. Рассчитать минимальную концентрацию иодид-аниона (I-) при которой серебро количественно осадится из раствора в виде иодида серебра (AgI)?
ПР(AgI)= 10-16. { Раздел5.5, задача №1 }
4. Хроматографические методы анализа. Ионообменная хроматография.
5.Спектральные методы. Основное и возбужденное состояние атомов и молекул. Колебательные спектры. Оптические спектры. Закон Бугера-Ламберта-Бера. Чем отличаются спектры атомов и молекул. Что такое спектры поглощения и эмиссионные спектры.
На титрование 100 мл раствора смеси серной и фосфорной кислоты с использованием в качестве индикатора метилового оранжевого пошло 250 мл 0,1 н раствора гидроксида натрия. На титрование 100 мл той же смеси кислот с использованием в качестве индикатора фенолфталеина пошло 300 мл 0,1 н раствора гидроксида натрия. Определить молярные концентрации серной и фосфорной кислот в растворе. { Раздел 7.8, задачи №6 и №4 }
6. Сколько грамм а) сульфита натрия б) сульфата натрия надо взять, чтобы приготовить два раствора этих веществ по 500 мл каждого и концентрацией 0,001 N (молярная концентрация эквивалентов)? Какова процентная концентрация (массовая доля) данного вещества в каждом растворе (плотность раствора равна единице)? { Раздел6.3, задачи №1 и №2 }
Определить рН 0,01 М раствора NaOH, 0,001 М раствора уксусной кислоты Кд(CH3COOH) =10-5. { раздел 4.4}
7. Определить потенциал водородного электрода раствора, содержащего 0,01 моль в литре уксусной кислоты и 1 моль уксуснокислого натрия. Кд(CH3COOH) =10-5.
8. Рассчитать потенциал цинкового электрода опущенного в 0,001 М раствор нитрата цинка, содержащего 1,004 моль аммиака в 1л раствора. Константа устойчивости комплексного иона
[Zn (NH3)4]+2 равна 1011 . E0Zn2+/Zn0 = - 0,8B.
{ Раздел10.3, задача №2, первая половина }
9. Каким будет рН раствора в точке эквивалентности при титровании 0,1 н раствора NH3 (Кд=10-5) 0,1 н раствором соляной кислоты?
{ Раздел7.4, пункт 3) }
10. Определить потенциал серебряного электрода опущенного в раствор, содержащий на дне сосуда осадок соли серебра Ag3PO4 (ПР=10-21) и 1М Na3РO4 .E0Ag+/Ag=0,8B. { Раздел10.3, задача №2, вторая половина }
Вариант 4
1. Электрохимические методы анализа. Электрод сравнения. Сущность потенциометрического метода анализа. Какой параметр, зависящий от концентрации определяемого компонента, измеряется?
2. Что такое скачек кривой титрования? Какими точками на кривой титрования он ограничен? Определение рН в точке эквивалентности при титровании слабого основания сильной кислотой. По какой формуле определяется электродный потенциал в точке эквивалентности при окислительно-восстановительном титровании? Жесткость воды. В чем измеряется, как определяется и как устраняется?
3. Гравиметрический метод. Гравиметрический фактор. Рассчитать минимальную концентрацию цианид-аниона (CN-) при которой серебро количественно осадится из раствора в виде хлорида серебра (AgCN)? ПР(AgCN)= 10-16. { Раздел5.5, задача №1 }
4. Хроматографические методы анализа. Гель-хроматография.
Спектральные методы. Основное и возбужденное состояние атомов и молекул. Оптические спектры. Закон Бугера-Ламберта-Бера. Чем отличаются спектры атомов и молекул.
5. На титрование 100 мл раствора смеси серной и фосфорной кислоты с использованием в качестве индикатора метилового оранжевого пошло 250 мл 0,1 н раствора гидроксида натрия. На титрование 100 мл той же смеси кислот с использованием в качестве индикатора фенолфталеина пошло 300 мл 0,1 н раствора гидроксида натрия. Определить молярные концентрации серной и фосфорной кислот в растворе. { Раздел 7.8, задачи №6 и №4 }
6. Сколько грамм а) сульфида натрия б) сульфата калия надо взять, чтобы приготовить два раствора этих веществ по 500 мл каждого и концентрацией 0,001 N (молярная концентрация эквивалентов)? Какова процентная концентрация (массовая доля) данного вещества в каждом растворе (плотность раствора равна единице)? { Раздел6.3, задачи №1 и №2 }
7. Определить рН а) 0,01 М раствора NaOH, б) 0,001 М раствора уксусной кислоты Кд(CH3COOH) =10-5. { раздел 4.4}
8. Рассчитать потенциал цинкового электрода опущенного в 0,1 М раствор нитрата цинка, содержащего 1,4 моль аммиака в 1 л раствора. Константа устойчивости комплексного иона [Zn (NH3)4]+2 равна 1012. E0Zn2+/Zn0 = - 0,8B.
{ Раздел10.3, задача №2, первая половина }
9. Каким будет рН раствора в точке эквивалентности при титровании 0,1 М раствора уксусной кислоты (Кд(CH3COOH) =10-5) 0,1 н раствором NaOH?
{ Раздел7.4, пункт 3) }
10. Определить потенциал серебряного электрода опущенного в раствор, содержащий на дне сосуда осадок соли серебра Ag2S (ПР=10-49) и 0,1 М Na2S. E0Ag+/Ag=0,8B. { Раздел10.3, задача №2, вторая половина }
Вариант 5
1. Электрохимические методы анализа. Индикаторный электрод. Сущность потенциометрического метода анализа. Какой параметр, зависящий от концентрации определяемого компонента, измеряется?
2. Определение рН в точке эквивалентности при титровании сильной кислоты сильным основанием. По какой формуле определяется электродный потенциал в точке эквивалентности при окислительно-восстановительном титровании? Жесткость воды. В чем измеряется, как определяется и как устраняется?
3. Гравиметрический метод. Гравиметрический фактор. Рассчитать минимальную концентрацию фосфат-аниона (PO4-3) при которой серебро количественно осадится из раствора в виде фосфата серебра (Ag3PO4)? ПР(Ag3PO4)= 10-20. { Раздел5.5, задача №1 }
4. Хроматографические методы анализа. Газовая, жидкостная хроматография. Ионообменная , гель-хроматография, тонкослойная.
На титрование 100 мл раствора смеси серной и фосфорной кислоты с использованием в качестве индикатора метилового оранжевого пошло 600 мл 0,1 н раствора гидроксида натрия. На титрование 100 мл той же смеси кислот с использованием в качестве индикатора фенолфталеина пошло 800 мл 0,1 н раствора гидроксида натрия. Определить молярные концентрации серной и фосфорной кислот в растворе. { Раздел 7.8, задачи №6 и №4 }
5. Сколько грамм а) сульфида натрия б) сульфата калия надо взять, чтобы приготовить два раствора этих веществ по 500 мл каждого и концентрацией 0,001 N (молярная концентрация эквивалентов)? Какова процентная концентрация (массовая доля) данного вещества в каждом растворе (плотность раствора равна единице)? { Раздел6.3, задачи №1 и №2 }
6. Определить рН а) 0,001 М раствора NaOH, б) 0,001 М раствора уксусной кислоты. Кд(CH3COOH) =10-5. { раздел 4.4}
7. Определить потенциал водородного электрода раствора, содержащего 0,1 моль в литре уксусной кислоты и 0,01 моль уксуснокислого натрия. Кд(CH3COOH) =10-5.
8. Рассчитать потенциал цинкового электрода опущенного в 0,001 М раствор нитрата цинка, содержащего 1,004 моль аммиака в 1 л раствора. Константа устойчивости комплексного иона
[Zn (NH3)4]+2 равна 109. E0Zn2+/Zn0 = - 0,8B.
{ Раздел10.3, задача №2, первая половина }
9. Каким будет рН раствора в точке эквивалентности при титровании 0,1 н раствора фенола Кд=10-11 0,1 н раствором NaOH? { Раздел7.4, пункт 3) }
10. Определить потенциал серебряного электрода опущенного в раствор, содержащий на дне сосуда осадок соли серебра AgSCN (ПР=10-12) и 1N NaSCN. E0Ag+/Ag=0,8B. { Раздел10.3, задача №2, вторая половина }
Вариант 6
1. Электрохимические методы анализа. Электрод сравнения. Сущность кондуктометрического метода анализа. Какой параметр, зависящий от концентрации определяемого компонента, измеряется?
2. Что такое скачек кривой титрования? Какими точками на кривой титрования он ограничен? Определение рН в точке эквивалентности при титровании сильной кислоты сильным основанием. По какой формуле определяется электродный потенциал в точке эквивалентности при окислительно-восстановительном титровании? Жесткость воды. В чем измеряется, как определяется и как устраняется?
3. Гравиметрический метод. Гравиметрический фактор. Рассчитать минимальную концентрацию сульфид-аниона (S-2) при которой серебро количественно осадится из раствора в виде сульфида серебра (Ag2S)? ПР(Ag2S)= 10-50. { Раздел5.5, задача №1 }
4. Хроматографические методы анализа. Жидкостная хроматография.
На титрование 100 мл раствора смеси серной и фосфорной кислоты с использованием в качестве индикатора метилового оранжевого пошло 200 мл 0,1 н раствора гидроксида натрия. На титрование 100 мл той же смеси кислот с использованием в качестве индикатора фенолфталеина пошло 300 мл 0,1 н раствора гидроксида натрия. Определить молярные концентрации серной и фосфорной кислот в растворе. { Раздел 7.8, задачи №6 и №4 }
5. Сколько грамм а) сульфита натрия б) сульфида калия надо взять, чтобы приготовить два раствора этих веществ по 500 мл каждого и концентрацией 0,001 N (молярная концентрация эквивалентов)? Какова процентная концентрация (массовая доля) данного вещества в каждом растворе (плотность раствора равна единице)? { Раздел6.3, задачи №1 и №2}
6. Определить рН а) HCl 0,001 М, б) 0,1 М раствора аммиака Кд(NH4OH) =10-5. { раздел 4.4}
7. Определить потенциал водородного электрода раствора, содержащего 0,01 моль в литре уксусной кислоты и 0,1 моль уксуснокислого натрия. Кд(СН3СООН) =10-5
8. Рассчитать потенциал цинкового электрода опущенного в 0,01 М раствор нитрата цинка, содержащего 1,04 моль аммиака в 1л раствора. Константа устойчивости комплексного иона [Zn (NH3)4]+2 равна 1010. E0Zn2+/Zn0 = - 0,8B.
{ Раздел10.3, задача №2, первая половина }
9. Каким будет рН раствора в точке эквивалентности при титровании 0,1н раствора хлорноватистой кислоты HClO (Кд=10-7) 0,1 н раствором NaOH?
{ Раздел7.4, пункт 3) }
10. Определить потенциал серебряного электрода опущенного в раствор, содержащий на дне сосуда осадок соли серебра Ag2SO3 (ПР=10-14) и 1М Na2SO3. E0Ag+/Ag=0,8B. { Раздел10.3, задача №2, вторая половина }
Вариант 7
1. Электрохимические методы анализа. Индикаторный электрод. Сущность кулонометрического метода анализа. Какой параметр, зависящий от концентрации определяемого компонента, измеряется?
2. Определение рН в точке эквивалентности при титровании слабой кислоты сильным основанием. Жесткость воды. В чем измеряется, как определяется и как устраняется?
3. Гравиметрический метод. Гравиметрический фактор. Рассчитать минимальную концентрацию бромид-аниона (Br-) при которой серебро количественно осадится из раствора в виде бромида серебра (AgBr)? ПР(AgBr)= 10-13. { Раздел5.5, задача №1 }
4. На титрование 100 мл раствора смеси серной и фосфорной кислоты с использованием в качестве индикатора метилового оранжевого пошло 300 мл 0,1 н раствора гидроксида натрия. На титрование 100 мл той же смеси кислот с использованием в качестве индикатора фенолфталеина пошло 400 мл 0,1 н раствора гидроксида натрия. Определить молярные концентрации серной и фосфорной кислот в растворе. { Раздел 7.8, задачи №6 и №4 }
5. Сколько грамм а) гидроксида кальция б) карбоната натрия надо взять, чтобы приготовить два раствора этих веществ по 500 мл каждого и концентрацией 0,001 N (молярная концентрация эквивалентов)? Какова процентная концентрация (массовая доля) данного вещества в каждом растворе (плотность раствора равна единице)? { Раздел6.3, задачи №1 и №2 }
6. Определить рН а) 0,01 М раствора NaOH, б) 0,0001М раствора. { раздел 4.4}
7. Определить потенциал водородного электрода раствора, содержащего 0,1 моль в литре уксусной кислоты и 0,001 моль уксуснокислого натрия Кд(CH3COOH) =10-5.
8. Рассчитать потенциал цинкового электрода опущенного в 0,1 М раствор нитрата цинка, содержащего 1,4 моль аммиака в 1л раствора. Константа устойчивости комплексного иона [Zn (NH3)4]+2 равна 1011 . E0Zn2+/Zn0 = - 0,8B.
{ Раздел10.3, задача №2, первая половина }
9. Каким будет рН раствора в точке эквивалентности при титровании 0,1 н раствора циановой HOCN (Кд=10-3) 0,1н раствором NaOH.
{ Раздел7.4, пункт 3) }
10. Определить потенциал серебряного электрода опущенного в раствор, содержащий на дне сосуда осадок соли серебра AgI (ПР=10-17) и 0,1N NaI. E0Ag+/Ag=0,8B. { Раздел10.3, задача №2, вторая половина }
Вариант 8
1. Электрохимические методы анализа. Электрод сравнения. Сущность амперометрического метода анализа. Какой параметр, зависящий от концентрации определяемого компонента, измеряется?
2 Что такое скачек кривой титрования? Какими точками на кривой титрования он ограничен? Определение рН в точке эквивалентности при титровании слабого основания сильной кислотой. По какой формуле определяется электродный потенциал в точке эквивалентности при окислительно-восстановительном титровании?
3. Гравиметрический метод. Гравиметрический фактор. Рассчитать минимальную концентрацию роданид-аниона (SCN-) при которой серебро количественно осадится из раствора в виде роданистого серебра (AgSCN)? ПР(AgSCN)= 10-12. { Раздел5.5, задача №1 }
4. Спектральные методы. Основное и возбужденное состояние атомов и молекул. Оптические спектры. Закон Бугера-Ламберта-Бера. Что такое спектры поглощения и эмиссионные спектры.
На титрование 100 мл раствора смеси серной и фосфорной кислоты с использованием в качестве индикатора метилового оранжевого пошло 400 мл 0,1 н раствора гидроксида натрия. На титрование 100 мл той же смеси кислот с использованием в качестве индикатора фенолфталеина пошло 600 мл 0,1 н раствора гидроксида натрия. Определить молярные концентрации серной и фосфорной кислот в растворе. { Раздел 7.8, задачи №6 и №4 }
5. Сколько грамм а) нитрата серебра б) сульфата меди надо взять, чтобы приготовить два раствора этих веществ по 500 мл каждого и концентрацией 0,001 N (молярная концентрация эквивалентов)? Какова процентная концентрация (массовая доля) данного вещества в каждом растворе (плотность раствора равна единице)? { Раздел6.3, задачи №1 и №2}
6. Определить рН а) 0,0001М раствора HCl, б) 0,1 М раствора аммиака Кд(NH4OH) =10-5. { раздел 4.4}
7. Определить потенциал водородного электрода раствора, содержащего 0,1 моль в литре уксусной кислоты и 0,1 моль уксуснокислого натрия. Кд(CH3COOH) =10-5.
8. Рассчитать потенциал цинкового электрода опущенного в 0,001 М раствор нитрата цинка, содержащего 1,004 моль аммиака в 1л раствора. Константа устойчивости комплексного иона [Zn (NH3)4]+2 равна 1011. E0Zn2+/Zn0 = - 0,8B.
{ Раздел10.3, задача №2, первая половина }
9. Каким будет рН раствора в точке эквивалентности при титровании 0,1н раствора хлоруксусной ClCH2COOH (Кд=10-3) 0,1н раствором NaOH?
{ Раздел7.4, пункт 3) }
10. Определить потенциал серебряного электрода опущенного в раствор, содержащий на дне сосуда осадок соли серебра AgCl (ПР=10-10) 1N NaCl. E0Ag+/Ag=0,8B. { Раздел10.3, задача №2, вторая половина }
Вариант 9
1. Электрохимические методы анализа. Электрод сравнения. Сущность потенциометрического метода анализа. Какой параметр, зависящий от концентрации определяемого компонента, измеряется?
2. Что такое скачек кривой титрования? Какими точками на кривой титрования он ограничен? Определение рН в точке эквивалентности при титровании сильной кислоты сильным основанием. По какой формуле определяется электродный потенциал в точке эквивалентности при окислительно-восстановительном титровании?
3. Гравиметрический метод. Гравиметрический фактор. Рассчитать минимальную концентрацию сульфит-аниона (SO3-2) при которой серебро количественно осадится из раствора в виде сульфита серебра (Ag2SO3)? ПР(Ag2SO3)= 10-14. { Раздел5.5, задача №1 }
4. Спектральные методы. Закон Бугера-Ламберта-Бера. Чем отличаются спектры атомов и молекул.
5. На титрование 100 мл раствора смеси серной и фосфорной кислоты с использованием в качестве индикатора метилового оранжевого пошло 600 мл 0,1 н раствора гидроксида натрия. На титрование 100 мл той же смеси кислот с использованием в качестве индикатора фенолфталеина пошло 800 мл 0,1 н раствора гидроксида натрия. Определить молярные концентрации серной и фосфорной кислот в растворе. { Раздел 7.8, задачи №6 и №4 }
6. Сколько грамм а) фосфата натрия б) сульфата натрия надо взять, чтобы приготовить два раствора этих веществ по 500 мл каждого и концентрацией 0,001 N (молярная концентрация эквивалентов)? Какова процентная концентрация (массовая доля) данного вещества в каждом растворе (плотность раствора равна единице)? { Раздел6.3, задачи №1 и №2 }
7. Определить рН а) 0,01 М раствора NaOH, б) 0,1 М раствора аммиака Кд(NH4OH) =10-5. { раздел 4.4}
8. Рассчитать потенциал цинкового электрода опущенного в 0,01 М раствор нитрата цинка, содержащего 1,04 моль аммиака в 1л раствора. Константа устойчивости комплексного иона [Zn (NH3)4]+2 равна 1012. E0Zn2+/Zn0 = - 0,8B.
{ Раздел10.3, задача №2, первая половина }
9. Каким будет рН раствора в точке эквивалентности при титровании 0,1н раствора хлористой кислоты HClO2 0,1н раствором NaOH? Кд (HClO2) = 10-7.
{ Раздел7.4, пункт 3) }
10. Определить потенциал серебряного электрода опущенного в раствор, содержащий на дне сосуда осадок соли серебра Ag3AsO4 (ПР=10-22) и 0,1М Na3AsO4. E0Ag+/Ag=0,8B. { Раздел10.3, задача №2, вторая половина }
Вариант 10
1. Электрохимические методы анализа. Индикаторный электрод и электрод сравнения. Сущность кондуктометрического, метода анализа. Какой параметр, зависящий от концентрации определяемого компонента, измеряется?
2. Что такое интервал перехода окраски индикатора? Определение рН в точке эквивалентности при титровании слабой кислоты сильным основанием. По какой формуле определяется электродный потенциал в точке эквивалентности при окислительно-восстановительном титровании.? Жесткость воды. В чем измеряется, как определяется и как устраняется?
3. Гравиметрический метод. Гравиметрический фактор. Рассчитать минимальную концентрацию гексацианоферрат-аниона [Fe(CN)6]-4 при которой серебро количественно осадится из раствора в виде гексацианоферрата серебра Ag4[Fe(CN)6]? ПР(Ag4[Fe(CN)6]) = 10-44 . { Раздел5.5, задача №1 }
4. Хроматографические методы анализа. тонкослойная.
Спектральные методы. Вырожденные состояния. Закон Бугера-Ламберта-Бера. Чем отличаются спектры атомов и молекул.
4. На титрование 100 мл раствора смеси серной и фосфорной кислоты с использованием в качестве индикатора метилового оранжевого пошло 250 мл 0,1 н раствора гидроксида натрия. На титрование 100 мл той же смеси кислот с использованием в качестве индикатора фенолфталеина пошло 300 мл 0,1 н раствора гидроксида натрия. Определить молярные концентрации серной и фосфорной кислот в растворе. { Раздел 7.8, задачи №6 и №4 }
5. Сколько грамм а) гидроксида кальция б) нитрата серебра надо взять, чтобы приготовить два раствора этих веществ по 500 мл каждого и концентрацией 0,001 N (молярная концентрация эквивалентов)? Какова процентная концентрация (массовая доля) данного вещества в каждом растворе (плотность раствора равна единице)? { Раздел6.3, задачи №1 и №2 }
6. Определить рН а) 0,01 М раствора NaOH, б) 0,1 М раствора аммиака Кд(NH4OH) =10-5. { раздел 4.4}
7. Определить потенциал водородного электрода раствора, содержащего 0,1 моль в литре уксусной кислоты и 1 моль уксуснокислого натрия. Кд(CH3COOH) =10-5.
8. Рассчитать потенциал цинкового электрода опущенного в 0,1 М раствор нитрата цинка, содержащего 1,4 моль аммиака в 1л раствора. Константа устойчивости комплексного иона [Zn (NH3)4]+2 равна 109. E0Zn2+/Zn0 = - 0,8B.
{ Раздел10.3, задача №2, первая половина }
9. Рассчитать потенциал серебряного электрода, опущенного в раствор, на дне которого имеется осадок бромида серебра и 1моль в литре бромистого натрия. ПР (бромида серебра AgBr) = 10-13 , Е0 Ag+/Ag0= 0,8B.
{ Раздел10.3, задача №2, вторая половина }
10. Каким будет рН раствора в точке эквивалентности при титровании 0,1н раствора салициловой кислоты (Кд=10-3) 0,1н раствором гидроксида натрия?
{ Раздел7.4, пункт 3) }
Вариант 11
1. Электрохимические методы анализа. Индикаторный электрод. Сущность кулонометрического метода анализа. Какой параметр, зависящий от концентрации определяемого компонента, измеряется?
2. Что такое скачек кривой титрования? Какими точками на кривой титрования он ограничен? Определение рН в точке эквивалентности при титровании сильной кислоты сильным основанием По какой формуле определяется электродный потенциал в точке эквивалентности при окислительно-восстановительном титровании.?
3. Гравиметрический метод. Гравиметрический фактор. . Рассчитать минимальную концентрацию гексацианоферрат-аниона [Fe(CN)6]-3 при которой серебро количественно осадится из раствора в виде гексацианоферрата серебра Ag3[Fe(CN)6]? ПР(Ag3[Fe(CN)6]) = 10-22. { Раздел5.5, задача №1 }
4. Хроматографические методы анализа. Газовая хроматография.
Спектральные методы. Основное и возбужденное состояние атомов и молекул. Электронные спектры. Коэффициент пропускания. Молярный коэффициент поглощения или коэффициент экстинкции. Чем отличаются спектры атомов и молекул.
4а. На титрование 100 мл раствора смеси серной и фосфорной кислоты с использованием в качестве индикатора метилового оранжевого пошло 150 мл 0,1 н раствора гидроксида натрия. На титрование 100 мл той же смеси кислот с использованием в качестве индикатора фенолфталеина пошло 200 мл 0,1 н раствора гидроксида натрия. Определить молярные концентрации серной и фосфорной кислот в растворе. { Раздел 7.8, задачи №6 и №4 }
5. Сколько грамм а) сульфита натрия б) карбоната натрия надо взять, чтобы приготовить два раствора этих веществ по 500 мл каждого и концентрацией 0,001 N (молярная концентрация эквивалентов)? Какова процентная концентрация (массовая доля) данного вещества в каждом растворе (плотность раствора равна единице)? { Раздел6.3, задачи №1 и №2 }
6. Определить рН а) 0,01М раствора NaOH, б) 0,001М раствора уксусной кислоты Кд(CH3COOH) =10-5. { раздел 4.4}
7. Определить потенциал водородного электрода раствора, содержащего 0,1 моль в литре уксусной кислоты и 1 моль уксуснокислого натрия.
8. Рассчитать потенциал цинкового электрода опущенного в 0,001 М раствор нитрата цинка, содержащего 1,004 моль аммиака в 1л раствора. Константа устойчивости комплексного иона [Zn (NH3)4]+2 равна 1010. E0Zn2+/Zn0 = - 0,8B.
{ Раздел10.3, задача №2, первая половина }
9. Каким будет рН раствора в точке эквивалентности при титровании 0,1 н раствора салициловой кислоты (Кд=10-3) 0,1н раствором NaOH
{ Раздел7.4, пункт 3) }
10. Определить потенциал серебряного электрода опущенного в раствор, содержащий на дне сосуда осадок соли серебра Ag3PO4 (ПР=10-21) и 1М Na3РO4. E0Ag+/Ag=0,8B. { Раздел10.3, задача №2, вторая половина }
Вариант 12
1. Электрохимические методы анализа. Индикаторный электрод. Сущность кондуктометрического метода. Какой параметр, зависящий от концентрации определяемого компонента, измеряется?
2. Определение рН в точке эквивалентности при титровании сильной кислоты сильным основанием, слабого основания сильной кислотой.
3. Гравиметрический метод. Гравиметрический фактор. Рассчитать минимальную концентрацию хлорид-аниона (Cl-) при которой серебро количественно осадится из раствора в виде хлорида серебра (AgCl)? ПР(AgCl)= 10-10{ Раздел5.5, задача №1 }.
4. Спектральные методы. Оптические спектры. Спектры ЯМР, ЭПР. Вырожденные состояния.
4а. На титрование 100 мл раствора смеси серной и фосфорной кислоты с использованием в качестве индикатора метилового оранжевого пошло 30 мл 0,1 н раствора гидроксида натрия. На титрование 100 мл той же смеси кислот с использованием в качестве индикатора фенолфталеина пошло 40 мл 0,1 н раствора гидроксида натрия. Определить молярные концентрации серной и фосфорной кислот в растворе. { Раздел 7.8, задачи №6 и №4 }
5. Сколько грамм а) сульфита натрия б) гидроксида кальция надо взять, чтобы приготовить два раствора этих веществ по 500 мл каждого и концентрацией 0,001 N (молярная концентрация эквивалентов)? Какова процентная концентрация (массовая доля) данного вещества в каждом растворе (плотность раствора равна единице)? { раздел 4.4}
6. Определить рН а) 0,01 М раствора NaOH, б) 0,001 М раствора уксусной кислоты Кд(CH3COOH) =10-5.
7. Каким будет рН раствора в точке эквивалентности при титровании 0,1н раствора синильной кислоты HCN (Kд = 10-9 ) 0,1 н раствором NaOH?
{ Раздел7.4, пункт 3) }
8. Определить потенциал водородного электрода раствора, содержащего 0,1 моль в литре уксусной кислоты и 0,1 моль уксуснокислого натрия. Кд(CH3COOH) =10-5.
9. Рассчитать потенциал цинкового электрода опущенного в 0,01 М раствор нитрата цинка, содержащего 1,04 моль цианистого калия (КСN) в 1л раствора. Константа устойчивости комплексного иона [Zn (CN)4]2- равна 1017. E0Zn2+/Zn0 = - 0,8B. { Раздел10.3, задача №2, первая половина }
10. Рассчитать потенциал золотого электрода, опущенного в раствор, на дне которого имеется осадок бромида золота и 1 моль бромистого натрия в литре. ПР (бромида золота AuBr) = 10-17 , Е0 Au+/Au0 = 1,5B.
{ Раздел10.3, задача №2, вторая половина }
Вариант 13
1. Электрохимические методы анализа. Электрод сравнения. Сущность кулонометрического метода анализа. Какой параметр, зависящий от концентрации определяемого компонента, измеряется?
2. Назвать основные титриметрические методы анализа. Что такое скачек кривой титрования? Какими точками на кривой титрования он ограничен? Жесткость воды. В чем измеряется, как определяется и как устраняется?
3. Гравиметрический метод. Гравиметрический фактор. Рассчитать минимальную концентрацию арсенат-аниона (AsO43-) при которой серебро количественно осадится из раствора в виде хлорида серебра (Ag3AsO4)? ПР(Ag3AsO4)= 10-22. { Раздел5.5, задача №1 }
4. Хроматографические методы анализа. Жидкостная хроматография.
Спектральные методы. Основное и возбужденное состояние атомов и молекул. Вырожденные состояния. Электронные спектры. Молярный коэффициент поглощения или коэффициент экстинкции. Что такое спектры поглощения и эмиссионные спектры.
5. На титрование 100 мл раствора смеси серной и фосфорной кислоты с использованием в качестве индикатора метилового оранжевого пошло 3 мл 0,1 н раствора гидроксида натрия. На титрование 100 мл той же смеси кислот с использованием в качестве индикатора фенолфталеина пошло 4 мл 0,1 н раствора гидроксида натрия. Определить молярные концентрации серной и фосфорной кислот в растворе. { Раздел 7.8, задачи №6 и №4 }
6. Сколько грамм ацетата натрия, сульфита натрия надо взять, чтобы приготовить два раствора этих солей по 500 мл каждого, концентрации 0,001 N? Какова процентная концентрация (массовая доля) данного раствора (плотность раствора равна единице)? { Раздел6.3, задачи №1 и №2 }
7. Определить рН а) 0,0001М раствора HCl и б) 0,1 М раствора аммиака Кд(NH4OH) =10-5. { раздел 4.4}
8. Рассчитать потенциал цинкового электрода опущенного в 0,1 М раствор нитрата цинка, содержащего 1,4 моль цианистого калия (КСN) в 1л раствора. Константа устойчивости комплексного иона [Zn (СN)4]2- равна 1017 .
E0Zn2+/Zn0 = - 0,8B. { Раздел10.3, задача №2, первая половина }
9. Каким будет рН раствора в точке эквивалентности при титровании 0,1н раствора синильной кислоты HCN (Kд = 10-9) 0,1н раствором NaOH?
{ Раздел7.4, пункт 3) }
10. Определить потенциал платинового электрода опущенного в раствор, содержащий на дне сосуда осадок гидроксида платины Pt (OH)2 (ПР=10-25) и 0,1N NaOH. E0Pt2+/Pt=1,2B.
{ Раздел10.3, задача №2, вторая половина }
Вариант 14.
1. Электрохимические методы анализа. Индикаторный электрод. Сущность амперометрического метода анализа. Какой параметр, зависящий от концентрации определяемого компонента, измеряется?
2. По какой формуле определяется электродный потенциал в точке эквивалентности при окислительно-восстановительном титровании? Жесткость воды. В чем измеряется, как определяется и как устраняется?
3. Гравиметрический метод. Гравиметрический фактор. Рассчитать минимальную концентрацию иодид-аниона (I-) при которой серебро количественно осадится из раствора в виде иодида серебра (AgI)?
ПР(AgI)= 10-16{ Раздел5.5, задача №1 }
4. Хроматографические методы анализа. Ионообменная хроматография.
4а. На титрование 100 мл раствора смеси серной и фосфорной кислоты с использованием в качестве индикатора метилового оранжевого пошло 200 мл 0,1 н раствора гидроксида натрия. На титрование 100 мл той же смеси кислот с использованием в качестве индикатора фенолфталеина пошло 300 мл 0,1 н раствора гидроксида натрия. Определить молярные концентрации серной и фосфорной кислот в растворе. { Раздел 7.8, задачи №6 и №4 }
5.Спектральные методы. Основное и возбужденное состояние атомов и молекул. Колебательные спектры. Оптические спектры. Закон Бугера-Ламберта-Бера. Чем отличаются спектры атомов и молекул. Что такое спектры поглощения и эмиссионные спектры.
6. Сколько грамм сульфита натрия, сульфата натрия надо взять, чтобы приготовить 500 мл 0,001 N раствора? Какова процентная концентрация (массовая доля) данного раствора (плотность раствора равна единице)? { Раздел6.3, задачи №1 и №2 }
Определить рН а) 0,01 М раствора NaOH, б) 0,001 М раствора уксусной кислоты Кд(CH3COOH) =10-5. { раздел 4.4}
7. Определить потенциал водородного электрода раствора, содержащего 0,01 моль в литре уксусной кислоты и 1 моль уксуснокислого натрия. Кд(CH3COOH) =10-5.
8. Рассчитать потенциал цинкового электрода опущенного в 0,001 М раствор нитрата цинка, содержащего 1,004 моль цианистого калия (КСN)в 1л раствора. Константа устойчивости комплексного иона [Zn (СN)4]2- равна 1017 . E0Zn2+/Zn0 = - 0,8B. { Раздел10.3, задача №2, первая половина }
9. Каким будет рН раствора в точке эквивалентности при титровании 0,1 н раствора NH3 (Кд(NH4OH) =10-5) 0,1 н раствором соляной кислоты?
{ Раздел7.4, пункт 3) }
10. Определить потенциал медного электрода опущенного в раствор, содержащий на дне сосуда осадок соли меди Cu2S (ПР=10-48) и 1M Na2S .E0Cu+/Cu=0,52B. { Раздел10.3, задача №2, вторая половина }
Вариант 15
1. Электрохимические методы анализа. Электрод сравнения. Сущность потенциометрического метода анализа. Какой параметр, зависящий от концентрации определяемого компонента, измеряется?
2. Что такое скачек кривой титрования? Какими точками на кривой титрования он ограничен? Определение рН в точке эквивалентности при титровании слабого основания сильной кислотой. По какой формуле определяется электродный потенциал в точке эквивалентности при окислительно-восстановительном титровании.? Жесткость воды. В чем измеряется, как определяется и как устраняется?
3. Гравиметрический метод. Гравиметрический фактор. . Рассчитать минимальную концентрацию цианид-аниона (CN-) при которой серебро количественно осадится из раствора в виде хлорида серебра (AgCN)? ПР(AgCN)= 10-16 { Раздел5.5, задача №1 }
4. Хроматографические методы анализа. Гель-хроматография.
Спектральные методы. Оптические спектры. Закон Бугера-Ламберта-Бера. Чем отличаются спектры атомов и молекул.
5. На титрование 100 мл раствора смеси серной и фосфорной кислоты с использованием в качестве индикатора метилового оранжевого пошло 60 мл 0,1 н раствора гидроксида натрия. На титрование 100 мл той же смеси кислот с использованием в качестве индикатора фенолфталеина пошло 80 мл 0,1 н раствора гидроксида натрия. Определить молярные концентрации серной и фосфорной кислот в растворе. { Раздел 7.8, задачи №6 и №4 }
6. Сколько грамм а) сульфида натрия б) сульфата калия надо взять, чтобы приготовить два раствора этих веществ по 500 мл каждого и концентрацией 0,001 N (молярная концентрация эквивалентов)? Какова процентная концентрация (массовая доля) данного вещества в каждом растворе (плотность раствора равна единице)? { Раздел6.3, задачи №1 и №2 }
7. Определить рН а) 0,01 М раствора NaOH, б) 0,001 М раствора уксусной кислоты Кд(CH3COOH) =10-5. { раздел 4.4}
8. Рассчитать потенциал цинкового электрода опущенного в 0,1 М раствор нитрата никеля (Ni(NO3)2) , содержащего 1,6 моль цианистого калия (КСN) в 1л раствора. Константа устойчивости комплексного иона [Ni (CN)6]4- равна 1031. E0 Ni2+/Ni0 = - 0,23B. { Раздел10.3, задача №2, первая половина }
9. Каким будет рН раствора в точке эквивалентности при титровании 0,1 М раствора уксусной кислоты (Кд(CH3COOH) =10-5) 0,1 н раствором NaOH?
{ Раздел7.4, пункт 3) }
10. Определить потенциал оловянного электрода опущенного в раствор, содержащий на дне сосуда осадок соли олова SnS (ПР = 10-28) и 0,01М Na2S. E0Sn2+/Sn= -0,14B. { Раздел10.3, задача №2, вторая половина }
Вариант 16
1. Электрохимические методы анализа. Индикаторный электрод. Сущность кондуктометрического метода. Какой параметр, зависящий от концентрации определяемого компонента, измеряется?
2. Определение рН в точке эквивалентности при титровании сильной кислоты сильным основанием, слабого основания сильной кислотой.
3. Гравиметрический метод. Гравиметрический фактор. Рассчитать минимальную концентрацию хлорид-аниона (Cl-) при которой серебро количественно осадится из раствора в виде хлорида серебра (AgCl)? ПР(AgCl)= 10-10{ Раздел5.5, задача №1 }
4. Хроматографические методы анализа. Газовая хроматография.
5. На титрование 100 мл раствора смеси серной и фосфорной кислоты с использованием в качестве индикатора метилового оранжевого пошло 6 мл 0,1 н раствора гидроксида натрия. На титрование 100 мл той же смеси кислот с использованием в качестве индикатора фенолфталеина пошло 8 мл 0,1 н раствора гидроксида натрия. Определить молярные концентрации серной и фосфорной кислот в растворе. { Раздел 7.8, задачи №6 и №4 }
6. Сколько грамм а) сульфита натрия б) ацетата натрия надо взять, чтобы приготовить два раствора этих веществ по 500 мл каждого и концентрацией 0,001 N (молярная концентрация эквивалентов)? Какова процентная концентрация (массовая доля) данного вещества в каждом растворе (плотность раствора равна единице)? { Раздел6.3, задачи №1 и №2 }
7. Определить рН а) 0,0001М раствора HCl, б) 0,1 М раствора аммиака Кд(NH4OH) =10-5. { раздел 4.4}
8. Рассчитать потенциал цинкового электрода опущенного в 0,1 М раствор нитрата цинка, содержащего 1,4 моль аммиака в 1л раствора. Константа устойчивости комплексного иона [Zn (NH3)4]+2 равна 1010 .E0Zn2+/Zn0 = - 0,8B.
{ Раздел10.3, задача №2, первая половина }
9. Каким будет рН раствора в точке эквивалентности при титровании 0,1н раствора синильной кислоты HCN (Kд = 10-9) 0,1н раствором NaOH.
{ Раздел7.4, пункт 3) }
10. Определить потенциал серебряного электрода опущенного в раствор, содержащий на дне сосуда осадок соли серебра Ag3AsO4 (ПР=10-22) и 0,1М Na3AsO4. E0Ag+/Ag=0,8B. { Раздел10.3, задача №2, вторая половина }
Вариант 17
1. Электрохимические методы анализа. Электрод сравнения. Сущность кулонометрического метода анализа. Какой параметр, зависящий от концентрации определяемого компонента, измеряется?
2. Назвать основные титриметрические методы анализа. Что такое скачек кривой титрования? Какими точками на кривой титрования он ограничен? Жесткость воды. В чем измеряется, как определяется и как устраняется?
3. Гравиметрический метод. Гравиметрический фактор. Рассчитать минимальную концентрацию арсенат-аниона (AsO43-) при которой серебро количественно осадится из раствора в виде хлорида серебра (Ag3AsO4)? ПР(Ag3AsO4)= 10-22{ Раздел5.5, задача №1 }
4.Спектральные методы. Основное и возбужденное состояние атомов и молекул. Вырожденные состояния. Электронные спектры. Молярный коэффициент поглощения или коэффициент экстинкции. Что такое спектры поглощения и эмиссионные спектры.
4а. На титрование 100 мл раствора смеси серной и фосфорной кислоты с использованием в качестве индикатора метилового оранжевого пошло 300 мл 0,1 н раствора гидроксида натрия. На титрование 100 мл той же смеси кислот с использованием в качестве индикатора фенолфталеина пошло 400 мл 0,1 н раствора гидроксида натрия. Определить молярные концентрации серной и фосфорной кислот в растворе. { Раздел 7.8, задачи №6 и №4 }
5. Сколько грамм а) гидроксида кальция, б) ацетата натрия надо взять, чтобы приготовить два раствора этих веществ по 500 мл каждого и концентрацией 0,001 N (молярная концентрация эквивалентов)? Какова процентная концентрация (массовая доля) данного вещества в каждом растворе (плотность раствора равна единице)? { Раздел6.3, задачи №1 и №2 }
6. Определить рН 0,01 М раствора NaOH, а также 0,001 М раствора уксусной кислоты Кд(CH3COOH) =10-5. { раздел 4.4}
7. Каким будет рН раствора в точке эквивалентности при титровании 0,1н раствора синильной кислоты HCN (Kд = 10-9) 0,1н раствором NaOH?
{ Раздел7.4, пункт 3) }
8. Определить потенциал водородного электрода раствора, содержащего 0,1 моль в литре уксусной кислоты и 0,1 моль уксуснокислого натрия. Кд(CH3COOH) =10-5.
9. Рассчитать потенциал цинкового электрода опущенного в 0,01 М раствор нитрата цинка, содержащего 1,04 моль аммиака в 1л раствора. Константа устойчивости комплексного иона [Zn (NH3)4]+2 равна 1010. E0Zn2+/Zn0 = - 0,8B.
{ Раздел10.3, задача №2, первая половина }
10. Рассчитать потенциал серебряного электрода, опущенного в раствор, на дне которого имеется осадок бромида серебра и 1моль в литре бромистого натрия. ПР (бромида серебра AgBr) = 10-13 , Е0 Ag+/Ag0= 0,8B.
{ Раздел10.3, задача №2, вторая половина }
Вариант 18
1. Электрохимические методы анализа. Индикаторный электрод. Сущность амперометрического метода анализа. Какой параметр, зависящий от концентрации определяемого компонента, измеряется?
2. Сколько грамм а) гидроксида кальция, б) арсената натрия (Na3AsO4) надо взять, чтобы приготовить два раствора этих веществ по 500 мл каждого и концентрацией 0,001 N (молярная концентрация эквивалентов)? Какова процентная концентрация (массовая доля) данного вещества в каждом растворе (плотность раствора равна единице)? { Раздел6.3, задачи №1 и №2 }
3. Гравиметрический метод. Гравиметрический фактор. Рассчитать минимальную концентрацию иодид-аниона (I-) при которой серебро количественно осадится из раствора в виде иодида серебра (AgI)?
ПР(AgI)= 10-16{ Раздел5.5, задача №1 }
4. Хроматографические методы анализа. Ионообменная хроматография.
5. На титрование 100 мл раствора смеси серной и фосфорной кислоты с использованием в качестве индикатора метилового оранжевого пошло 400 мл 0,1 н раствора гидроксида натрия. На титрование 100 мл той же смеси кислот с использованием в качестве индикатора фенолфталеина пошло 600 мл 0,1 н раствора гидроксида натрия. Определить молярные концентрации серной и фосфорной кислот в растворе. { Раздел 7.8, задачи №6 и №4 }
6.Спектральные методы. Основное и возбужденное состояние атомов и молекул. Колебательные спектры. Оптические спектры. Закон Бугера-Ламберта-Бера. Чем отличаются спектры атомов и молекул. Что такое спектры поглощения и эмиссионные спектры.
7. Определить рН а) 0,01 М раствора NaOH, б) 0,001 М раствора уксусной кислоты Кд(CH3COOH) =10-5. { Раздел 4.4 }
8. Рассчитать потенциал цинкового электрода опущенного в 0,1 М раствор нитрата цинка, содержащего 1,4 моль аммиака в 1л раствора. Константа устойчивости комплексного иона [Zn (NH3)4]+2 равна 1012. E0Zn2+/Zn0 = - 0,8B.
{ Раздел10.3, задача №2, первая половина }
9. Каким будет рН раствора в точке эквивалентности при титровании 0,1М раствора уксусной кислоты (Кд(CH3COOH) =10-5) 0,1н раствором NaOH?
{ Раздел7.4, пункт 3) }
10. Определить потенциал серебряного электрода опущенного в раствор, содержащий на дне сосуда осадок соли серебра Ag2S (ПР=10-49) и 0,1М Na2S. E0Ag+/Ag=0,8B. { Раздел10.3, задача №2, вторая половина }
Вариант 19
1. Электрохимические методы анализа. Электрод сравнения. Сущность потенциометрического метода анализа. Какой параметр, зависящий от концентрации определяемого компонента, измеряется?
2. Что такое скачек кривой титрования? Какими точками на кривой титрования он ограничен? Определение рН в точке эквивалентности при титровании слабого основания сильной кислотой. По какой формуле определяется электродный потенциал в точке эквивалентности при окислительно-восстановительном титровании? Жесткость воды. В чем измеряется, как определяется и как устраняется?
3. Гравиметрический метод. Гравиметрический фактор. . Рассчитать минимальную концентрацию цианид-аниона (CN-) при которой серебро количественно осадится из раствора в виде хлорида серебра (AgCN)? ПР(AgCN)= 10-16 { Раздел5.5, задача №1 }
4. Спектральные методы. Основное и возбужденное состояние атомов и молекул. Оптические спектры. Закон Бугера-Ламберта-Бера. Чем отличаются спектры атомов и молекул.
4а. На титрование 100 мл раствора смеси серной и фосфорной кислоты с использованием в качестве индикатора метилового оранжевого пошло 600 мл 0,1 н раствора гидроксида натрия. На титрование 100 мл той же смеси кислот с использованием в качестве индикатора фенолфталеина пошло 800 мл 0,1 н раствора гидроксида натрия. Определить молярные концентрации серной и фосфорной кислот в растворе. { Раздел 7.8, задачи №6 и №4 }
5. Сколько грамм а) сульфита натрия б) сульфата натрия надо взять, чтобы приготовить два раствора этих веществ по 500 мл каждого и концентрацией 0,001 N (молярная концентрация эквивалентов)? Какова процентная концентрация (массовая доля) данного вещества в каждом растворе (плотность раствора равна единице)? { Раздел 6.3, задачи №1 и №2 }
6. Определить рН а) 0,01М раствора NaOH, б) 0,001М раствора уксусной кислоты Кд= 10-5{Раздел 4.4 }
7. Определить потенциал водородного электрода раствора, содержащего 0,01 моль в литре уксусной кислоты и 1 моль уксуснокислого натрия. Кд(CH3COOH) =10-5.
8. Рассчитать потенциал цинкового электрода опущенного в 0,001 М раствор нитрата цинка, содержащего 1,004 моль аммиака в 1л раствора. Константа устойчивости комплексного иона [Zn (NH3)4]+2 равна 1011 . E0Zn2+/Zn0 = - 0,8B.
{ Раздел10.3, задача №2, первая половина }
9. Каким будет рН раствора в точке эквивалентности при титровании 0,1 н раствора NH3 (Кд(NH4OH) =10-5) 0,1 н раствором соляной кислоты
{ Раздел7.4, пункт 3) }
10. Определить потенциал серебряного электрода опущенного в раствор, содержащий на дне сосуда осадок соли серебра Ag3PO4 (ПР=10-21) и 1М Na3РO4 .E0Ag+/Ag=0,8B. { Раздел10.3, задача №2, вторая половина }
Вариант 20
1. Электрохимические методы анализа. Индикаторный электрод. Сущность потенциометрического метода анализа. Какой параметр, зависящий от концентрации определяемого компонента, измеряется?
2. Определение рН в точке эквивалентности при титровании сильной кислоты сильным основанием. По какой формуле определяется электродный потенциал в точке эквивалентности при окислительно-восстановительном титровании? Жесткость воды. В чем измеряется, как определяется и как устраняется?
3. Гравиметрический метод. Гравиметрический фактор. Рассчитать минимальную концентрацию фосфат-аниона (PO4-3) при которой серебро количественно осадится из раствора в виде фосфата серебра (Ag3PO4)? ПР(Ag3PO4)= 10-20{ Раздел5.5, задача №1 }
4. Спектральные методы. Вырожденные состояния. Электронные спектры. Колебательные спектры. Закон Бугера-Ламберта-Бера. Коэффициент пропускания. Молярный коэффициент поглощения или коэффициент экстинкции. Что такое спектры поглощения и эмиссионные спектры.
4а. На титрование 100 мл раствора смеси серной и фосфорной кислоты с использованием в качестве индикатора метилового оранжевого пошло 250 мл 0,1 н раствора гидроксида натрия. На титрование 100 мл той же смеси кислот с использованием в качестве индикатора фенолфталеина пошло 300 мл 0,1 н раствора гидроксида натрия. Определить молярные концентрации серной и фосфорной кислот в растворе. { Раздел 7.8, задачи №6 и №4 }
5. Сколько грамм а) сульфида натрия б) сульфата калия надо взять, чтобы приготовить два раствора этих веществ по 500 мл каждого и концентрацией 0,001 N (молярная концентрация эквивалентов)? Какова процентная концентрация (массовая доля) данного вещества в каждом растворе (плотность раствора равна единице)? { Раздел6.3, задачи №1 и №2 }
6. Определить рН а) HCl 0,001 М, б) 0,1 М раствора аммиака Кд(NH4OH) =10-5. { Раздел 4.4 }
7. Определить потенциал водородного электрода раствора, содержащего 0,01 моль в литре уксусной кислоты и 0,1 моль уксуснокислого натрия. Кд(CH3COOH) =10-5.
8. Рассчитать потенциал цинкового электрода опущенного в 0,01 М раствор нитрата цинка, содержащего 1,04 моль аммиака в 1л раствора. Константа устойчивости комплексного иона [Zn (NH3)4]+2 равна 1010. E0Zn2+/Zn0 = - 0,8B.
{ Раздел10.3, задача №2, первая половина }
9. Каким будет рН раствора в точке эквивалентности при титровании 0,1н раствора хлорноватистой кислоты HClO (Кд=10-7) 0,1н раствором NaOH.
{ Раздел7.4, пункт 3) }
10. Определить потенциал серебряного электрода опущенного в раствор, содержащий на дне сосуда осадок соли серебра Ag2SO3 (ПР=10-14) и 1М Na2SO3. E0Ag+/Ag=0,8B. { Раздел10.3, задача №2, вторая половина }
Вариант 21
1. Электрохимические методы анализа. Электрод сравнения. Сущность кондуктометрического метода анализа. Какой параметр, зависящий от концентрации определяемого компонента, измеряется?
2. Что такое скачек кривой титрования? Какими точками на кривой титрования он ограничен? Определение рН в точке эквивалентности при титровании сильной кислоты сильным основанием. По какой формуле определяется электродный потенциал в точке эквивалентности при окислительно-восстановительном титровании? Жесткость воды. В чем измеряется, как определяется и как устраняется?
3. Гравиметрический метод. Гравиметрический фактор. Рассчитать минимальную концентрацию сульфид-аниона (S-2) при которой серебро количественно осадится из раствора в виде сульфида серебра (Ag2S)? ПР(Ag2S)= 10-50. { Раздел5.5, задача №1 }
4. Хроматографические методы анализа. Жидкостная хроматография.
Спектральные методы. Основное и возбужденное состояние атомов и молекул. Колебательные спектры. Закон Бугера-Ламберта-Бера. Что такое спектры поглощения и эмиссионные спектры.
На титрование 100 мл раствора смеси серной и фосфорной кислоты с использованием в качестве индикатора метилового оранжевого пошло 150 мл 0,1 н раствора гидроксида натрия. На титрование 100 мл той же смеси кислот с использованием в качестве индикатора фенолфталеина пошло 200 мл 0,1 н раствора гидроксида натрия. Определить молярные концентрации серной и фосфорной кислот в растворе. { Раздел 7.8, задачи №6 и №4 }
5. Сколько грамм а) сульфита натрия б) сульфида калия надо взять, чтобы приготовить два раствора этих веществ по 500 мл каждого и концентрацией 0,001 N (молярная концентрация эквивалентов, нормальная концентрация)? Какова процентная концентрация (массовая доля) данного вещества в каждом растворе (плотность раствора равна единице)? { Раздел6.3, задачи №1 и №2 }
6. Определить рН а) 0,001М раствора NaOH, б) 0,001М раствора уксусной кислоты Кд(CH3COOH) =10-5. { Раздел 4.4 }
7. Определить потенциал водородного электрода раствора, содержащего 0,1 моль в литре уксусной кислоты и 0,01 моль уксуснокислого натрия.
8. Рассчитать потенциал цинкового электрода опущенного в 0,001 М раствор нитрата цинка, содержащего 1,004 моль аммиака в 1л раствора. Константа устойчивости комплексного иона [Zn (NH3)4]+2 равна 109. E0Zn2+/Zn0 = - 0,8B.
{ Раздел10.3, задача №2, первая половина }
9. Каким будет рН раствора в точке эквивалентности при титровании 0,1н раствора фенола (Кд=10-11) 0,1 н раствором NaOH? { Раздел7.4, пункт 3) }
10. Определить потенциал серебряного электрода опущенного в раствор, содержащий на дне сосуда осадок соли серебра AgSCN (ПР=10-12) и 1N NaSCN. E0Ag+/Ag=0,8B. { Раздел10.3, задача №2, вторая половина }
Вариант 22
1. Электрохимические методы анализа. Индикаторный электрод. Сущность кулонометрического метода анализа. Какой параметр, зависящий от концентрации определяемого компонента, измеряется?
2. Определение рН в точке эквивалентности при титровании слабой кислоты сильным основанием. Жесткость воды. В чем измеряется, как определяется и как устраняется?
3. Гравиметрический метод. Гравиметрический фактор. Рассчитать минимальную концентрацию бромид-аниона (Br-) при которой серебро количественно осадится из раствора в виде бромида серебра (AgBr)? ПР(AgBr)= 10-13. { Раздел5.5, задача №1 }
4. Хроматографические методы анализа. Ионообменная хроматография.
Спектральные методы. Вырожденные состояния. Оптические спектры. Коэффициент пропускания. Молярный коэффициент поглощения или коэффициент экстинкции. Чем отличаются спектры атомов и молекул.
4а. На титрование 100 мл раствора смеси серной и фосфорной кислоты с использованием в качестве индикатора метилового оранжевого пошло 30 мл 0,1 н раствора гидроксида натрия. На титрование 100 мл той же смеси кислот с использованием в качестве индикатора фенолфталеина пошло 40 мл 0,1 н раствора гидроксида натрия. Определить молярные концентрации серной и фосфорной кислот в растворе. { Раздел 7.8, задачи №6 и №4 }
5. Сколько грамм а) гидроксида кальция б) карбоната натрия надо взять, чтобы приготовить два раствора этих веществ по 500 мл каждого и концентрацией 0,001 N (молярная концентрация эквивалентов)? Какова процентная концентрация (массовая доля) данного вещества в каждом растворе (плотность раствора равна единице)? { Раздел6.3, задачи №1 и №2 }
6. Определить рН а) 0,0001М раствора HCl, б) 0,1 М раствора аммиака Кд(NH4OH) =10-5. { Раздел 4.4 }
7. Определить потенциал водородного электрода раствора, содержащего 0,1 моль в литре уксусной кислоты и 0,1 моль уксуснокислого натрия. Кд(CH3COOH) =10-5.
8. Рассчитать потенциал цинкового электрода опущенного в 0,001 М раствор нитрата цинка, содержащего 1,004 моль аммиака в 1л раствора. Константа устойчивости комплексного иона [Zn (NH3)4]+2 равна 1011 . E0Zn2+/Zn0 = - 0,8B.
{ Раздел10.3, задача №2, первая половина }
9. Каким будет рН раствора в точке эквивалентности при титровании 0,1 н раствора хлоруксусной ClCH2COOH (Кд = 10-3) 0,1 н раствором NaOH?
{ Раздел7.4, пункт 3) }
10. Определить потенциал серебряного электрода опущенного в раствор, содержащий на дне сосуда осадок соли серебра AgCl (ПР=10-10) 1N NaCl. E0Ag+/Ag=0,8B. { Раздел10.3, задача №2, вторая половина }
Вариант 23
1. Электрохимические методы анализа. Электрод сравнения. Сущность амперометрического метода анализа. Какой параметр, зависящий от концентрации определяемого компонента, измеряется?
2 Что такое скачек кривой титрования? Какими точками на кривой титрования он ограничен? Определение рН в точке эквивалентности при титровании слабого основания сильной кислотой. По какой формуле определяется электродный потенциал в точке эквивалентности при окислительно-восстановительном титровании?
3. Гравиметрический метод. Гравиметрический фактор. Рассчитать минимальную концентрацию роданид-аниона (SCN-) при которой серебро количественно осадится из раствора в виде роданистого серебра (AgSCN)? ПР(AgSCN)= 10-12{ Раздел5.5, задача №1 }
4. Хроматографические методы анализа. Гель-хроматография.
Спектральные методы. Основное и возбужденное состояние атомов и молекул. Оптические спектры. Закон Бугера-Ламберта-Бера. Что такое спектры поглощения и эмиссионные спектры.
4а. На титрование 100 мл раствора смеси серной и фосфорной кислоты с использованием в качестве индикатора метилового оранжевого пошло 3 мл 0,1 н раствора гидроксида натрия. На титрование 100 мл той же смеси кислот с использованием в качестве индикатора фенолфталеина пошло 4 мл 0,1 н раствора гидроксида натрия. Определить молярные концентрации серной и фосфорной кислот в растворе. { Раздел 7.8, задачи №6 и №4 }
5. Сколько грамм а) нитрата серебра б) сульфата меди надо взять, чтобы приготовить два раствора этих веществ по 500 мл каждого и концентрацией 0,001 N (молярная концентрация эквивалентов)? Какова процентная концентрация (массовая доля) данного вещества в каждом растворе (плотность раствора равна единице)? { Раздел6.3, задачи №1 и №2}
6. Определить рН а) 0,01 М раствора NaOH, б) 0,0001М раствора. {Раздел 4.4 }
7. Определить потенциал водородного электрода раствора, содержащего 0,1 моль в литре уксусной кислоты и 0,001 моль уксуснокислого натрия. Кд=10-5.
8. Рассчитать потенциал цинкового электрода опущенного в 0,1 М раствор нитрата цинка, содержащего 1,4 моль аммиака в 1л раствора. Константа устойчивости комплексного иона [Zn (NH3)4]+2 равна 1011 . E0Zn2+/Zn0 = - 0,8B.
{ Раздел10.3, задача №2, первая половина }
9. Каким будет рН раствора в точке эквивалентности при титровании 0,1н раствора циановой HOCN (Кд=10-3) 0,1н раствором NaOH?
{ Раздел7.4, пункт 3) }
10. Определить потенциал серебряного электрода опущенного в раствор, содержащий на дне сосуда осадок соли серебра AgI (ПР=10-17) и 0,1N NaI. E0Ag+/Ag=0,8B. { Раздел10.3, задача №2, вторая половина }
Вариант 24
1. Электрохимические методы анализа. Электрод сравнения. Сущность потенциометрического метода анализа. Какой параметр, зависящий от концентрации определяемого компонента, измеряется?
2. Что такое скачек кривой титрования? Какими точками на кривой титрования он ограничен? Определение рН в точке эквивалентности при титровании сильной кислоты сильным основанием. По какой формуле определяется электродный потенциал в точке эквивалентности при окислительно-восстановительном титровании?
3. Гравиметрический метод. Гравиметрический фактор. Рассчитать минимальную концентрацию сульфит-аниона (SO3-2) при которой серебро количественно осадится из раствора в виде сульфита серебра (Ag2SO3)? ПР(Ag2SO3) = 10-14 { Раздел5.5, задача №1 }
4. Хроматографические методы анализа. Гель-хроматография.
Спектральные методы. Основное и возбужденное состояние атомов и молекул. Вырожденные состояния. Электронные спектры. Закон Бугера-Ламберта-Бера. Чем отличаются спектры атомов и молекул.
4а. На титрование 100 мл раствора смеси серной и фосфорной кислоты с использованием в качестве индикатора метилового оранжевого пошло 200 мл 0,1 н раствора гидроксида натрия. На титрование 100 мл той же смеси кислот с использованием в качестве индикатора фенолфталеина пошло 300 мл 0,1 н раствора гидроксида натрия. Определить молярные концентрации серной и фосфорной кислот в растворе. { Раздел 7.8, задачи №6 и №4 }
5. Сколько грамм а) фосфата натрия б) сульфата натрия надо взять, чтобы приготовить два раствора этих веществ по 500 мл каждого и концентрацией 0,001 N (молярная концентрация эквивалентов)? Какова процентная концентрация (массовая доля) данного вещества в каждом растворе (плотность раствора равна единице)? { Раздел6.3, задачи №1 и №2 }
6. Определить рН а) 0,01 М раствора NaOH, б) 0,1 М раствора аммиака Кд(NH4OH) =10-5. { Раздел 4.4 }
7. Определить потенциал водородного электрода раствора, содержащего 0,1 моль в литре уксусной кислоты и 1 моль уксуснокислого натрия. Кд(CH3COOH) =10-5.
8. Рассчитать потенциал цинкового электрода опущенного в 0,1 М раствор нитрата цинка, содержащего 1,4 моль аммиака в 1л раствора. Константа устойчивости комплексного иона [Zn (NH3)4]+2 равна 109. E0Zn2+/Zn0 = - 0,8B.
{ Раздел10.3, задача №2, первая половина }
9. Рассчитать потенциал серебряного электрода, опущенного в раствор, на дне которого имеется осадок бромида серебра и 1моль в литре бромистого натрия. ПР (бромида серебра AgBr) = 10-13 , Е0 Ag+/Ag0= 0,8B. { Раздел10.3, задача №2, вторая половина }
10. Каким будет рН раствора в точке эквивалентности при титровании 0,1 н раствора салициловая Кд=10-3 0,1н раствором гидроксида натрия.
{ Раздел7.4, пункт 3) }
Вариант 25
1. Электрохимические методы анализа. Индикаторный электрод и электрод сравнения. Сущность кондуктометрического, метода анализа. Какой параметр, зависящий от концентрации определяемого компонента, измеряется?
2. Что такое интервал перехода окраски индикатора? Определение рН в точке эквивалентности при титровании слабой кислоты сильным основанием. По какой формуле определяется электродный потенциал в точке эквивалентности при окислительно-восстановительном титровании? Жесткость воды. В чем измеряется, как определяется и как устраняется?
3. Гравиметрический метод. Гравиметрический фактор. Рассчитать минимальную концентрацию гексацианоферрат-аниона [Fe(CN)6]-4 при которой серебро количественно осадится из раствора в виде гексацианоферрата серебра Ag4[Fe(CN)6]? ПР(Ag4[Fe(CN)6]) = 10-44. { Раздел5.5, задача №1 }
4. Хроматографические методы анализа. тонкослойная.
Спектральные методы. Вырожденные состояния. Спектры ЯМР. Закон Бугера-Ламберта-Бера. Чем отличаются спектры атомов и молекул.
5. На титрование 100 мл раствора смеси серной и фосфорной кислоты с использованием в качестве индикатора метилового оранжевого пошло 60 мл 0,1 н раствора гидроксида натрия. На титрование 100 мл той же смеси кислот с использованием в качестве индикатора фенолфталеина пошло 80 мл 0,1 н раствора гидроксида натрия. Определить молярные концентрации серной и фосфорной кислот в растворе. { Раздел 7.8, задачи №6 и №4 }
6. Сколько грамм а) гидроксида кальция б) нитрата серебра надо взять, чтобы приготовить два раствора этих веществ по 500 мл каждого и концентрацией 0,001 N (молярная концентрация эквивалентов)? Какова процентная концентрация (массовая доля) данного вещества в каждом растворе (плотность раствора равна единице)? { Раздел6.3, задачи №1 и №2 }
7. Определить рН а) 0,01 М раствора NaOH, б) 0,1 М раствора аммиака Кд(NH4OH) =10-5. { Раздел 4.4 }
8. Рассчитать потенциал цинкового электрода опущенного в 0,01 М раствор нитрата цинка, содержащего 1,04 моль аммиака в 1л раствора. Константа устойчивости комплексного иона [Zn (NH3)4]+2 равна 1012. E0Zn2+/Zn0 = - 0,8B.
{ Раздел10.3, задача №2, первая половина }
9. Каким будет рН раствора в точке эквивалентности при титровании 0,1н раствора хлористой кислоты HClO2 0,1 н раствором NaOH? Кд(HClO2 ) =10-3.
{ Раздел7.4, пункт 3) }
10. Определить потенциал серебряного электрода опущенного в раствор, содержащий на дне сосуда осадок соли серебра Ag3AsO4 (ПР=10-22) и 0,1М Na3AsO4. E0Ag+/Ag=0,8B. { Раздел10.3, задача №2, вторая половина }
Вариант 26
1. Электрохимические методы анализа. Индикаторный электрод. Сущность кулонометрического метода анализа. Какой параметр, зависящий от концентрации определяемого компонента, измеряется?
2. Что такое скачек кривой титрования? Какими точками на кривой титрования он ограничен? Определение рН в точке эквивалентности при титровании сильной кислоты сильным основанием По какой формуле определяется электродный потенциал в точке эквивалентности при окислительно-восстановительном титровании?
3. Гравиметрический метод. Гравиметрический фактор. Рассчитать минимальную концентрацию гексацианоферрат-аниона [Fe(CN)6]-3 при которой серебро количественно осадится из раствора в виде гексацианоферрата серебра Ag3[Fe(CN)6]? ПР(Ag3[Fe(CN)6]) = 10-22. { Раздел5.5, задача №1 }
4. Хроматографические методы анализа. Газовая хроматография.
Спектральные методы. Основное и возбужденное состояние атомов и молекул. Электронные спектры. Чем отличаются спектры атомов и молекул?
4а. На титрование 100 мл раствора смеси серной и фосфорной кислоты с использованием в качестве индикатора метилового оранжевого пошло 6 мл 0,1 н раствора гидроксида натрия. На титрование 100 мл той же смеси кислот с использованием в качестве индикатора фенолфталеина пошло 8 мл 0,1 н раствора гидроксида натрия. Определить молярные концентрации серной и фосфорной кислот в растворе. { Раздел 7.8, задачи №6 и №4 }
5. Сколько грамм а) сульфита натрия б) карбоната натрия надо взять, чтобы приготовить два раствора этих веществ по 500 мл каждого и концентрацией 0,001 N (молярная концентрация эквивалентов)? Какова процентная концентрация (массовая доля) данного вещества в каждом растворе (плотность раствора равна единице)? { Раздел6.3, задачи №1 и №2 }
6. Определить рН а) 0,01 М раствора NaOH, б) 0,001 М раствора уксусной кислоты Кд(CH3COOH) =10-5. { Раздел 4.4 }
7. Каким будет рН раствора в точке эквивалентности при титровании 0,1н раствора синильной кислоты HCN (Kд = 10-9 ) 0,1н раствором NaOH?
{ Раздел7.4, пункт 3) }
8. Определить потенциал водородного электрода раствора, содержащего 0,1 моль в литре уксусной кислоты и 0,1 моль уксуснокислого натрия. Кд(CH3COOH) =10-5.
9. Рассчитать потенциал цинкового электрода опущенного в 0,01 М раствор нитрата цинка, содержащего 1,04 моль цианистого калия (КСN) в 1л раствора. Константа устойчивости комплексного иона [Zn (CN)4]2- равна 1017.
E0Zn2+/Zn0 = - 0,8B. { Раздел10.3, задача №2, первая половина }
10. Рассчитать потенциал золотого электрода, опущенного в раствор, на дне которого имеется осадок бромида золота и 1моль бромистого натрия в литре. ПР (бромида золота AuBr) = 10-17 , Е0 Au+/Au0= 1,5B.
{ Раздел10.3, задача №2, вторая половина }
Вариант 27
1. Электрохимические методы анализа. Индикаторный электрод. Сущность кондуктометрического метода. Какой параметр, зависящий от концентрации определяемого компонента, измеряется?
2. Определение рН в точке эквивалентности при титровании сильной кислоты сильным основанием, слабого основания сильной кислотой.
3. Гравиметрический метод. Гравиметрический фактор. Рассчитать минимальную концентрацию хлорид-аниона (Cl-) при которой серебро количественно осадится из раствора в виде хлорида серебра (AgCl)? ПР(AgCl)= 10-10{ Раздел5.5, задача №1 }
4. Сколько грамм а) сульфита натрия б) карбоната натрия надо взять, чтобы приготовить два раствора этих веществ по 500 мл каждого и концентрацией 0,001 N (молярная концентрация эквивалентов)? Какова процентная концентрация (массовая доля) данного вещества в каждом растворе (плотность раствора равна единице)? { Раздел6.3, задачи №1 и №2 }
5. Спектральные методы. Оптические спектры. Спектры ЯМР, ЭПР. Вырожденные состояния.
5а. На титрование 100 мл раствора смеси серной и фосфорной кислоты с использованием в качестве индикатора метилового оранжевого пошло 300 мл 0,1 н раствора гидроксида натрия. На титрование 100 мл той же смеси кислот с использованием в качестве индикатора фенолфталеина пошло 400 мл 0,1 н раствора гидроксида натрия. Определить молярные концентрации серной и фосфорной кислот в растворе. { Раздел 7.8, задачи №6 и №4 }
6. Определить рН а) 0,01М раствора NaOH, б) 0,001М раствора уксусной кислоты Кд(CH3COOH) =10-5. { Раздел 4.4 }
7. Определить потенциал водородного электрода раствора, содержащего 0,1 моль в литре уксусной кислоты и 1 моль уксуснокислого натрия. Кд(CH3COOH) =10-5.
8. Рассчитать потенциал цинкового электрода опущенного в 0,001 М раствор нитрата цинка, содержащего 1,004 моль аммиака в 1л раствора. Константа устойчивости комплексного иона [Zn (NH3)4]+2 равна 1010. E0Zn2+/Zn0 = - 0,8B.
{ Раздел10.3, задача №2, первая половина }
9. Каким будет рН раствора в точке эквивалентности при титровании 0,1н раствора салициловой кислоты (Кд = 10-3) 0,1 н раствором NaOH?
{ Раздел7.4, пункт 3) }
10. Определить потенциал серебряного электрода опущенного в раствор, содержащий на дне сосуда осадок соли серебра Ag3PO4 (ПР = 10-21) и 1М Na3РO4. E0Ag+/Ag=0,8B. { Раздел10.3, задача №2, вторая половина }
Вариант 28
1. Электрохимические методы анализа. Электрод сравнения. Сущность кулонометрического метода анализа. Какой параметр, зависящий от концентрации определяемого компонента, измеряется?
2. Назвать основные титриметрические методы анализа. Что такое скачек кривой титрования? Какими точками на кривой титрования он ограничен? Жесткость воды. В чем измеряется, как определяется и как устраняется?
3. Гравиметрический метод. Гравиметрический фактор. Рассчитать минимальную концентрацию арсенат-аниона (AsO43-) при которой серебро количественно осадится из раствора в виде хлорида серебра (Ag3AsO4)? ПР(Ag3AsO4)= 10-22. { Раздел5.5, задача №1 }
4. Хроматографические методы анализа. Жидкостная хроматография.
Спектральные методы. Основное и возбужденное состояние атомов и молекул. Вырожденные состояния. Электронные спектры. Молярный коэффициент поглощения или коэффициент экстинкции. Что такое спектры поглощения и эмиссионные спектры.
5. На титрование 100 мл раствора смеси серной и фосфорной кислоты с использованием в качестве индикатора метилового оранжевого пошло 400 мл 0,1 н раствора гидроксида натрия. На титрование 100 мл той же смеси кислот с использованием в качестве индикатора фенолфталеина пошло 600 мл 0,1 н раствора гидроксида натрия. Определить молярные концентрации серной и фосфорной кислот в растворе. { Раздел 7.8, задачи №6 и №4 }
6. Сколько грамм ацетата натрия, сульфита натрия надо взять, чтобы приготовить два раствора по 500 мл, концентрации 0,001 N? Какова процентная концентрация (массовая доля) данного раствора (плотность раствора равна единице)? { Раздел6.3, задачи №1 и №2 }
7. Определить рН а) 0,01 М раствора NaOH, б) 0,001 М раствора уксусной кислоты. Кд(CH3COOH) =10-5. { Раздел 4.4 }
8. Рассчитать потенциал цинкового электрода опущенного в 0,1 М раствор нитрата никеля (Ni(NO3)2) , содержащего 1,6 моль цианистого калия (КСN) в 1л раствора. Константа устойчивости комплексного иона [Ni (CN)6]4- равна 1031. E0 Ni2+/Ni0 = - 0,23B. { Раздел10.3, задача №2, первая половина }
9. Каким будет рН раствора в точке эквивалентности при титровании 0,1М раствора уксусной кислоты (Кд(CH3COOH) =10-5) 0,1 н раствором NaOH?
{ Раздел7.4, пункт 3) }
10. Определить потенциал оловянного электрода опущенного в раствор, содержащий на дне сосуда осадок соли олова SnS (ПР=10-28) и 0,1М Na2S. E0Sn2+/Sn= -0,14B. { Раздел10.3, задача №2, вторая половина }
Вариант 29
1. Электрохимические методы анализа. Индикаторный электрод. Сущность амперометрического метода анализа. Какой параметр, зависящий от концентрации определяемого компонента, измеряется?
2. По какой формуле определяется электродный потенциал в точке эквивалентности при окислительно-восстановительном титровании.? Жесткость воды. В чем измеряется, как определяется и как устраняется?
3. Гравиметрический метод. Гравиметрический фактор. Рассчитать минимальную концентрацию иодид-аниона (I-) при которой серебро количественно осадится из раствора в виде иодида серебра (AgI)?
ПР(AgI)= 10-16{ Раздел5.5, задача №1 }
4. Хроматографические методы анализа. Ионообменная хроматография.
5. На титрование 100 мл раствора смеси серной и фосфорной кислоты с использованием в качестве индикатора метилового оранжевого пошло 600 мл 0,1 н раствора гидроксида натрия. На титрование 100 мл той же смеси кислот с использованием в качестве индикатора фенолфталеина пошло 800 мл 0,1 н раствора гидроксида натрия. Определить молярные концентрации серной и фосфорной кислот в растворе. { Раздел 7.8, задачи №6 и №4 }
6. Сколько грамм а) ацетата натрия, б) сульфита натрия надо взять, чтобы приготовить два раствора по 500 мл, концентрации 0,001 N? Какова процентная концентрация (массовая доля) данного раствора (плотность раствора равна единице)? { Раздел6.3, задачи №1 и №2}
7. Определить рН 0,0001М раствора HCl и 0,1 М раствора аммиака Кд(NH4OH) =10-5. { Раздел 4.4 }
8. Рассчитать потенциал цинкового электрода опущенного в 0,1 М раствор нитрата цинка, содержащего 1,4 моль цианистого калия (КСN) в 1л раствора. Константа устойчивости комплексного иона [Zn (СN)4]2- равна 1017 .
E0Zn2+/Zn0 = - 0,8B. { Раздел10.3, задача №2, первая половина }
9. Каким будет рН раствора в точке эквивалентности при титровании 0,1н раствора синильной кислоты HCN (Kд = 10-9 ) 0,1н раствором NaOH
{ Раздел7.4, пункт 3) }
10. Определить потенциал платинового электрода опущенного в раствор, содержащий на дне сосуда осадок гидроксида платины Pt (OH)2 (ПР=10-25) и 0,1N NaOH. E0Pt2+/Pt=1,2B. { Раздел10.3, задача №2, вторая половина }
Вариант 30
1. Электрохимические методы анализа. Электрод сравнения. Сущность потенциометрического метода анализа. Какой параметр, зависящий от концентрации определяемого компонента, измеряется?
2. Что такое скачек кривой титрования? Какими точками на кривой титрования он ограничен? Определение рН в точке эквивалентности при титровании слабого основания сильной кислотой. По какой формуле определяется электродный потенциал в точке эквивалентности при окислительно-восстановительном титровании.? Жесткость воды. В чем измеряется, как определяется и как устраняется?
3. Гравиметрический метод. Гравиметрический фактор. . Рассчитать минимальную концентрацию цианид-аниона (CN-) при которой серебро количественно осадится из раствора в виде хлорида серебра (AgCN)? ПР(AgCN)= 10-16 { Раздел5.5, задача №1 }
4. Хроматографические методы анализа. Гель-хроматография.
Спектральные методы. Основное и возбужденное состояние атомов и молекул. Оптические спектры. Закон Бугера-Ламберта-Бера. Чем отличаются спектры атомов и молекул.
5. На титрование 100 мл раствора смеси серной и фосфорной кислоты с использованием в качестве индикатора метилового оранжевого пошло 250 мл 0,1 н раствора гидроксида натрия. На титрование 100 мл той же смеси кислот с использованием в качестве индикатора фенолфталеина пошло 300 мл 0,1 н раствора гидроксида натрия. Определить молярные концентрации серной и фосфорной кислот в растворе. { Раздел 7.8, задачи №6 и №4 }
6. Сколько грамм а) сульфида натрия б) сульфата калия надо взять, чтобы приготовить два раствора этих веществ по 500 мл каждого и концентрацией 0,001 N (молярная концентрация эквивалентов)? Какова процентная концентрация (массовая доля) данного вещества в каждом растворе (плотность раствора равна единице)? { Раздел6.3, задачи №1 и №2}
7. Определить рН а) 0,01 М раствора NaOH, б) 0,001 М раствора уксусной кислоты. Кд(CH3COOH) =10-5. { Раздел 4.4 }
8. Рассчитать потенциал цинкового электрода опущенного в 0,01 М раствор нитрата никеля (Ni(NO3)2) , содержащего 1,06 моль цианистого калия (КСN) в 1л раствора. Константа устойчивости комплексного иона [Ni (CN)6]4- равна 1031. E0 Ni2+/Ni0 = - 0,23B. { Раздел10.3, задача №2, первая половина }
9. Каким будет рН раствора в точке эквивалентности при титровании 0,1М раствора уксусной кислоты (Кд=10-5) 0,1н раствором NaOH?
{ Раздел7.4, пункт 3) }
10. Определить потенциал оловянного электрода опущенного в раствор, содержащий на дне сосуда осадок соли олова SnS (ПР=10-28) и 0,1М Na2S. E0Sn2+/Sn= -0,14B. { Раздел10.3, задача №2, вторая половина }
Содержание
ВВЕДЕНИЕ
КЛАССИФИКАЦИЯ МЕТОДОВ АНАЛИЗА
МЕТРОЛОГИЧЕСКИЕ ХАРАКТЕРИСТИКИ МЕТОДОВ АНАЛИЗА
ЗАКОН ЭКВИВАЛЕНТОВ
СВОЙСТВА РАСТВОРОВ
Способы выражения концентрации растворов
Связь различных способов выражения концентрации растворов
Ионная сила и рН растворов
Расчет рН растворов разных электролитов
Решение типовых задач
Задачи для самостоятельного решения
ГРАВИМЕТРИЧЕСКИЙ (ВЕСОВОЙ) МЕТОД АНАЛИЗА
Основные этапы гравиметрического анализа
Основные требования к осаждаемой и гравиметрической форме
Основные требования к осаждению кристаллических осадков
Общая характеристика метода
Решение типовых задач
Задачи для самостоятельного решения
ТИТРИМЕТРИЧЕСКИЙ (ОБЪЕМНЫЙ) МЕТОД АНАЛИЗА
Общая характеристика метода
Растворы в титриметрическом анализе
Решение типовых задач
Задачи для самостоятельного решения
Реакции в титриметрическом анализе
Процесс и способы титрования
Общие сведения о кривых титрования
Расчет концентрации веществ на различных участках кривых титрования
7. КИСЛОТНО-ОСНОВНОЕ ТИТРОВАНИЕ (МЕТОД НЕЙТРАЛИЗАЦИИ)
7.1 Общая характеристика метода
Индикаторы кислотно-основного титрования
Логарифмические кривые кислотно-основного титрования
Титрование слабой кислоты сильным основанием
Титрование смеси кислот (оснований)
Расчет рН раствора в различные моменты титрования
Выбор индикатора титрования
Решение типовых задач
Задачи для самостоятельного решения
МЕТОДЫ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНОГО ТИТРОВАНИЯ
Расчет фактора и числа эквивалентности веществ, участвующих в ОВР
Кривые окислительно-восстановительного титрования
Способы фиксирования конечной точки титрования (к. т. т.)
Перманганатометрия
Аналитические возможности метода перманганатометрии
Иодометрия
8.7 Приготовление и стандартизация рабочих растворов I2 и Na2S2O3
Условия проведения и аналитические возможности метода
Решение типовых задач
Задачи для самостоятельного решения
Комплексонометрия
Общая характеристика метода
9.2 Реакции ионов металлов Меn+с ЭДТА
Кривые комплексонометрии и способы установления конечной точки титрования (к. т. т.)
Условия проведения комплексонометрического титроания
Решение типовых задач
Задачи для самостоятельного решения
ЭЛЕКТРОХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
Классификация электрохимических методов
Основные электрохимические методы
Решение типовых задач
Задачи для самостоятельного решения
ХРОМАТОГРАФИЧЕСКИЕ МЕТОДЫ
Механизмы хроматографического разделения
СПЕКТРОСКОПИЯ
Поглощение в УФ- и видимой областях
Люминесценция
Инфракрасная (ИК) спектроскопия
Ядерный магнитный резонанс (ЯМР)
Масс-спектрометрия (МС)
Решение типовых задач
Задачи для самостоятельного решения
Аналитическая проба
Дополнение
Литература
Варианты контрольных работ