Равновесия в растворах электролитов самостоятельно
ХИМИЧЕСКОЕ РАВНОВЕСИЕ
1. Обратимые реакции. Химическое равновесие
2. Принцип Ле- Шателье; Смещение химического равновесия (самостоятельно)
3. Вывод формулы константы химического равновесия (самостоятельно)
4. Равновесия в растворах электролитов (самостоятельно)
5. Гетерогенные ионные равновесия
ОБРАТИМЫЕ РЕАКЦИИ. Химическое равновесие
Все химические реакции, в принципе, обратимы. Это означает, что в реакционной смеси осуществляется как взаимодействие реагентов (при этом образуются… Например: В закрытой реакционной системе, содержащей первоначально ртуть и… Таким образом, в данной системе развиваются одновременно протекающие два процесса, и суммарное уравнение обратимой…СЛ.1(3) П р и м е р. Железо и сера при умеренном нагревании реагируют между собой с образованием сульфида железа(II), FeS при таких температурах устойчив и практически не разлагается на железо и серу: Fe + S ® FeS.
В химических реакциях, которые способны при заданных условиях протекать в обоих направлениях, не происходит взаимодействия веществ без остатка. Особенно это характерно для гомогенных реакций (реакции между газами, реакции в растворе).
СЛ.1(4) П р и м е р. Реакция синтеза аммиака является обратимой N2 + 3H2 « 2NH3.
СЛ.2(0) Прямая и обратная реакции протекают одновременно в противоположных направлениях. Зависимость между прямой и обратной реакциями количественно выражается через… По мере протекания прямой реакции накапливается все большее число частиц конечных веществ, которые принимают участие в…СЛ.3(1) Например: При обратимой реакции электролитической диссоциации воды лишь очень незначительная часть молекул воды вступает в эту реакцию: H2O H+ + OH-.
Поэтому говорят, что положение равновесия находится в области недиссоциированных молекул Н2О.
Каждая химическая реакция, проводимая в определенных условиях, имеет присущее только ей положение равновесия.
Для одних и тех же условии соответствующее положение равновесия не зависит от того, реагенты или продукты реакции были исходными веществами.
Выбор условий проведения обратимых реакций является практически важной проблемой для обеспечения эффективности химико-технологических процессов, т. е. для получения оптимального количества необходимых веществ.
Вывод формулы КОНСТАНТы химического РАВНОВЕСИЯ.
Представим химическую реакцию в общем виде:СЛ.4(0) mA + nB Þ pC + qD Исходя из закона действующих масс, напишем выражения для u прямой и обратной… СЛ.4(1) uПР=К1[A]m[B]n; uобр=К2[C]p[D]qСЛ.5(5) В состоянии химического равновесия, произведение концентраций продуктов реакции, деленное на произведение концентраций исходных веществ (с учетом стехиометрических коэффициентов), есть при постоянной t0 постоянная величина, называемая константой равновесия.
Равновесия в растворах электролитов
СЛ.7(0) Если в растворе наряду с катионами и анионами присутствуют молекулы растворенного вещества MA →…СЛ.8(2) Исходя из определения степени диссоциации: [M+]=[ A−]=αc0, [MA]= ( 1 − α)c0.
СЛ.8(4) . СЛ.8(5) В случае α << 1 (на практике α<0,05) знаменатель… СЛ.8(6)Гетерогенные ионные равновесия
СЛ.10(0)Рассмотрим насыщенный водный раствор сильного электролита МА (рис.3СЛ.10(1)).
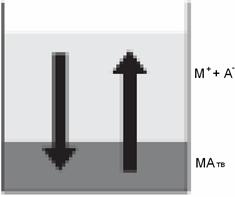
СЛ.10(2) Рис. 3. Равновесие между твердой фазой малорастворимого сильного электролита и его насыщенным раствором
СЛ.10(3) В таком растворе существует фазовое (гетерогенное) равновесие MA(т) Û M+(р) + A−(р). Если концентрации катиона и аниона невелики, а это справедливо для малорастворимых сильных электролитов, состояние равновесия может быть описано соответствующей константой равновесия. СЛ.10(4) В данном случае она имеет специальное название и обозначение — произведение растворимости (ПР): Kc =[M+][A−] = ПР(МА).
Как и любая другая константа равновесия, произведение растворимости является величиной постоянной при постоянной температуре. При изменении температуры произведение растворимости изменяет свое значение.
СЛ.11(0) В более общем случае для малорастворимого сильного электролита MxAy уравнение фазового равновесия выглядит следующим образом: MxAy(т) Û xMa+(р)+ yAb−(р), тогда СЛ.11(1) ПР = [Ma+]x[Ab−]y.
Значения произведений растворимости являются справочными величинами.
Зная произведение растворимости малорастворимого сильного электролита, несложно найти величину его растворимости. СЛ.11(2) Согласно уравнению фазового равновесия, если концентрация насыщенного раствора вещества равна L, равновесные концентрации катионов и анионов составляют соответственно [Ma+] = xL и [Ab−] = yL. Подставляя эти соотношения в выражение для произведения растворимости, получим:
СЛ.11(3) ПР(MxAy) = (xL)x(yL)y = xxyyLx+y,
СЛ.11(4) 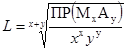
Используя произведение растворимости, можно сформулировать условия осаждения и растворения малорастворимых сильных электролитов.
Рассмотрим политерму растворимости вещества MA (рис. 4СЛ.12(0) ).
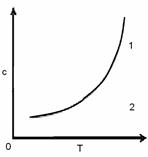
Рис. 4.Политерма растворимости вещества MA
В точках, соответствующих кривой растворимости (1), СЛ.12(1) c(M+)c(A−) = [M+][A−] = ПР.
СЛ.12(2) Если произведение концентраций c(M+)c(A−) < ПР, то точка на диаграмме растворимости находится в области ненасыщенных растворов (2), следовательно, внесенный в такой раствор осадок должен растворяться: MA(т) → M+(р) + A−(р).
СЛ.12(3) Если же произведение концентраций катионов и анионов c(M+)c(A−)>ПР, раствор пересыщен, и для достижения равновесия должно образоваться некоторое количество осадка: M+(р) + A−(р) → MA(т).
СЛ.13 В более общем случае для малорастворимого сильного электролита MxAy:
§ условие растворения осадка: [c(Ma+)]x· [c(Ab−)]y < ПР;
§условие выпадения осадка: [c(Ma+)]x· [c(Ab−)]y > ПР.
В соответствии с этими условиями и согласно принципу Ле Шателье, введение дополнительного количества одноименного иона (катиона или аниона), например в составе хорошо растворимого сильного электролита, сдвигает фазовое равновесие в сторону образования твердого вещества (т.е. выпадения дополнительного количества осадка). Это справедливо в том случае, если нет комплексообразования.
САМОСТОЯТЕЛЬНО