рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Запитання для самоконтролю
Реферат Курсовая Конспект
Запитання для самоконтролю
Запитання для самоконтролю - раздел Химия, Техніка безпеки в хімічній лабораторії 1. Які Значення Магнітного Квантового Числа Відповідають Орбітальному Квантов...
1. Які значення магнітного квантового числа відповідають орбітальному квантовому числу 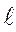 =1?
=1?
2. Яке максимальне число електронів відповідає підрівню з 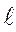 =1? Чому?
=1? Чому?
3. Чому на 3-му енергетичному рівні не може бути більше 18 електронів? Покажіть це, виходячи з комбінації квантових чисел.
4. Який енергетичний підрівень буде першим заповнюватись електронами: 3d або 4s?
5. Який енергетичний підрівень буде першим заповнюватись електронами: 3d або 4р?
6. Розрахуйте сумарний спін для 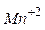 .
.
7. Який стан більш стійкий 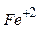 або
або 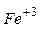 ?
?
8. Напишіть електронні формули (розподіл електронів за рівнями та підрівнями) для частинок 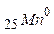 ,
, 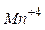 ,
, 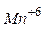
9. Перерахуйте електронні аналоги серед елементів ІІІ-ї групи періодичної системи Д.І.Менделєєва. До якого типу елементів
(s-, p-, d- або f-) вони відносяться?
10. Як і чому змінюється енергія йонізації в групах періодичної системи? Покажіть на прикладі елементів – V-ї групи
11. За якими правилами відбувається заповнення електронами атомних
орбіталей?
12. Наведіть стару та нову формуліровки періодичного закону Д.І.Менделєєва.
13. Як побудована періодична система Д.І.Менделєєва?
14. Який фізичний зміст величин періодичної системи?
15. Які закономірності періодичної системи?
16. Дайте визначення поняттям енергія іонізації, енергія спорідненості до електрона, електронегативність.
17. З чого складається план характеристики властивостей елементів по їх положенню в періодичній системі?
Самостійно вирішити задачі № 182, 186, 190, 192,193 [5. с. 41]
Література:
[1] с. 10-23; [2] с. 32-60; [3] с. 36-61; [4] с. 59-68; [5] с. 37-40
Виконайте експеримент та заповніть лабораторний журнал:
Дотримуйтесь правил техніки безпеки! (стор.5)
| № | Зміст роботи | Рівняння реакцій, спостереження, розрахунки | ||
Дослід №1
Електронна будова атомів і йонів металів
1.1 У першу пробірку налийте 1 мл розчину Плюмбум нітрату 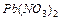 і додайте залізо і додайте залізо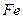 .
- Запишіть рівняння цієї окисно-відновної хімічної реакції.
- Запишіть повну електронну формулу атома Феруму 26Fe0 .
- Запишіть формулу валентних електронів і їх розподіл за квантовими комірками для Феруму і йона Fe+2 .
- Вкажіть значення квантових чисел для 3d-електронів атома Fe.
- Запишіть повну електронну формулу атома Плюмбуму 82Pb0.
- Запишіть формулу валентних електронів і їх розподіл за квантовими комірками для атома Плюмбуму Pb0 та його йона Pb+2. .
- Запишіть рівняння цієї окисно-відновної хімічної реакції.
- Запишіть повну електронну формулу атома Феруму 26Fe0 .
- Запишіть формулу валентних електронів і їх розподіл за квантовими комірками для Феруму і йона Fe+2 .
- Вкажіть значення квантових чисел для 3d-електронів атома Fe.
- Запишіть повну електронну формулу атома Плюмбуму 82Pb0.
- Запишіть формулу валентних електронів і їх розподіл за квантовими комірками для атома Плюмбуму Pb0 та його йона Pb+2.
| 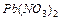 + +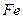 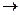

 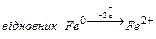 2 1 2 1
26Fe0 -1s22s22p63s23p63d64s2
82Pb0 -1s22s22p6………….
| |||
1.2 У другу пробірку налийте 1 мл розчину Плюмбум нітрату 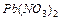 і додайте цинк.
- Запишіть повну електронну формулу атома Цинку 30Zn0.
- Запишіть формулу валентних електронів і їх розподіл за квантовими комірками для атома Цинку і йона Zn+2 .
- Вкажіть значення квантових чисел для електронів вказаного викладачем підрівня. і додайте цинк.
- Запишіть повну електронну формулу атома Цинку 30Zn0.
- Запишіть формулу валентних електронів і їх розподіл за квантовими комірками для атома Цинку і йона Zn+2 .
- Вкажіть значення квантових чисел для електронів вказаного викладачем підрівня.
| 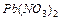 + +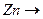 30Zn0 -1s2…………….
30Zn0 -1s2…………….
| |||
1.3 У третю пробірку налийте 1 мл розчину Плюмбум нітрату 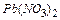 і додайте магній.
- Запишіть рівняння цієї окисно-відновної хімічної реакції.
- Запишіть повну електронну формулу атома Магнію 12Mg0 .
- Запишіть формулу валентних електронів і їх розподіл за квантовими комірками для атома Магнію 12Mg0 і йона Mg+2.
- Вкажіть значення квантових чисел для електронів вказаного викладачем підрівня. і додайте магній.
- Запишіть рівняння цієї окисно-відновної хімічної реакції.
- Запишіть повну електронну формулу атома Магнію 12Mg0 .
- Запишіть формулу валентних електронів і їх розподіл за квантовими комірками для атома Магнію 12Mg0 і йона Mg+2.
- Вкажіть значення квантових чисел для електронів вказаного викладачем підрівня.
| 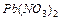 + +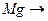 12Mg0 -1s2………………
12Mg0 -1s2………………
| |||
Дослід №2
Електрона будова атомів та йонів неметалів
2.1 У 1-у пробірку налийте розчин бромної води (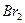 ) і додайте ) і додайте 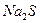 . Запишіть рівняння цієї окисно-відновної хімічної реакції.
- Запишіть повну електронну формулу атома Брому 35Br0.
- Запишіть формулу валентних електронів і їх розподіл за квантовими комірками для атома Брому 35Br0 і йона Br -.
- Запишіть повну електронну формулу атома Сульфуру 16S0.
- Запишіть формулу валентних електронів і їх розподіл за квантовими комірками для атома Сульфуру 16S0 і йона S-2.
- Вкажіть значення квантових чисел для електронів вказаного викладачем підрівня. . Запишіть рівняння цієї окисно-відновної хімічної реакції.
- Запишіть повну електронну формулу атома Брому 35Br0.
- Запишіть формулу валентних електронів і їх розподіл за квантовими комірками для атома Брому 35Br0 і йона Br -.
- Запишіть повну електронну формулу атома Сульфуру 16S0.
- Запишіть формулу валентних електронів і їх розподіл за квантовими комірками для атома Сульфуру 16S0 і йона S-2.
- Вкажіть значення квантових чисел для електронів вказаного викладачем підрівня.
|  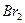 + +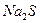 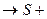
  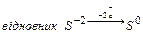 2 1 2 1
35Br0 -1s2………………..
16S0 -1s2……………….
| |||
2.2 У другу пробірку налийте бромної води (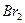 ) та додайте ) та додайте 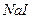 .
- Запишіть рівняння цієї окисно-відновної хімічної реакції.
- Запишіть повну електронну формулу атома Йоду 53I 0.
- Запишіть формулу валентних електронів і їх розподіл за квантовими комірками для атома Йоду 53I 0 і йона I –.
- Вкажіть значення квантових чисел для електронів вказаного викладачем підрівня. .
- Запишіть рівняння цієї окисно-відновної хімічної реакції.
- Запишіть повну електронну формулу атома Йоду 53I 0.
- Запишіть формулу валентних електронів і їх розподіл за квантовими комірками для атома Йоду 53I 0 і йона I –.
- Вкажіть значення квантових чисел для електронів вказаного викладачем підрівня.
| 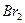 + +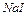  53I 0 -1s2………………..
I 0
53I 0 -1s2………………..
I 0  I – I –
|
Висновки і місце для домашніх задач:
Оцінка_____________ Дата_____________ Підпис викладача______________
– Конец работы –
Эта тема принадлежит разделу:
Техніка безпеки в хімічній лабораторії
СХІДНОУКРАЇНСЬКИЙ НАЦІОНАЛЬНИЙ УНІВЕРСИТЕТ імені ВОЛОДИМИРА ДАЛЯ... ЛАБОРАТОРНИЙ ЖУРНАЛ...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Запитання для самоконтролю
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?



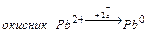 2 1
2 1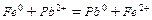


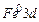 4s
4s 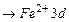 4s
4s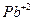
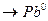

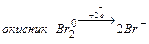 2 1
2 1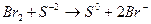
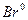
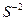





Новости и инфо для студентов