рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Образование и номенклатура пептидов
Реферат Курсовая Конспект
Образование и номенклатура пептидов
Образование и номенклатура пептидов - раздел Химия, Химия белков Важнейшим Свойством Аминокислот Является Их Способность К Ковалентному Взаимо...
Важнейшим свойством аминокислот является их способность к ковалентному взаимодействию за счет a-амино- и a -карбоксильной группы с образованием пептидной связи.
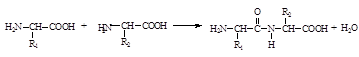
Пептидная связь -СО-NH- характеризуется планарностью - все атомы, входящие в пептидную группу, находятся в одной плоскости. Транс-конфигурация пептидной связи является более предпочтительной, поскольку она менее стерически затруднена R-группами, чем цис-форма.
В результате реакции поликонденсации аминокислот образуются пептиды (полигетероаминокислоты). Пептиды - полимерные соединения, структурной единицей которых являются аминокислоты.

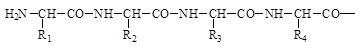
Поскольку в образовании пептидных связей принимают участие лишь a-амино и a-карбоксильные группы, пептиды имеют неразветвленный характер. Скелет (хребет, остов) пептидов состоит из регулярно повторяющихся структурных элементов.
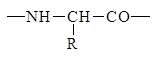
В пептидной цепи аминокислотные остатки расположены в определенной последовательности.
Пептиды обладают векторностью, пептидная цепь направлена от N-конца (начало цепи) к С-концу (конец цепи). N-конец - это конец, на котором находится свободная a-аминогруппа. С-конец - это конец, на котором находится свободная a-карбоксильная группа. В составе пептидной цепи N- и С-концы могут быть модифицированы. Векторность указывает направление, в котором происходит удлинение пептидов и белков при их синтезе. В соответствии с принятой векторностью осуществляется запись и чтение, входящих в состав пептидов, аминокислот.
Коэффициент поликонденсации характеризует число аминокислотных остатков, входящих в состав данного пептида. Условно принято, что пептиды, содержащие до 20 аминокислотных остатков, относятся к олигопептидам, среди которых различают ди-, три- тетрапептиды и т.д. Коэффициент поликонденсации полипептидов колеблется в диапазоне от 20 до 50.
Молекулярная масса пептидов зависит от характера и числа аминокислотных остатков. Поскольку средняя молекулярная масса одного аминокислотного остатка составляет около 110 Да, молекулярная масса пептидов варьирует в диапазоне от 200 до 6000Да.
НOМЕНКЛАТУРА ПЕПТИДОВ. Названия пептидов образуются в соответствии с последовательностью входящих в их состав аминокислотных остатков, начиная с N-конца. При этом в названиях всех аминокислотных остатков, за исключением последнего, меняется окончание на "ил", например : глицил-аланил- серил-цистеин. Наряду с полным названием используются сокращенные обозначения. При этом аминокислотная последовательность пептидов обозначается, начиная с N-конца, с использованием трехбуквенных сокращенных названий аминокислот, например: гли-ала-сер-цис. При записи аминокислотной последовательности белков может быть использовано и однобуквенное обозначение аминокислот. В медицине и биологии используются тривиальные названия пептидов, отражающие место их синтеза, особенности биологического действия или другие обстоятельства. Например, один из пептидов задней доли гипофиза - вазопрессин получил свое название в связи со способностью повышать тонус сосудов.
– Конец работы –
Эта тема принадлежит разделу:
Химия белков
Конформация глобулярных... Физико химические свойства белков...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Образование и номенклатура пептидов
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов