рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- ПЕРВИЧНАЯ СТРУКТУРА БЕЛКОВ
Реферат Курсовая Конспект
ПЕРВИЧНАЯ СТРУКТУРА БЕЛКОВ
ПЕРВИЧНАЯ СТРУКТУРА БЕЛКОВ - раздел Химия, Химия белков Белки (Протеины) - Это Высокомолекулярные Полимерные Соединен...
Белки (протеины) - это высокомолекулярные полимерные соединения пептидной природы (полигетероаминокислоты).
Первичная структура белков - это последовательность чередования аминокислотных остатков в полипептидной цепи (ППЦ).
Первичная структура белков является ковалентной структурой, поскольку в её основе лежит пептидная связь между a-амино- и a-карбоксильными группами аминокислот. Вследствие этого полипептидные цепи имеют неразветвленный характер.
Скелет (хребет, остов) полипептидной цепи состоит из регулярно повторяющихся структурных элементов
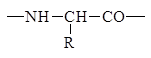
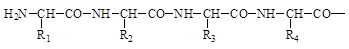
Полипептидная цепь обладает векторностью, направление цепи от N-конца (начало цепи) к C-концу (конец цепи), N-конец - это конец, на котором находится свободная a-аминогруппа. C-конец - это конец, на котором находится свободная a-карбоксильная группа. Аминокислотная последовательность белков обозначается, начиная с N-конца, с использованием трехбуквенных сокращенных названий аминокислот, например: гли-ала-цис-про. Может быть использовано и однобуквенное обозначение аминокислотных остатков в белке.
N- и C-концы в составе белков могут быть модифицированы. Аминогруппа на N-конце может быть ацетилирована, формилирована или метилирована. В ряде белков N-концевым является остаток пирролидонкарбоната (пироглутамата), не содержащий свободной аминогруппы. C-конец может быть амидирован. Модификации C-конца более редки по сравнению с N-концевыми модификациями.
Коэффициент поликонденсации белков варьирует в диапазоне от 50 до 2500. Обычно белок содержит 100-300 аминокислотных остатков. Поскольку средняя молекулярная масса одного аминокислотного остатка составляет около 110 Да, молекулярная масса белков варьирует в диапазоне от 6000 до миллионов Да.
Каждый индивидуальный белок обладает уникальной первичной структурой. Первым белком, чья первичная структура была установлена, явился инсулин. Это удалось сделать Сэнгеру. Его стратегия заключалась в следующем. Сначала он разделил две полипептидные цепи и далее провел их специфическое ферментативное расщепление на небольшие пептиды, содержащие перекрывающиеся последовательности. Затем, используя 1-фтор-2,4-динитробензол идентифицировал N-концевые остатки. Кроме того, он определил аминокислотный состав пептидов и в итоге смог установить их структуру, сравнивая последовательности перекрывающихся пептидов. В общих чертах стратегия Сэнгера сохранила свое значение до наших дней. Однако были предложены и иные подходы. Эдманом разработан метод автоматической процедуры последовательного отщепления и идентификации N-концевых аминокислотных остатков. Для расшифровки первичной структуры можно использовать рентгеноструктурный анализ. Последовательность аминокислотных остатков может быть определена по нуклеотидной последовательности матричной РНК.
В настоящее время установлена первичная структура более 2000 белков. Теоретически число различных вариантов первичной структуры белков безгранично. Даже для полипептида из 20 различных аминокислот, число возможных последовательностей составляет 20´1018. В живой природе реализуется лишь незначительная доля возможных последовательностей, общее число которых у всех видов живых организмов оценивается величиной 1010-1012. .
Первичная структура белков генетически детерминирована, т.е. последовательность аминокислот в белке определяется последовательностью нуклеотидов в ДНК. Искажения последовательности нуклеотидов ДНК приводят к возникновению аномальных белков с измененными биологическими свойствами, что является причиной молекулярной патологии. В частности, причиной серповидноклеточной анемии служит точечная мутация гена, контролирующего b-цепь гемоглобина. Следствием этого является замена в 6-ом положении b-цепи остатка глутамата на валин. Такая замена приводит к утрате одного отрицательного заряда в каждой из двух b-цепей , что приводит к изменению конформации гемоглобина и утрате его биологической функции.
Гомологичными белками называются белки, выполняющие у разных видов одинаковые функции. Примером может служить гемоглобин: у всех позвоночных он выполняет одну и ту же функцию, связанную с транспортом кислорода. Гомологичные белки характеризуются наличием во многих положениях одних и тех же аминокислот. Как оказалось, число аминокислотных остатков, по которым различаются гомологичные белки пропорционально филогенетическому различию между данными видами. Например, молекулы цитохромов С лошади и дрожжей различаются по 48 аминокислотным остаткам, тогда как те же молекулы курицы и утки – только по 2 остаткам. Что касается цитохромов С курицы и индейки, то они имеют идентичные аминокислотные последовательности. Сведения о числе различий в аминокислотных последовательностях гомологичных белков из разных видов используют для построения эволюционных карт, отражающих последовательные этапы возникновения и развития различных видов животных и растений в процессе эволюции.
– Конец работы –
Эта тема принадлежит разделу:
Химия белков
Конформация глобулярных... Физико химические свойства белков...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: ПЕРВИЧНАЯ СТРУКТУРА БЕЛКОВ
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов