ДОДАТКИ
ДОДАТКИ - раздел Химия, ЗАВДАННЯ ДЛЯ САМОСТІЙНОЇ РОБОТИ З ХІМІЇ Додаток 1 Таблиця Електронегативності Елементів (За Л. Полінгом)...
Додаток 1
Таблиця електронегативності елементів (за Л. Полінгом)
| H 2,1 | He - | ||||||||
| Li 1,0 | Be 1,5 | B 2,0 | C 2,5 | N 3,0 | O 3,5 | F 4,0 | Ne - | ||
| Na 0,9 | Mg 1,2 | Al 1,5 | Si 1,8 | P 2,1 | S 2,5 | Cl 3,0 | Ar - | ||
| K 0,8 | Ca 1,0 | Sc 1,3 | Ti 1,5 | V 1,6 | Cr 1,6 | Mn 1,5 | Fe 1,8 | Co 1,9 | Ni 1,9 |
| Cu 1,9 | Zn 1,6 | Ga 1,6 | Ge 1,8 | As 2,0 | Se 2,4 | Br 2,8 | Kr - | ||
| Rb 0,8 | Sr 1,0 | Y 1,2 | Zr 1,4 | Nb 1,6 | Mo 1,8 | Tc 1,9 | Ru 2,2 | Rh 2,2 | Pd 2,2 |
| Ag 1,9 | Cd 1,7 | In 1,7 | Sn 1,8 | Sb 1,9 | Te 2,1 | I 2,5 | Xе - | ||
| Cs 0,7 | Ba 0,9 | La-Lu 1,0-1,2 | Hf 1,3 | Ta 1,5 | W 1,7 | Re 1,9 | Os 2,2 | Ir 2,2 | Pt 2,2 |
| Au 2,4 | Hg 1,9 | Tl 1,8 | Pb 1,9 | Bi 1,9 | Po 2,0 | At 2,2 | Rn - | ||
| Fr 0,7 | Ra 0,9 | Ac 1,1 | Ku - | Ns - |
Додаток 2
Термодинамічні константи деяких речовин
| Речовина | Агрегатний стан | DН°298, кДж/моль | DG°298, кДж/моль | S°298, кДж/моль |
| NH3 O2 NO N2 NO2 H2O CO CO2 CH4 H2 C2H6 C2H4 H2S SO2 Sромб HCl Cl2 H2O ZnO Zn Mg(OH)2 CaSO4×2H2O CaSiO3 CaCO3 CaO Ca(OH)2 Na2CO3 AgNO3 Ag SiO2 NH4Cl Fe2O3 3CaO×2SiO2 BeCO3 Al2O3 Al BaCO3 | г г г г г г г г г г г г г г г г р к т т т т т т т т т т т т т т т т т т | -46,19 90,37 33,89 -241,84 -110,5 -393,51 -84,67 49,04 52,28 -20,15 296,9 -92,30 -285,84 -349,0 -924,66 -2033,67 -1579,0 -1206,0 -635,1 -986,2 -1129,0 -120,7 -859,3 -315,39 -821,32 -3826,9 -981,57 -1675,0 -1202,0 | 16,64 86,69 51,84 -288,8 -137,27 -394,38 -32,89 124,50 68,12 -33,02 -300,37 -95,27 -237,5 -318,19 -833,7 -1495,4 -1128,8 -604,2 -896,76 -1047,7 -32,2 -803,75 -343,64 -740,99 -944,75 -15,76,4 -1138,8 | 192,5 205,3 210,62 191,5 240,45 188,74 197,4 213,6 229,5 130,6 173,2 219,4 205,64 248,1 31,88 186,7 223,0 69,96 43,5 41,59 63,14 193,97 87,45 92,9 39,7 83,4 136,0 140,9 42,69 42,09 94,56 89,96 211,01 199,4 50,94 28,31 112,1 |
Додаток 3
Ряд напруг металів
| Метал | Катіон у розчині | Стандартний потенціал, В | Метал | Катіон у розчині | Стандартний потенціал, В |
| Літій Калій Рубідій Барій Стронцій Кальцій Натрій Магній Берилій Алюміній Титан Цирконій Ванадій Марганець Хром Цинк Залізо Полоній | Li+ K+ Rb+ Ba2+ Sr2+ Ca2+ Na+ Mg2+ Be2+ Al3+ Ti2+ Zr2+ V2+ Mn2+ Cr2+ Zn2+ Fe2+ Po4+ | -3,01 -2,92 -2,98 -2,92 -2,89 -2,84 -2,74 -2,38 -1,70 -1,66 -1,63 -1,53 -1,18 -1,05 -0,91 -0,76 -0,44 -0,40 | Кадмій Талій Кобальт Нікель Молібден Германій Олово Свинець Водень Бісмут Стибій Арсен Мідь Ртуть Срібло Платина Золото | Cd2+ Ta2+ Co2+ Nі2+ Mo3+ Ge4+ Sn2+ Pb2+ H+ Bi3+ Sb3+ As3+ Cu2+ Hg2+ Ag+ Pt2+ Au+ | -0,40 -0,34 -0,27 -0,23 -0,20 -0,15 -0,14 -0,13 +0,22 +0,24 +0,30 +0,34 +0,798 +0,799 +1,19 +1,7 |
Додаток 4
Добуток розчинності (ДP) важкорозчинних сполук у воді при 25 °С
| Сполука | ДP | Сполука | ДP |
| AgCl | 1,8×10-10 | HgS | 1,6×10-52 |
| AgSCN | 1,1×10-12 | Mg(OH)2 | 6×10-10 |
| Ag2Cr2O7 | 1,0×10-10 | Mn(OН)2 | 2×10-13 |
| Ag2CrO4 | 1,1×10-12 | Mn(OH)3 | 1×10-36 |
| BaCO3 | 4×10-9 | MnS | 2,5×10-13 |
| BaCrO4 | 1,2×10-12 | NiCO3 | 1,3×10-7 |
| BaSO4 | 1,1×10-10 | NiC2O4 | 4×10-10 |
| BaMnO4 | 2,5×10-10 | Ni(OH)2 | 6,3×10-18 |
| CaCO3 | 3,8×10-9
| PbCO3 | 7,5×10-14 |
| CaSO4×2H2O | 2,5×10-5 | PbCl2 | 2×10-5 |
| CdS | 1,6×10-28 | PbCrO4 | 1,8×10-14 |
| CdCO3 | 1×10-12 | Pb(OH)2 | 5×10-16 |
| Co(OH)2 | 2×10-15 | PbS | 2,5×10-27 |
| CuC2O4 | 2,5×10-22 | PbSO4 | 1,6×10-8 |
| Cu2S | 1×10-48 | SnS | 2,5×10-27 |
| CuS | 6×10-38 | Sn(OH)4 | 1×10-57 |
| FeCO3 | 3,5×10-11 | SrCO3 | 4×10-8 |
| Fe(OH)2 | 8×10-16 | SrSO4 | 3,2×10-7 |
| Fe(OH)3 | 6,3×10-38 | Zn(OH)2 | 1×10-17 |
| FeS | 5×10-18 | ZnS | 1,6×10-24 |
Додаток 5
Стандартні електродні потенціали 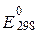 деяких окисно-відновних систем у водних розчинах
деяких окисно-відновних систем у водних розчинах
| № п/п | Електродний процес | 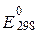 , В , В
|
| Ag+ + e = Ag | 0,799 | |
| Al 3+ + 3e = Al | -0,663 | |
| Ca2+ + 2e = Ca | -2,866 | |
| Cu2+ + 2e = Cu | 0,337 | |
| Zn2+ + 2e = Zn | -0,763 | |
| Pb4+ + 2e = Pb2+ | 1,694 | |
| J2(тв) + 2e = 2J- | 0,536 | |
| HIO + H+ + e = ½ J2 + H2O | 1,45 | |
| SiF62- + 4e = Si + 6F- | -1,20 | |
| SiO32- + 3H2O + 4e = Si + 6OH- | -1,73 | |
| H3PO3 + 3H+ + 3e = P + 3H2O | -0,49 | |
| PO43- +2H2O + 2e = HPO32- + 3OH- | -1,05 | |
| H3PO4 + 2H+ + 2e = H3PO3 + H2O | -0,276 | |
| H2SO3 +4H++ 4e = S + 3H2O | 0,45 | |
| SO42- + H2O + 2e= SO32- + 2OH- | -0,90 | |
| SO32- + 3H2O + 6e= S2- + 6OH- | -0,61 | |
| 2SO32- + 3H:O + 4e = S2O32- + 6OH- | -0,58 | |
| SO42- + 2H+ + 2e = H2S04 + H2O | 0,20 | |
| S2O62- + 4H+ + 2e = H3SO3+ H2O | 0,20 | |
| S + 2e = S2- | -0,48 | |
| SO42- + 8H+ + 8e = S2- + 4H2O | 0,149 | |
| SO42- + 4H+ + 2e = H2SO4 + H2O | 0,17 | |
| 2NO3-+ 2H2O +2e= N2O4 + 4OH- | -0,85 | |
| NO3- + NO + e = 2NO2 | -0,58 | |
| NO2- + H2O + e = NO + 2OH- | -0,46 | |
| NO3- + 5H2O + 6e = NH2OH + 7OH- | -0,30 | |
| N2O22- + 6H2O + 4e = 2NH2OH + 6OH- | -0,73 | |
| N2O+ H2O + 6H+ + 4e = 2NH3OH+ | -0,05 | |
| NO3- +H2O + 2e = NO2- + 2OH- | 0,01 | |
| 2NO2- +3H2O + 4e = N2O +6OH- | 0,15 | |
| HNO2 +5H+ +4e = NH3OH+ +H2O | 0,62 | |
| NO3-+ 3H+ + 2e = HNO2+ H2O | 0,94 | |
| NO3- + 4H+ +3e = NO + 2H2O | 0,96 | |
| HNO3 + H+ + e = NO + H2O | 1,00 | |
| 2HNO3 + 4H+ + 4e = N2O + 3H2O | 1,29 | |
| NH3 + 3H+ + 2e = NH4+ + H2 | 1,96 | |
| Fe2S3 + 2e = 2FeS + S2- | -0,67 | |
| Fe(OH)3 + e = Fe(OH)2 + OH- | -0,56 | |
| Fe2+ + 2e = Fe | -0,440 | |
| Fe3+ + 3e = Fe | -0,037 | |
| Fe3+ + e = Fe2+ | 0,771 | |
| FeO42- +8H++ 3e = Fe3+ +4H2O | 1,90 | |
| Mn(OH)3 + e = Mn(0H)2 + OH- | -0,40 | |
| MnO2 + H2O + 2e = Mn(OH)2 +2OH- | -0,05 | |
| Mn(OH)3 +e= Mn(OH)2 +OH- | 0,10 | |
| MnO4- +2H2O + 3e = MnO2 + 4OH- | 0,57 | |
| MnO42- +2H2O +3e = MnO2 + 4OH- | 0,58 | |
| MnO2 + 4H+ + 2e = Mn2+ +2H2O | 1,23 | |
| Mn3+ + e = Mn2+ | 1,51 | |
| MnO4- + 8H+ + 5e = Mn2+ + 4H2O | 1,51 | |
| MnO4- + e = MnO42- | 0,54 | |
| ClO3- + H2O + e = ClO2 + 2OH- | -0,45 | |
| ClO4- +H2O +2e= ClO3- + 2OH- | 0,17 | |
| ClO3- + H2O + 2e = ClO2- + 2OH- | 0,35 | |
| ClO2- + H2O + 2e = ClO- + 2OH- | 0,59 | |
| ClO3- + 3H2O + 6e = ClO- + 6OH- | 0,62 | |
| ClO4- +4H2O +8e = Cl- + 8OH- | 0,51 | |
| 2C1O- + 2H2O +2e = Cl2+ 4OH- | 0,52 | |
| ClO2- + H2O + 2e = CIO- + 2OH- | 0,66 | |
| ClO- + H2O + 2e = Cl- + 2OH- | 0,89 | |
| ClO4- + 2H+ + 2e = ClO3- + H2O | 1,19 | |
| C1O3- + 3H+ +2e = HC1O2 + H2O | 1,21 | |
| ClO4- + 8H+ + 7e = 1/2Cl2 + 4H2O | 1,34 | |
| ClO3- + 6H+ +6e= Cl- + 3H2O | 1,45 | |
| Cl2 + 2e = 2Cl- | 1,36 | |
| HC1O + H+ + 2e =Cl- +H2O | 1,49 | |
| HC1O2 +3H+ + 4e = Cl- + 2H2O | 1,56 | |
| CrO42- +4H2O + 3e = Cr(OH)3 + 5OH- | -0,12 | |
| Cr2O72- +14H+ +6e= 2Cr3+ + 7H2O | 1,33 | |
| CrO42- +6H+ + 3e = Cr3+ + 3H2O | 1,335 | |
| Cr3+ + e = Cr2+ | -0,41 | |
| JO3- + 6H+ +5e = 1/2J2 +3H2O | 1,195 | |
| JO3- + 3H2O + 6e = J-+ 6OH- | 0,26 | |
| BrO3- + 3H2O + 6e = Br -+6OH- | 0,61 | |
| BrO-+H2O + 2e = Br- + 2OH- | 0,76 | |
| Br2 + 2e = 2Br- | 1,065 | |
| HBrO + H+ +2e = Br- + H2O | 1,33 | |
| BrO3- + 6H+ + 5e = ½ Br2 + 3H2O | 1,52 | |
| HBrO + H+ + e = ½ Br2 + H2O | 1,59 | |
| ½ H2 + e = H- | -2,23 | |
| 2H+ + 2e = H2 | 0,000 | |
| 2H+ + 2e = H2 (pH = 7) | -0,414 | |
| O2 + e = O2- | -0,56 | |
| O2 +2H2O + 4e = 4OH- | 0,401 | |
| O2 + 4H+ + 4e = 2H2O | 1,229 | |
| O2 + 2H+ + 2e = H2O2 | 0,682 | |
| H2O2 +2H+ + 2e = 2H2O | 1,77 | |
| PbO2 + 4H+ + 2e = Pb2+ + 2H2O | 1,455 |
Фізичні величини та числові значення деяких констант:
- одиниці маси (m) 1 г = 10-3 кг;
- одиниці об’єму (V) 1 дм3 = 1 л = 10-3 м3;
- одиниці густини (r) 1 г/мл або г/см3 = 10-3 г/л або г/дм3 або кг/м3;
- одиниці часу (t) 1 год = 60 хв або 3600 с;
- одиниці тиску (р) 1 атм = 760 мм рт.ст. = 100325 Па = 101,3 кПа або
1мм рт.ст. =1,31×10-3 атм = 133,322 Па;
- одиниці теплоти та енергії (Q, E) 1 кал = 4,1868 Дж або
1 еВ = 1,602×10-19 Дж;
- одиниця електричного заряду (Q, q) 1- = 1,602×10-19 Кл;
- число Авогадро (С12 = 12,0000…..) NА = 6,02252×1023 моль-1;
- заряд електрона - = (4,8030 ± 0,001) × 10-10 ел.ст.од. = 1,602 × 10-19 Кл;
- маса електрона m = 9,1091 × 10-31 кг = 0,00054860 а.о.м.;
- газова стала R = 1,9872 кал× град-1×моль-1 = 8,3143 Дж ×К-1×моль-1 =
= 0,082057 л× атм× град-1×моль-1;
- молярний об’єм (ідеальний газ, 0°С, 1 атм) = 22,414×103 см3×моль-1 =
=22,414 л = 2,241436 ×10-2 м3 ×моль-1;
- стала Планка h = 6,6256 × 10-27 ерг × с = 6,6256 × 10-34 Дж × с;
- швидкість світла у вакуумі = 2,99795 × 108 м × с-1;
- p = 3,14159;
- е = 2,7183;
- ln 10 = 2,3026;
- константа Фарадея F = 96487 Кл/моль;
- абсолютна температура плавлення льоду Т пл. льоду = 273,15 К;
– Конец работы –
Эта тема принадлежит разделу:
ЗАВДАННЯ ДЛЯ САМОСТІЙНОЇ РОБОТИ З ХІМІЇ
КИЇВСЬКИЙ НАЦІОНАЛЬНИЙ УНІВЕРСИТЕТ... БУДІВНИЦТВА І АРХІТЕКТУРИ...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: ДОДАТКИ
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов