рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Коллигативные свойства растворов
Реферат Курсовая Конспект
Коллигативные свойства растворов
Коллигативные свойства растворов - раздел Химия, Основные понятия в химии Многие Свойства Растворов Зависят Не Только От Концентрации Растворенного В Н...
Многие свойства растворов зависят не только от концентрации растворенного в нем вещества, но и от природы этого вещества. Например, плотность раствора зависит от индивидуальных свойств растворителя и растворенного вещества, а также от концентрации последнего. Однако некоторые физические свойства растворов определенного типа зависят только от концентрации частиц растворенного вещества и не зависят от индивидуальных свойств растворенного вещества. Эти свойства называют коллигативными. К их числу относятся понижение давления паров, повышение температуры кипения, понижение температуры затвердевания и осмотическое давление раствора.
3.1 Понижение давления паров
Если в некотором растворителе растворяют нелетучее вещество, равновесное давление паров растворителя при этом понижается. Например, растворы сахара или поваренной соли в воде имеют более низкое давление паров, чем чистая вода. Количественное описание давления паров растворов, содержащих нелетучие растворенные вещества, дает закон Рауля.
р(А)=Х(А)´ро(А) (3.1.1)
где р(А)-давление паров раствора, Па, Х(А)-мольная доля растворителя, ро(А)-давление паров чистого растворителя, Па.
3.2 Повышение температуры кипения
Повышение температуры кипения DТкип (относительно температуры кипения чистого растворителя) пропорционально числу растворенных частиц в расчете на моль молекул растворителя. Напомним, что моляльность раствора - это число молей растворенного вещества в 1000 г растворителя, а следовательно, в определенном числе молей растворителя. Таим образом, DТкип пропорциональна моляльности раствора:
DТкип=Ккип´Сg (3.2.1)
Коэффициент пропорциональности Ккип, называемый моляльной константой повышения температуры кипения, зависит от растворителя.
3.3 Понижение температуры затвердевания
Температура затвердевания жидкости соответствует такой температуре, при которой уравниваются давления паров твердой и жидкой фаз. Понижение температуры затвердевания раствора объясняется тем, что растворенное вещество обычно нерастворимо в твердой фазе растворителя. Точка, соответствующая состоянию равновесия между твердой фазой и жидким раствором, лежит слева от точки равновесия для чистого растворителя, т.е. в области более низких температур. Как и повышение температуры кипения, понижение температуры затвердевания, DТзатв, пропорционально моляльности раствора:
DТзатв=Кзатв´Сg (3.3.1)
Коэффициент пропорциональности Кзатв - моляльная константа понижения температуры затвердевания.
В табл. 3.3.1 приведен ряд типичных значений Ккип и Кзатв для нескольких распространенных растворителей.
Таблица 3.3.1
Моляльные константы повышения температуры кипения и понижения температуры затвердевания некоторых растворителей
| Растворитель | Нормальная температура кипения, оС | Ккип, оС/моль | Нормальная температура затвердевания, оС | Кзатв, оС/моль | |
| Формула | Название | ||||
| Н2О | Вода | 100.0 | 0.52 | 0.0 | 1.86 |
| С6Н6 | Бензол | 80.1 | 2.53 | 5.5 | 5.12 |
| ССl4 | Тетрахлоридуглерода | 76.8 | 5.02 | -22.3 | 29.8 |
| С2Н5ОН | Этанол | 78.4 | 1.22 | -114.6 | 1.99 |
| НССl3 | Хлороформ | 61.2 | 3.63 | -63.5 | 4.68 |
3.4 Осмос
Ряд материалов определенного типа, в том числе многие мембраны в биологических системах, обладает свойством полупроницаемости, т.е. способностью пропускать частицы одного сорта и не пропускать частицы других сортов.
Осмос представляет собой результат проникания молекул растворителя, но не растворенного вещества, через полупроницаемую мембрану из более разбавленного раствора в более концентрированный.
Давление, которое требуется создать, чтобы остановить осмос из чистого растворителя в раствор, называется осмотическим давлением (росм) этого раствора. Осмотическое давление связано с концентрацией раствора уравнением:
росм=См´R´T (3.4.1)
где росм - осмотическое давление, кПа, См - моляльность раствора, М, R - универсальная газовая постоянная, (R=8.31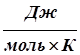 ), Т - абсолютная температура, К.
), Т - абсолютная температура, К.
Когда полупроницаемой перегородкой разделены два раствора, обладающие одинаковым осмотическим давлением, проникания растворителя через перегородку не наблюдается. Такие два раствора называются изотоническими. Раствор, обладающий меньшим осмотическим давлением по сравнению с более концентрированным раствором, называют гипотоническим, а второй, более концентрированный, раствор - гипертоническим.
– Конец работы –
Эта тема принадлежит разделу:
Основные понятия в химии
Все вещества состоят из химических элементов Например составными частями серной кислоты Н SO являются элементы водород сера и кислород... Химические элементы составные части простых и сложных веществ каждый... Число нейтронов содержащихся в ядрах данного элемента в отличие от числа протонов может быть различным Атомы...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Коллигативные свойства растворов
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов