рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Основные понятия в химии
Реферат Курсовая Конспект
Основные понятия в химии
Основные понятия в химии - раздел Химия, 1. Основные Понятия В Химии Все Вещества Состоят Из Химических Элеме...
1. Основные понятия в химии
Все вещества состоят из химических элементов. Например, составными частями серной кислоты Н2SO4 являются элементы водород, сера и кислород.
Химические элементы - составные части простых и сложных веществ; каждый химический элемент представляет собой совокупность атомов с одинаковым зарядом ядра. Закономерности в химических свойствах элементов отражает периодическая система элементов Д. И. Менделеева. Атомный номер элемента равен заряду ядра, выраженному в единицах заряда протона; численно заряд ядра равен количеству протонов, содержащихся в ядрах атомов данного химического элемента.
Число нейтронов, содержащихся в ядрах данного элемента, в отличие от числа протонов, может быть различным. Атомы одного элемента, ядра которых содержат разное число нейтронов, называются изотопами. Атом с определенным числом протонов и нейтронов в ядре называется нуклидом. Общее число протонов и нейтронов в ядре называется массовым числом. Каждому химическому элементу соответствует совокупность определенных атомов.
Атом - структурная основная единица вещества; это мельчайшая частица элемента, которая может соединяться с другими элементами.
Атомная масса (Аr) - значение массы атома, выраженное в атомных единицах массы (а. е. м.). Атомная единица массы равна 1/12 массы нуклида 12С.
1 а. е. м. = 1.66´10-27 кг
Аr (Br) = 79,91 а. е. м.
Ar (Nb) = 92,91 а. е. м.
Молекула - совокупность прочно связанных атомов, которая ведет себя во многих отношениях как единое целое. Молекула состоит из атомов одного или различных химических элементов и существует как единая динамическая система атомных ядер и электронов. Атомы объединяются в молекулу благодаря химическим связям, в образовании которых принимают участие в основном внешние (валентные) электроны.
Вещества, образованные атомами одного химического элемента, называются простыми. Например, сера (S), железо (Fe), озон (О3), азот (N2).
Сложные вещества образованы атомами разных химических элементов и могут иметь состав постоянный или меняющийся в некоторых пределах. Например, молекула гидрокарбоната калия KHCO3 состоит из атомов калия, водорода, углерода и кислорода.
Молекулярная масса (Мr) - средняя масса “формульного” состава соединения, включающего атомы отдельных элементов в их природном изотопном составе, выраженная в атомных единицах массы (а. е. м.).
Мr (KCl) = 74,56 а. е. м.
Мr ((NH4)2SO4´Fe2(SO4)3´24 H2O) = 964,42 а. е. м.
Моль - множество, состоящее из числа Авогадро структурных единиц. Структурные единицы могут быть атомами, молекулами, ионами, электронами и другими частицами. Численное значение числа Авогадро: NA = 6,022´1023 моль-1.
Число молей (n) в массе (m (г)) определяется по формуле:
n=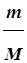 , (1.1)
, (1.1)
где М - молярная масса вещества, г/моль.
Молярная масса (М) - масса одного моля вещества. Молярная масса (г/моль) численно равна молекулярной массе вещества, выраженной в атомных единицах массы. В системе СИ молярная масса выражается в кг/кмоль. В расчетах по химическим уравнениям допустимо молярную массу выражать в граммах.
М(KCl) = 74,56 г/моль
М((NH4)2SO4´Fe2(SO4)3´24 H2O) = 963,42 г/моль
Примеры решения задач
Пример 1
Какова масса 1 моля глюкозы С6Н12О6?
Решение. Суммируя атомные массы элементов в формуле глюкозы, найдем ее молекулярную массу:
Мr (C) = 6´12 а. е. м. = 72,0 а. е. м.
Мr (H) =12´1 а. е. м. = 12 а. е. м.
Мr (О) = 6´16 а. е. м. = 96 а. е. м.
 Мr (C6H12O6) = 180 а. е. м.
Мr (C6H12O6) = 180 а. е. м.
Следовательно, 1 моль С6Н12О6 имеет массу 180 г.
Пример 2
Сколько атомов С содержится в 1 моле С6Н12О6?
Решение. В одном моле содержится 6,02´1023 молекул С6Н12О6 . Каждая молекула содержит 6 атомов С, следовательно, в 1 моле глюкозы содержится 6´(6,02´1023) атомов С:


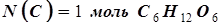
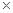 6,02´1023 молекул
6,02´1023 молекул 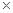 6 атомов С
6 атомов С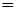
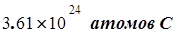
1 моль 1 молекула
Пример 3
Сколько молей глюкозы С6Н12О6 содержится: а) в 538 г и б) в 1,00 г этого вещества?
Решение. а) Один моль С6Н12О6 обладает массой 180 г (см. пример 1). Число молей С6Н12О6: n 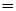
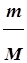
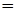
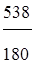 = 2,99 моля.
= 2,99 моля.
б) Число молей С6Н12О6 в 1,00 г этого вещества: n = 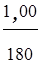 = 5,56´10-3 моля.
= 5,56´10-3 моля.
Пример 4
Сколько молекул глюкозы содержится в 5,23 г С6Н12О6?
Решение. Число молекул С6Н12О6 определяется по формуле:
N = 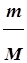
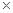 NA =
NA = 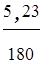
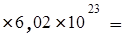 1,75´1022 молекул.
1,75´1022 молекул.
Пример 5
Какова масса 1,00 ´ 1023 молекул С6Н12О6в граммах?
Решение. 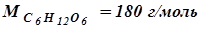 Масса С6Н12О6 определяется по формуле:
Масса С6Н12О6 определяется по формуле:
m=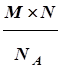 =
=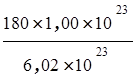 = 29,9 г
= 29,9 г
Упражнения
а) С3Н8; б) SO2; в) SiH4; г) В5Н11; д) Н3PO4. 2. Определите массу: а) 2 молей СО2; б) 3,58´1022 атомов Kr; в)… 3. Какую массу должен иметь образец металлического натрия, чтобы в нем содержалось столько атомов Na, сколько атомов…Примеры решения задач
Пример 1
Определим эквивалент и эквивалентную массу меди в оксидах Cu2Oи CuO.
В оксиде Cu2O - медь одновалентна; M (Cu)=64 г/моль
Э(Cu)=1 моль, mэ(Cu)=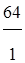 =64 г/моль
=64 г/моль
В оксиде CuO - медь двухвалентна, значит
Э(Cu)=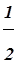 моль, mэ(Cu)=
моль, mэ(Cu)=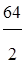 =32 г/моль
=32 г/моль
Эквивалентная масса сложного вещества равна сумме эквивалентных масс его составных частей. Составными частями молекулы в этом случае следует считать те ее части, которые в неизменном виде переходят из исходных веществ в продукты реакции. Например, эквивалентная масса оксида состоит из эквивалентной массы металла или неметалла и кислорода:
mэ (оксида)=mэ (металла)+mэ (кислорода) (1.12)
Эквивалентная масса соли состоит из эквивалентной массы металла и эквивалентной массы кислотного остатка:
mэ (соли)=mэ (металла)+mэ (кислотного остатка) (1.13)
Эквивалентная масса кислотного остатка равна его молярной массе, деленной на заряд кислотного остатка.
Между массой вещества и его эквивалентной массой существует зависимость:
m=nэ´mэ , (1.14)
где m - масса вещества; nэ - количество эквивалентов вещества; mэ - эквивалентная масса вещества.
Между количеством и числом эквивалентов данного вещества существует зависимость:
nэ=n/Э, (1.15)
где n - количество вещества; nэ - число эквивалентов вещества; Э - эквивалент вещества.
Примеры решения задач
Пример 1
Сколько эквивалентов содержится в 450 г MgSO4?
Решение. По формуле (1.11) вычислим эквивалентную массу сульфата магния:
mэ(MgSO4)=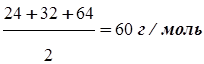
Воспользовавшись формулой (1.15), рассчитаем число эквивалентов:
nэ=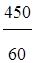 =7,5 моль
=7,5 моль
Пример 2
Сколько грамм составляют 7 эквивалентов AgNO3?
Решение. По формуле (1.11) вычислим эквивалентную массу нитрата серебра:
mэ(AgNO3)=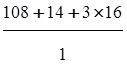 =170 г/моль
=170 г/моль
Преобразовав формулу (1.14), рассчитаем массу соли:
m=nэ´mэ=7´170=1190 г
Упражнения
2. Сколько эквивалентов содержится в 320 г CuSO4? 3. Вычислите эквиваленты и эквивалентные массы H2SO4 и Al(OH)3 в реакциях,… 4. Одно и тоже количество металла взаимодействует с 0,2 г кислорода и с 3,2 г галогена. Вычислите эквивалентную массу…Способы выражения концентраций
Компонент раствора, физическое состояние которого сохраняется при образовании раствора, принято считать растворителем. Например, при смешении… 2.1 Молярную концентрацию раствора определяют как число молей вещества,… См=Пример
Напишите выражение для константы равновесия каждой из следующих реакций:
a) CO2(г.)+Н2(г.)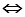 СО2(г.)+Н2О(ж.)
СО2(г.)+Н2О(ж.)
б)SnO2(тв.)+2СО(г.)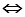 Sn(тв.)+2СО2(г.)
Sn(тв.)+2СО2(г.)
Решение. а) поскольку вода участвует в данной реакции в виде чистой жидкости, ее концентрацию не следует включать в выражение для константы равновесия:
K=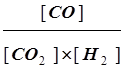
б) поскольку SnO2 и Sn являются чистыми твердыми веществами, они не входят в выражение для константы равновесия:
K=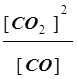
7.2.2 Кажущаяся константа равновесия
Допустим, что смесь 2,0 моля Н2, 1,00 моля N2 и 2,00 моля NH3 поместили в сосуд объемом 1 л при температуре 472 К. Будет ли реакция между N2 и Н2 давать дополнительное количество NH3? Подставив начальные концентрации N2, H2 и NH3 в выражение для константы равновесия реакции, найдем:
K =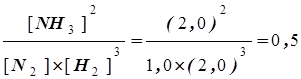
В примере раздела 7.2 было установлено, что при заданной температуре Кс=0,105. Следовательно, для того чтобы система приблизилась к равновесию,
отношение 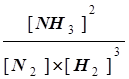 должно уменьшиться с 0,500 до 0,105. Это произойдет при уменьшении [NH3] и увеличении [N2] и [H2]. Следовательно, по мере образования N2 и Н2 из NH3 реакция будет смещаться в сторону установления равновесия, другими словами, реакция должна протекать справа налево.
должно уменьшиться с 0,500 до 0,105. Это произойдет при уменьшении [NH3] и увеличении [N2] и [H2]. Следовательно, по мере образования N2 и Н2 из NH3 реакция будет смещаться в сторону установления равновесия, другими словами, реакция должна протекать справа налево.
Подставляя произвольные концентрации реагентов и продуктов в выражение для константы равновесия, мы получим кажущуюся константу равновесия, которую обозначают буквой Q. Кажущаяся константа равновесия становится равной истинной константе равновесия К только тогда, когда концентрации всех компонентов реакционной системы достигнут своих равновесных значений, т.е. Q=K только при равновесии. Если кажущаяся константа равновесия больше К, то вещества, указанные в правой части химического уравнения реакции, должны реагировать с образованием веществ, указанных в его левой части, другими словами, реакция приближается к равновесному состоянию, смещаясь справа налево. Следовательно, если Q>K, реакция сдвигается справа налево. И наоборот, если Q<K, реакция приближается к равновесному состоянию с образованием дополнительного количества продуктов (смещается слева направо).
7.2.3 Вычисление равновесных концентраций
Если нам известна константа равновесия некоторой реакции, то мы можем вычислить концентрации веществ в реакционной смеси при равновесии. Сложность такого расчета зависит от нескольких факторов: сложности химического уравнения реакции и от того, какие концентрации уже известны. Общий характер подобных расчетов станет понятен после решения следующих примеров.
Пример 1
При каком парциальном давлении NH3 находится в равновесии с N2 и Н2 при 500°С, если равновесное парциальное давление Н2 равно 0,733 атм., а N2 0,527 атм. При 500°С для реакции N2(г.)+3Н2(г.)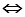 2NH3(г.) константа равновесия Кр=1,45
2NH3(г.) константа равновесия Кр=1,45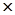 10-5.
10-5.
Решение. Кр=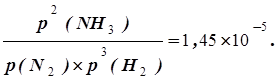
Поскольку значения Кр, р(N2) и р(Н2) заданы, из выражения для константы равновесия можно найти р(NH3):
p2(NH3)=Kp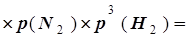 (1,45
(1,45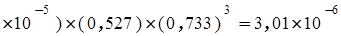 ,
,
откуда р(NH3)=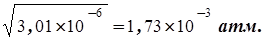
Пример 2
В сосуде объемом 1 л находится 0,50 моля HI при 448°С. Значение константы равновесия Кс для реакции Н2(г.)+I2(г.)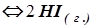 при указанной температуре равно 50,5. Каковы концентрации Н2, I2 и HI в сосуде при равновесных условиях?
при указанной температуре равно 50,5. Каковы концентрации Н2, I2 и HI в сосуде при равновесных условиях?
Решение. В данном случае не известна ни одна из равновесных концентраций; заданы лишь исходные концентрации [H2]=[I2]=0 и [HI]=0,50 M. Для того, чтобы выразить равновесные концентрации через начальные концентрации, необходимо воспользоваться полным уравнением реакции. Для этого построим таблицу концентраций. Обозначим количество HI, которое прореагирует с образованием Н2 и I2, через Х. При разложении Х молей HI образуется (Х/2) молей Н2 и (Х/2) молей I2. Таким образом:
Н2(г.)I2(г.)2HI(г.)
Исходные концентрации 0 М 0 М 0,50 М
Изменение концентраций (Х/2) М (Х/2) М Х М
Равновесные концентрации (Х/2) М (Х/2)М (0,50-Х) М
Теперь подставим равновесные концентрации в выражение для константы равновесия и вычислим с ее помощью единственную неизвестную величину Х:
Kc=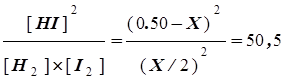
X=0,11M
Равновесные концентрации участников реакции таковы:
[H2]=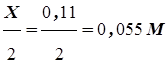
[I2]=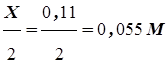
[HI]=0,50-0,11=0,39 M
7.2.4 Факторы, влияющие на равновесие. Принцип Ле Шателье.
Для предсказания влияния изменений внешних условий на поведение равновесной системы пользуются принципом Ле Шателье, который гласит: если равновесие в системе нарушается в результате изменения температуры, давления или концентрации одного из компонентов, положение равновесия смещается таким образом, чтобы противодействовать этому изменению.
В системе, находящейся в состоянии динамического равновесия, прямой и обратный процессы протекают с одинаковыми скоростями. Изменение условий, в которых находится система, может нарушить состояние равновесия. В результате этого равновесие смещается до тех пор, пока не установится новое равновесие. Принцип Ле Шателье указывает, что смещение равновесия должно происходить в таком направлении, чтобы свести к минимуму или уменьшить влияние воздействия, вызвавшего нарушение равновесия. Следовательно, если в химическую систему, находящуюся в равновесии, добавить какое-либо вещество (реагент или продукт), реакция смещается таким образом, чтобы равновесие восстанавливалось в результате поглощения части добавленного вещества. И наоборот, удаление из равновесной системы какого-либо вещества приводит к смещению равновесия в направлении, соответствующем образованию дополнительного количества данного вещества.
Если повышать полное давление системы, находящейся в состоянии равновесия, путем уменьшения ее объема, то система реагирует на это смещением равновесия в сторону уменьшения объема. Практически это означает, что смещение происходит в сторону уменьшения числа молей газа в системе. И наоборот, уменьшение давления в результате увеличения объема приводит к смещению реакции в сторону образования дополнительного количества молекул газа.
Изменение концентраций или полного давления могут вызывать смещение равновесия, но константа равновесия при этом не изменяется. Однако изменения температуры влияют на величину констант равновесия почти всех реакций. Константы равновесия всех экзотермических реакций, т.е. реакций, протекающих с выделением теплоты, при повышении температуры уменьшаются. В отличие от этого константы равновесия эндотермических реакций с повышением температуры увеличиваются. Следовательно, если реакция в прямом направлении является экзотермической, в обратном направлении она должна быть эндотермической; если теплота подводится к равновесной системе, которая является экзотермической в направлении прямой реакции, то равновесие смещается в обратном направлении, т.е. в сторону образования реагентов.
Пример
Рассмотрим реакцию:
N2O4(г.)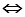 2NO2(г.)
2NO2(г.) 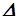 Н°=58,0 кДж
Н°=58,0 кДж
В каком направлении должно смещаться ее равновесие при: а) добавлении N2O4; б) удалении NO2; в) повышении давления; г) увеличении объема;
д) понижении температуры?
Решение. Для определения влияния всех этих изменений можно воспользоваться принципом Ле Шателье.
а) при добавлении N2O4 концентрация этого вещества в системе должна уменьшиться, следовательно, реакция сместится в сторону образования большего количества продуктов (в правую сторону уравнения);
б) при удалении NO2 в системе образуется дополнительное количество NO2 и равновесие сместится в сторону образования продуктов (вправо);
в) в системе установится новое равновесие, соответствующее меньшему объему (с меньшим числом молекул газа), следовательно, реакция должна сместиться влево;
г) равновесие в системе сместится в сторону возрастания объема системы (повышения числа молекул газа), т.е. вправо;
д) система ответит на повышение температуры смещением равновесия в сторону выделения теплоты. Реакция является эндотермической в прямом направлении (слева направо). Поэтому равновесие должно сместиться влево, так как при образовании дополнительного количества N2O4 произойдет выделение теплоты. Только это последнее изменение оказывает влияние на численное значение константы равновесия К.
Истинное химическое равновесие всегда включает конкуренцию двух противоположно направленных процессов, протекающих с одинаковой скоростью, независимо от конкретного механизма или пути реакции, по которому она осуществляется.
Упражнения
2. Для каждого из следующих растворов: а) 12,0 г ацетона (C3H6O) в 75,0 г воды; б) 3,22 г La(NO3)3 в 1,46 кг воды; в) 1,26 г KBr в 560 г жидкого… 3. Имеются два раствора. В первом случае 1,68 г бензойной кислоты (C7Н6О2)… 4. Для реакции Н2(г.)+Br2(г.)2HBr(г.) при 1495 К Кр=3,5104. Каково парциальное давление HBr в равновесной смеси,…Коллигативные свойства растворов
3.1 Понижение давления паров Если в некотором растворителе растворяют нелетучее вещество, равновесное… р(А)=Х(А)´ро(А) (3.1.1)Растворы электролитов и неэлектролитов
В качестве примера рассмотрим хлорид натрия; при его растворении в воде образуются ионы Na+ и Сl-, которые могут свободно перемещаться в растворе. В… HgCl2(водн.)ÛHgCl+(водн.)+Сl-(водн.) В виде ионов в растворе существует лишь небольшая часть HgCl2. Это соединение - пример слабого электролита.Ионное произведение воды. Водородный показатель.
H2O(ж.)ÛН+(водн.)+ОН-(водн.) Этому процессу соответствует константа диссоциации: K=Условия протекания химических реакций
1. Образование осадка. 2. Выделение газа. 3. Образование неэлектролита.Гидролиз солей
Если соль образована слабой кислотой и сильным основанием, то в результате гидролиза в растворе образуются гидроксильные ионы и он приобретает… NaCN+H2OÛHCN+KOH CN-+H2OÛHCN+OH-Гальванические элементы
Два металлических элемента, соединенных внешней цепью, называются электродами. Электрод, на котором происходит окисление, называется анодом, а… При схематическом изображении гальванического элемента граница раздела между… Zn+Cu(NO3)2=Zn(NO3)2+CuЭлектролиз
На электродах происходит разряд ионов и превращение их в нейтральные атомы или молекулы. На отрицательном электроде (катоде) происходит процесс… На катоде при электролизе всегда происходит разряд положительных ионов,…Коррозия металлов
10.1 Химическая коррозия Это процесс разрушения металлов в агрессивных средах, непроводящих… Газовая коррозия - процесс окисления металлов сухим газом, в основном, кислородом воздуха, а также продуктами сгорания…– Конец работы –
Используемые теги: основные, понятия, химии0.061
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Основные понятия в химии
Что будем делать с полученным материалом:
Если этот материал оказался полезным для Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов