рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Гидролиз солей
Реферат Курсовая Конспект
Гидролиз солей
Гидролиз солей - раздел Химия, Основные понятия в химии Гидролиз - Это Обменное Взаимодействие Соли С Водой, В Результате Которого Об...
Гидролиз - это обменное взаимодействие соли с водой, в результате которого образуется слабая кислота или слабое основание.
Если соль образована слабой кислотой и сильным основанием, то в результате гидролиза в растворе образуются гидроксильные ионы и он приобретает щелочную реакцию, например:
NaCN+H2OÛHCN+KOH
CN-+H2OÛHCN+OH-
При гидролизе соли, образованной сильной кислотой и слабым основанием, гидролизу подвергается катион соли; при этом в растворе возрастает концентрация ионов водорода, и он приобретает кислую реакцию, например:
AlCl3+H2OÛAlOHCl2+HCl
Al3++H2OÛAlOH2++H+
При взаимодействии с водой соли, образованной слабой кислотой и слабым основанием, гидролизу подвергаются как катион, так и анион соли; например, при гидролизе карбоната аммония:
(NH4)2CO3+H2OÛNH4HCO3+NH4OH
параллельно протекают два процесса:
NH4++H2OÛNH4OH+H+
CO32-+H2OÛHCO3-+OH-
В этом случае реакция раствора зависит от относительной силы кислоты и основания, образующих соль. Если Ккисл@Косн, то катион и анион гидролизуются в равной степени и реакция раствора будет нейтральной; если Ккисл>Косн, то катион соли гидролизуется в большей степени, чем анион, и реакция раствора будет слабокислой, а если Ккисл<Косн, то реакция раствора будет слабощелочной.
Соли, образованные сильной кислотой и сильным основанием, не гидролизуются, так как в этом случае обратная гидролизу реакция нейтрализации практически протекает до конца.
Гидролиз соли, образованной слабой кислотой АВ и сильным основанием, характеризуется константой гидролиза Кг:
Кг=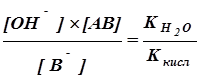 (7.1)
(7.1)
где К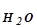 - ионное произведение воды.
- ионное произведение воды.
Аналогично для соли слабого основания МОН и сильной кислоты:
Кг=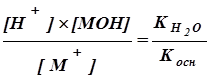 (7.2)
(7.2)
Степенью гидролиза h называется доля электролита, подвергшаяся гидролизу. Она связана с константой гидролиза Кг уравнением:
Кг=
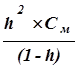 (7.3)
(7.3)
Чаще всего гидролизованная часть соли очень мала, а концентрация продуктов гидролиза незначительна. В подобных случаях h<<1, и в знаменателе последней формулы этой величиной можно пренебречь.
Кг=h2´Cм (7.4)
h=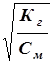 (7.5)
(7.5)
Гидролиз солей, образованных слабыми многоосновными кислотами, протекает ступенчато, причем продуктами первых стадий гидролиза являются кислые соли.
1 ступень Na2CO3+H2OÛNaHCO3+NaOH
CO32-+H2OÛHCO3-+OH-
2 ступень NaHCO3+H2OÛH2CO3+NaOH
HCO3-+H2OÛH2CO3+OH-
Также ступенчато протекает гидролиз солей, образованных слабыми основаниями многовалентных металлов. В результате гидролиза по первым ступеням образуется основная соль.
1 ступень AlCl3+H2OÛAlOHCl2+HCl
Al3++H2OÛAlOH2++H+
2 ступень AlOHCl2+H2OÛAl(OH)2Cl+HCl
AlOH2++H2OÛAl(OH)2++H+
3 ступень Al(OH)2Cl+H2OÛAl(OH)3+HCl
Al(OH)2++H2OÛAl(OH)3+H+
– Конец работы –
Эта тема принадлежит разделу:
Основные понятия в химии
Все вещества состоят из химических элементов Например составными частями серной кислоты Н SO являются элементы водород сера и кислород... Химические элементы составные части простых и сложных веществ каждый... Число нейтронов содержащихся в ядрах данного элемента в отличие от числа протонов может быть различным Атомы...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Гидролиз солей
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов