рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Реакции электрофильного присоединения
Реферат Курсовая Конспект
Реакции электрофильного присоединения
Реакции электрофильного присоединения - раздел Химия, По курсу БИО Органическая химия Ненасыщенные Углеводороды — Алкены, Циклоалкены, Алкадиены И Алкины — Проявля...
Ненасыщенные углеводороды — алкены, циклоалкены, алкадиены и алкины — проявляют способность к реакциям присоединения, так как содержат двойные или тройные связи. Более важной in vivo является двойная связь.
За счет электронов p-связи в молекулах алкенов имеется область повышенной электронной плотности. Поэтому они представляют собой нуклеофилы и, следовательно, склонны подвергаться атаке электрофильным реагентом.
Механизм реакции. Присоединение к алкенам галогеноводородов и родственных соединений протекает по гетеролитическому электрофильному механизму ае. Электрофильной частицей в данном процессе часто служит простейший электрофил — протон Н+. В реакции выделяют две основные стадии: 1) электрофильная атака протоном алкена с образованием карбокатиона — медленная стадия, определяющая скорость процесса в целом; 2) атака образовавшегося карбокатиона нуклеофилом Х—, приводящая к конечному продукту (быстрая стадия).
Присоединение галогеноводородов и воды (гидратация) происходит по правилу Марковникова: атомы водорода присоединяются преимущественно к наиболее гидрогенизированному атому углерода (наиболее богатому водородом), а атом галогена или гидроксигруппа присоединяются к наименее гидрогенизированному.
Н3С–СН = СН2 + НCl ® Н3С–СНCl–СН3
Образуется преимущественно 2-хлорпропан, а не 1-хлорпропан.
Но такая формулировка правила Марковникова не объясняет направление реакций гипогалогенирования (присоединения НОГал) и реакций присоединения к алкенам, в состав которых входят группы, обладающие отрицательным мезомерным или индукционным эффектами.
Существует и другая более общая формулировка правила Марковникова: присоединение несимметричного реагента к несимметричному алкену по ионному механизму протекает в направлении образования более устойчивого катиона. Так, в результате присоединения катиона водорода к двойной связи пропена могут возникнуть два карбокатиона:
СН3®СН2®+СН2 (I) и СН3®+СН¬СН3 (II)
Ни в том, ни в другом катионе положительный заряд на выделенном атоме углерода не равен, а много меньше +1 из-за смещения к нему электронной плотности от соседних атомов. Но в первичном катионе (I) донором этой плотности является один, а во вторичном (II) – два соседних атома углерода. Кроме того, в первичном катионе (I) метильная группа находится дальше, ее индукционный эффект по цепи затухает. Это значит, что распределение заряда во вторичном карбокатионе (II) более равномерное; такая частица оказывается более устойчивой, реакция идет по пути, направляемому ее образованием.
Рассмотрим присоединение галогеноводорода к непредельным карбоновым кислотам:
СН2 = СН – СООН + НCl ® СН2Cl – СН2 – СООН
В этом случае водород присоединяется к менее гидрогенизированному атому углерода. Значит ли это что присоединение идет против правила Марковникова? Оказывается, нет. В результате присоединения иона водорода к двойной связи кислоты могут возникнуть два карбокатиона:
+СН2 – СН2 ® СООН (I) и СН3 ®+СН ®СООН (II)
В первичном катионе (I) нет донорной метильной группы, зато дестабилизирующее действие акцепторной карбоксильной группы ощущается заметно меньше, чем во вторичном катионе (II). Отрицательный мезомерный и индукционный эффекты в карбоксильной группе увеличивают положительный заряд во вторичном катионе (II) в большей степени, чем в первичном (I). Это значит, что распределение заряда в первичном карбокатионе (I) более равномерное; такая частица оказывается более устойчивой, реакция идет по пути, направляемому ее образованием. Присоединение фактически следует правилу Марковникова в его обобщенной форме.
В случае реакции гипохлорирования (присоединения HOCl) в растворе присутствуют ионы ОН- и Cl+, а протона нет совсем и применима только обобщенная формулировка правила Марковникова. Тогда в результате присоединения катиона хлора к двойной связи пропена могут возникнуть два карбокатиона, из которых более устойчивым будет являться вторичный (II):
СН3®СНCl ®+СН2 (I) и СН3®+СН ¬ СН2Cl (II)
Тогда реакцию можно записать следующим образом:
Н3С–СН=СН2 + НОCl ® Н3С–СН(ОН)–СН2Cl
Присоединение против правила Марковникова идет в том случае, если реакцию проводят в присутствии перекисей (Н2О2 или ROOR). Тогда реакция протекает по другому механизму (свободнорадикальное присоединение):
 Н3С–СН=СН2 + НBr ROOR Н3С–СН2–СН2Br
Н3С–СН=СН2 + НBr ROOR Н3С–СН2–СН2Br
Для сопряженных диенов характерна способность образовывать в реакциях присоединения наряду с обычными 1,2-аддуктами продукты 1,4-присоединения. Соотношение между ними в значительной степени зависит от условий эксперимента.
Реакции электрофильного замещения. Для ароматических соединений бензольного ряда, конденсированных и гетероциклических ароматических соединений характерны реакции, не приводящие к нарушению ароматической системы, т. е. реакции замещения. Они не склонны вступать в реакции присоединения или окисления, ведущие к нарушению ароматичности.
Для соединений ароматического характера, имеющих замкнутую p -электронную систему, наиболее характерны реакции с электрофильными агентами.
С помощью кинетических методов показано, что большинство реакций электрофильного замещения в ароматическом ряду протекает по двухстадийному механизму. На первой, медленной, стадии происходит нарушение ароматической системы и переход атакуемого атома углерода ядра в состояние sp3-гибридизации. Вторая, быстрая, стадия сопровождается восстановлением ароматической структуры и вследствие выигрыша энергии протекает легко и быстро.

Следует заметить, что протекание первой стадии обычно осуществляется с промежуточным образованием так называемого p-комплекса. p -Комплексы представляют собой координационные соединения, в которых донором являются ароматические соединения, имеющие легко поляризуемые p -электроны, а акцепторами – галогены, сильные минеральные кислоты и тому подобные соединения, имеющие по разным причинам сродство к электронам.
p-Комплексы не являются истинными химическими соединениями, в которых электрофильная частица связывается ковалентной связью с конкретным атомом субстрата. p -Комплексы, образуемые бензолом, очевидно, построены объемно, так как наибольшая p-электронная плотность ароматических соединений расположена по обе стороны бензольного кольца.
Первой ступенью взаимодействия ароматических соединений с электрофильным агентом Е+ при реакциях электрофильного замещения является образование p- комплекса, который медленно, лимитируя скорость всей реакции, перегруппировывается в карбкатион (s- комплекс).
В отличие от p-комплексов, s-комплексы представляют собой истинно химические соединения, в которых электрофильный агент Е+ образует ковалентную связь за счет двух p-электронов одной из связей бензольного кольца. При образовании s-комплекса электрофильный агент внедряется в ароматическую молекулу более «глубоко», чем в p-комплексе. В s-комплексе один из атомов углерода бензольного кольца переходит в состояние sp 3-гибридизации, в котором все четыре связи направлены под углом 109°. При этом нарушается симметрия бензольного кольца, а группа Е+ и атом водорода оказываются в положении, перпендикулярном плоскости кольца.
Реакции электрофильного замещения завершаются отщеплением от s-комплекса протона и восстановлением ароматической системы. Как правило, этот процесс происходит при участии обладающего основными свойствами аниона А–, присутствующего в реакционной среде, и сопровождается выделением энергии.
К реакциям электрофильного замещения относятся реакции галогенирования, нитрования, сульфирования, алкилирования, ацилирования:
 |
Заместители в кольце делят на ориентанты I рода и II рода. Ориентанты I рода: алкильные радикалы, группы –ОН, –OR, –NH2, –NHR, –NR2, –SH, атомы галогенов направляют второй заместитель в орто- и пара-положения. Все заместители I рода, кроме галогенов, обладают электронодонорными свойствами по отношению к бензольному кольцу и ускоряют реакции электрофильного замещения по сравнению с незамещённым бензолом.
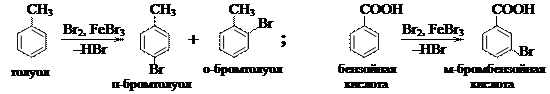
Ориентанты II рода: карбонильные и сложноэфирные группы, группы –СООН, –SO3H, –NO2, –CºN направляют второй заместитель в мета-положение. Все заместители II рода обладают электроноакцепторными свойствами по отношению к бензольному кольцу и замедляют реакции электрофильного замещения по сравнению с незамещённым бензолом.
– Конец работы –
Эта тема принадлежит разделу:
По курсу БИО Органическая химия
Государственное образовательное учреждение... Высшего профессионального образования... Тамбовский государственный университет им Г Р Державина...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Реакции электрофильного присоединения
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов