рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- ТЕМА 12. Углеводы: моно, ди- и полисахариды
Реферат Курсовая Конспект
ТЕМА 12. Углеводы: моно, ди- и полисахариды
ТЕМА 12. Углеводы: моно, ди- и полисахариды - раздел Химия, По курсу БИО Органическая химия Углеводы Разделяют На Простые (Моносахариды) И Сложные (Полис...
Углеводы разделяют на простые (моносахариды) и сложные (полисахариды).
Моносахариды (монозы). Это гетерополифункциональные соединения, содержащие карбонильную и несколько гидроксильных групп. Моносахариды имеют молекулярную формулу Сп(Н2О)п, которая и послужила основой для названия данного класса соединений (углерод + вода). По своей структуре монозы относятся к полиоксиальдегидам, или альдозам, или полиоксикетонам, или кетозам. В зависимости от числа атомов углерода монозы делят на триозы (три атома углерода), тетрозы (четыре атома), пентозы (пять атомов), гексозы (шесть атомов) и гептозы (семь атомов). В зависимости от строения карбонильной группы каждую из моноз обозначают: альдотриоза, альдогексоза, кетогексоза и т.п.
Оптическая изомерия моносахаридов. Характерной особенностью структуры моносахаридов является наличие в молекулах асимметрических (т.е. имеющих четыре различных заместителя) атомов углерода. Асимметрические атомы углерода представляют собой центры хиральности молекулы. Следствие хиральности молекулы – явление оптической изомерии, или энантиомерии, которое выражается в способности соединения вращать плоскость поляризованного света в противоположные стороны. Соединение с асимметрическими атомами углерода может существовать в виде 2 изомеров. В соединениях с одинаковыми асимметрическими атомами углерода число оптических изомеров уменьшается вследствие существования мезоформ. Мезо-соединения оптически неактивны из-за «внутренней компенсации» знака вращения. Примером мезо-соединения является D-ксилит.
Оптические изомеры, относящиеся друг к другу как несимметричный предмет к своему зеркальному отображению, называют энантиомерами, или оптическими антиподами. Энантиомеры отличаются друг от друга конфигурацией всех центров хиральности и образуют D-форму (лат.Dexter — правый) и L-форму (лат. laevus — левый) — стереохимические ряды моносахаридов. Изомеры, отличающиеся конфигурацией только части центров хиральности и не являющиеся оптическими антиподами, называют диастереомерами. Пару диастереомеров, отличающихся конфигурацией только одного асимметрического атома углерода, называют эпимерами. Обычно к названию добавляют номер эпимерного атома углерода, 2-эпимеры называют просто эпимерами. Например, D-аллоза и D-альтроза – эпимеры, D-аллоза и D-глюкоза – 3-эпимеры, D-аллоза и D-гулоза – 4-эпимеры.
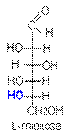
 В качестве стандарта для определения принадлежности соединения к стереохимическому D- или L-ряду принята конфигурация асимметрического атома в простейшей триозе — D-глицериновом альдегиде. Принадлежность соединения стереохимическому ряду определяет конфигурация асимметрического атома углерода с наибольшим номером (в случае глюкозы — атома С5). Если она совпадает с конфигурацией асимметрического атома углерода D-глицеринового альдегида, то соединение относят к D-ряду, если не совпадает — к L-ряду. Установлено, что все природные монозы относятся к D-ряду.
В качестве стандарта для определения принадлежности соединения к стереохимическому D- или L-ряду принята конфигурация асимметрического атома в простейшей триозе — D-глицериновом альдегиде. Принадлежность соединения стереохимическому ряду определяет конфигурация асимметрического атома углерода с наибольшим номером (в случае глюкозы — атома С5). Если она совпадает с конфигурацией асимметрического атома углерода D-глицеринового альдегида, то соединение относят к D-ряду, если не совпадает — к L-ряду. Установлено, что все природные монозы относятся к D-ряду.
Цикло-оксо-таутомерия моносахаридов. В твердом состоянии и в водном растворе моносахариды преимущественно существуют в виде циклических полуацеталей. Образование полуацеталей можно рассматривать как внутримолекулярную реакцию AN, в результате которой образуются наиболее устойчивые шестичленные циклы (пиранозные) и пятичленные циклы (фуранозные). Таким образом, в растворе устанавливается таутомерное равновесие между открытой (оксо-формой) и циклической формой моносахарида, причем циклическая форма значительно преобладает (более 99,9 % в равновесной смеси):
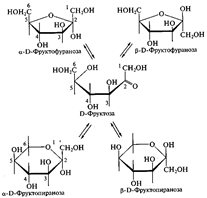
Для изображения на плоскости пространственной структуры соединений в открытой форме используют проекционные формулы Фишера, а для изображения на плоскости пространственной структуры циклических соединений применяют проекционные формулы Хоуорса:
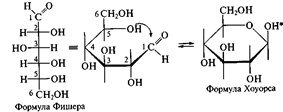
При этом руководствуются следующими правилами: цикл изображают плоским; заместители, находящиеся в оксо-форме справа, изображают под плоскостью цикла, а находящиеся слева — над плоскостью цикла; атомы водорода связей С—Н могут быть не показаны.
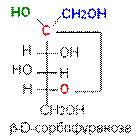
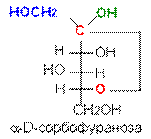 В циклической форме появляется дополнительный по сравнению с открытой формой асимметрический атом углерода (центр хиральности): атом С1 в альдозах или атом С2 в кетозах, называемый аномерным атомом углерода, и дополнительная группа –ОН, называемая полуацеталъным гидроксилом (в формуле Хоуорса показана звездочкой *). Если конфигурация аномерного атома углерода совпадает с конфигурацией атома, определяющего принадлежность соединения стереохимическому ряду, его называют a-аномером, если не совпадает — b-аномером.
В циклической форме появляется дополнительный по сравнению с открытой формой асимметрический атом углерода (центр хиральности): атом С1 в альдозах или атом С2 в кетозах, называемый аномерным атомом углерода, и дополнительная группа –ОН, называемая полуацеталъным гидроксилом (в формуле Хоуорса показана звездочкой *). Если конфигурация аномерного атома углерода совпадает с конфигурацией атома, определяющего принадлежность соединения стереохимическому ряду, его называют a-аномером, если не совпадает — b-аномером.
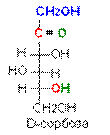 | 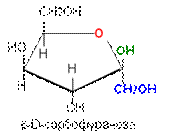 |
Таким образом, a- и b-аномеры моноз можно рассматривать как изомеры положения полуацетального гидроксила. Переход аномерных форм a « b осуществляется только через открытую оксо-форму: a-форма « оксо-форма « b-форма
Аналогично устанавливается равновесие в растворе между пиранозными и фуранозными формами. Преобладание a- или b-аномера зависит от природы монозы, растворителя, концентрации и других внешних условий. Равновесие между всеми формами является, таким образом, динамическим. Так, если какой-либо аномер глюкозы растворить в воде, он постепенно превращается в другой аномер, пока не образуется равновесная смесь двух аномеров, в которой также содержится очень небольшое количество открытой формы. Этот переход сопровождается изменением оптического вращения раствора. Такое явление называют мутаротацией (аномеризацией) моносахаридов. Равновесная смесь, образующаяся в результате мутаротации как a-, так и b-D-глюкопираноз, содержит 36 % a-изомера и 64 % b-формы. Доля оксо-формы в равновесной смеси невелика (при рН 6,9 равновесная смесь D-глкжозы содержит лишь малую часть альдегидной формы). Поэтому монозы не дают характерного для альдегидов окрашивания в реакции с фуксиносернистой кислотой и не реагируют с гидросульфитом натрия. Мутаротация катализируется кислотами и основаниями. В твердом состоянии монозы находятся исключительно в циклической форме.
Химические свойства моносахаридов. В химическом отношении монозы сочетают в себе свойства многоатомных спиртов, карбонильных соединений и полуацеталей.
1. Для циклических форм моноз наиболее характерны реакции с участием гидроксильной группы. Наиболее химически активна полуацетальная гидроксильная группа.
Простые эфиры получают при взаимодействии гидроксильных групп моноз с алкилгалогенидами. Одновременно в реакцию вступают как полуацетальная, так и спиртовые гидроксигруппы. Полуацетальная группа –ОН более реакционноспособна, поэтому образование простого эфира по этой группе протекает быстрее и может протекать и при взаимодействии моноз с низшими спиртами в присутствии хлороводорода. Образующиеся при этом моноэфиры называют гликозидами (пиранозидами и фуранозидами).
Простые эфиры, образованные спиртовыми гидроксильными группами не гидролизуются, а гликозидная связь легко подвергается гидролизу в щелочной среде. Растворы гликозидов не мутаротируют.
 |
Молекулы этанола или йодистого метила выступают в данной реакции в роли нуклеофилов. Аналогично монозы взаимодействуют с аминами и их производными с образованием N-гликозидов.
Гликозиды представляют собой продукты конденсации циклических форм моносахаридов со спиртами и аминами с образованием гликозидной связи. Гликозиды легко подвергаются гидролизу в кислой среде. По типу О-гликозидов образуются ди- и полисахариды, а по типу N-гликозидов — нуклеозиды — структурные компоненты нуклеиновых кислот. Гликозиды играют чрезвычайно важную роль в биохимических процессах, в частности в процессах дыхания и фотосинтеза. Важнейший из гликозидов — аденозинтрифосфат (АТФ), являющийся сложным эфиром фосфорной кислоты и аденозина — нуклеозида, являющегося продуктом конденсации аденина с рибозой. Фосфатные группы АТФ выполняют роль своеобразного энергетического депо; при их гидролизе выделяется энергия, необходимая клеткам для мышечного сокращения.
При взаимодействии с кислотами и их ангидридами монозы образуют сложные эфиры. Так, при взаимодействии глюкозы с уксусным ангидридом образуется пентаацетилглюкоза.
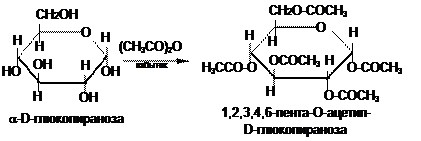
Биологически важный пример реакции данного типа — реакция фосфорилирования. Фосфаты – эфиры моноз и фосфорной кислоты содержатся во всех растительных и животных организмах и представляют собой метаболически активные формы моносахаридов. Так, 1-фосфат D-глюкозы образуется при гидролизе гликогена (полисахарида, присущего животным организмам); 6-фосфат глюкозы — продукт катаболизма глюкозы в организме; фосфаты D-рибозы и 2-дезокси-D-дезоксирибозы — структурные элементы нуклеиновых кислот.
 | |||
 |
Реакция происходит на первой стадии гликолиза (процесса окисления глюкозы в пируват). Необходимо заметить, что все промежуточные продукты гликолиза представляют собой сложные эфиры моноз и фосфорной кислоты.
2. Окисление моноз в кислой и нейтральной среде приводит к образованию различных кислот. Окислению может подвергаться только карбонильная группа — «мягкое» окисление, например, бромной водой с образованием –оновых кислот
Окисление карбонильной и первичной гидроксильной группы — «жесткое» окисление, например, раствором HNO3 до гликаровых кислот.
Окисление только первичной гидроксильной группы в мягких условиях (например, при действии ферментов) при защите альдегидной группы приводит к образованию гликуроновых кислот.
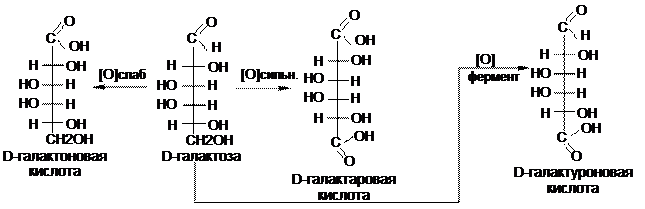

Гликурониды при нагревании легко декарбоксилируются, что приводит к образованию моноз с меньшим числом атомов углерода. Так можно получить из D-гликуронида пентозу — D-ксилозу.
Окисление моноз в щелочной среде сопровождается деструкцией углеродного скелета. Реакции окисления характерны не только для альдоз, но и для кетоз (в отличие от кетонов), что объясняется явлением эпимеризации моноз.
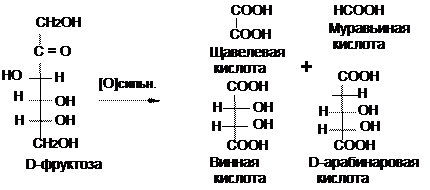
Окислению могут подвергаться и некоторые дисахариды, называемые восстанавливающими. Существуя преимущественно в форме полуацеталей, они обладают потенциально свободной альдегидной группой (в оксо-форме).
Восстанавливающие моно- и дисахариды восстанавливают ионы меди(П), входящие в состав реактива Фелинга или в состав реактива Бенедикта до оксида меди (I) Сu2О, а также ионы серебра в реактиве Толленса [Ag(NH3)2]OH до свободного серебра. Реакции используют как качественные на наличие восстанавливающих сахаридов.
3. Моносахариды подвергаются химическому либо билогическому восстановлению.
Восстановление моноз, как и всяких карбонильных соединений, приводит к превращению карбонильных групп в спиртовые; при этом образуются многоатомные спирты, называемые сахарными спиртами, или альдитами.
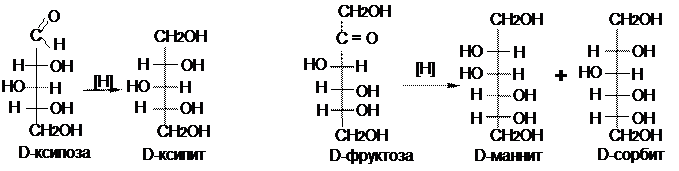 Помимо амальгамы натрия в водной (или водно-спиртовой, или спиртовой) среде для восстановления моноз используют водород в присутствии катализаторов (Pt, Pd, Ni) и гидриды металлов (особенно NaBH4). Следует иметь в виду, что при восстановлении альдоз образуется один спирт, а при восстановлении кетоз получают два стеоизомерных многоатомных спирта, т.к. неасиметрический 2-й атом С в кетозе (атом карбонильной группы) после восстановления становится асимметрическим и возможны две ориентации гидроксильной группы, связанной с ним.
Помимо амальгамы натрия в водной (или водно-спиртовой, или спиртовой) среде для восстановления моноз используют водород в присутствии катализаторов (Pt, Pd, Ni) и гидриды металлов (особенно NaBH4). Следует иметь в виду, что при восстановлении альдоз образуется один спирт, а при восстановлении кетоз получают два стеоизомерных многоатомных спирта, т.к. неасиметрический 2-й атом С в кетозе (атом карбонильной группы) после восстановления становится асимметрическим и возможны две ориентации гидроксильной группы, связанной с ним.
 4. Реакция изомеризации (эпимеризации) всегда происходит по a-СН*-кислотному центру моносахаридов, которым является атом углерода, непосредственно связанный с карбонильной группой. Реакция протекает под действием разбавленных растворов щелочей или ферментативно (в условиях организма) и сопровождается
4. Реакция изомеризации (эпимеризации) всегда происходит по a-СН*-кислотному центру моносахаридов, которым является атом углерода, непосредственно связанный с карбонильной группой. Реакция протекает под действием разбавленных растворов щелочей или ферментативно (в условиях организма) и сопровождается
внутримолекулярным окислением-восстановлением
(диспропорционированием) атомов углерода С1 и С2.
В ходе этой перегруппировки вследствие переноса
протона, осуществляемого под влиянием
гидроксильного иона, возникает промежуточное
соединение — ендиол (одна двойная связь (-ен)
между двумя гидроксильными группами (ди-ол)).
Превращения ендиола могут привести к образова-
нию как кетозы, так и двух альдоз.
Таким образом, в результате реакции
постепенно образуется равновесная смесь
изомеров. Например, в результате эпимеризации D-глюкозы образуется
D-манноза — эпимер глюкозы по С2 и D-фруктоза — структурный изомер глюкозы.
Пример реакции изомеризации в организме — ферментативное превращение глюкозо-6-фосфата в фруктозо-6-фосфат в процессе гликолиза.
Олиго- и полисахариды. Дисахариды (биозы) представляют собой продукт конденсации двух молекул моносахаридов, соединенных О-гликозидной связью.
Если в реакции конденсации принимают участие оба полуацетальных гидроксила и два остатка моноз соединяются гликозид-гликозидной связью, образуется невосстанавливающий дисахарид. Такой дисахарид не содержит гликозидный гидроксил, не может переходить в открытую альдегидную форму и поэтому не восстанавливает окислов металлов ( не вступает в реакции с гидроксидом меди или в реакцию «серебряного зеркала»).
Если в реакции конденсации принимают участие один полуацетальный и один спиртовой гидроксил и два остатка моноз соединяются гликозид-гликозной связью, образуется восстанавливающий дисахарид. Такой дисахарид содержит гликозидный гидроксил, за счёт которого может переходить в открытую альдегидную форму и выступать в качестве восстановителя.
Дисахариды, как любые гликозиды, гидролизуются в кислой среде. Наиболее биологически важными дисахаридами являются сахароза, мальтоза, лактоза и целлобиоза.
Например, структурную формулу мальтозы, которая является основным продуктом расщепления крахмала в полости рта под действием фермента слюны — b-амилазы, можно представить следующим образом:
 | |||
 | |||
Систематическое название (a-D-глюкопиранозил-(1®4)-a-D-глюкопираноза или 4-(a-D- глюкопиранозидо)-D-глюко-пираноза) указывает на наличие гликозидной связи между имеющим a-конфигурацию атомом С, одного остатка глюкозы и атомом С4 другого остатка. Мальтоза образуется в результате конденсации двух молекул a-D-глюкопиранозы с образованием гликозидной связи между атомом С1 a-аномера глюкозы и атомом С4 второй молекулы глюкозы. Такую связь называют a (1®4) –связью.
 Лактоза (4-(b-D-галактопиранозидо)-D-глюкопираноза) имеет строение:
Лактоза (4-(b-D-галактопиранозидо)-D-глюкопираноза) имеет строение:
 |
 Целлобиоза (4-(b- D -глюкопиранозидо)-D-глюкопираноза) представляет собой основной структурный элемент целлюлозы; образуется при ферментативном гидролизе целлюлозы. Целлобиоза, как и лактоза, имеет 1,4-b-гликозидную связь и является восстанавливающим дисахаридом, но в отличие от лактозы при полном гидролизе дает только D-глюкозу:
Целлобиоза (4-(b- D -глюкопиранозидо)-D-глюкопираноза) представляет собой основной структурный элемент целлюлозы; образуется при ферментативном гидролизе целлюлозы. Целлобиоза, как и лактоза, имеет 1,4-b-гликозидную связь и является восстанавливающим дисахаридом, но в отличие от лактозы при полном гидролизе дает только D-глюкозу:
 |
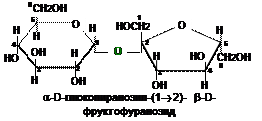 Сахарозу (a-D-глюкопиранозидо-b-D-фруктофуранозид)
Сахарозу (a-D-глюкопиранозидо-b-D-фруктофуранозид)
называют тростниковым сахаром; она является невосстанав-
ливающим дисахаридом, содержится в тростнике, сахарной
свекле, различных фруктах, ягодах и овощах.
Систематическое название сахарозы отражает конфигу-
рацию обоих гликозидных (суффикс «озид» у названий обеих
моноз) гидроксилов (a или b), и наличие связи С1 –С2.
Продукты конденсации нескольких (от 2 до 12) молекул моносахаридов называют олигосахаридами; большего числа моносахаридов — полисахаридами.
Если макромолекулы построены из остатков одного моносахарида, то такие полисахариды называют гомополисахаридами. Среди гомополисахаридов наиболее биологически важными являются поли- D -глюкопиранозы: амилоза, амилопектин, гликоген (дисахаридным фрагментом последних является мальтоза) и целлюлоза, структурным компонентом которой выступает дисахарид целлобиоза.
Амилоза — это полимер неразветвленного строения (линейный полимер) молекулярной массой около 60000; при нагревании растворяется в воде, образуя лиофильный коллоидный раствор; взаимодействует с йодом с образованием комплексного «соединения включения» синего цвета.
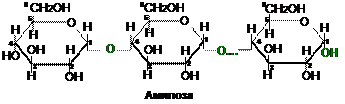 |
При ферментативном гидролизе b-амилазой, которая выделяется поджелудочной железой и содержится в слюне, амилоза расщепляется на глюкозу и мальтозу; гидролиз начинается с невосстанавливающего конца амилозы и осуществляется последовательным отщеплением молекул мальтозы.
Амилопектин имеет разветвленную структуру и включает наряду с a(1®4)-связями и гликозидные a(1®6)-связи. За счет последних и образуются разветвления в структуре:
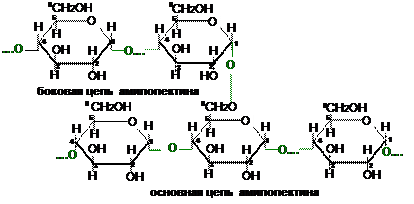 |
При растворении в воде амилопектин набухает, образуя связаннодисперсную систему — гель. С йодом амилопектин образует соединение красно-фиолетового цвета.
Смесь амилозы (20-25%) и амилопектина (75-80%) предтавляет собой полисахарид природного происхождения — крахмал.
Таким образом, природный крахмал не является индивидульным веществом: он состоит из двух фракций, отличающихся пo строению и вследствие этого обладающих различной растворимостью в теплой воде. Крахмал является основным резервным полисахаридом растений.
Крахмал – белое аморфное вещество. В холодной воде не растворим, в горячей набухает и постепенно растворяется. При охлаждении получается студнеобразная масса или гель (кисель). По многим свойствам кисель похож на твёрдое тело, в частности, проявляет упругость, несмотря на то, что это довольно разбавленный раствор крахмала, а не концентрированный, как например, сироп. Дело в том, что при попадании в раствор разветвлённые и неразветвлённые молекулы амилопектина и амилазы за счёт возникающих водородных связей формируют трёхмерную пространственную сетку, в ячейки которой попадают молекулы воды. Такой каркас существует только при невысокой температуре. Если кисель подогреть, молекулы начнут двигаться энергичнее, водородные связи между ними разрушатся и кисель станет жидким.
Все полисахариды крахмала вращают поляризованный свет вправо, так как образованы правовращающей глюкозой. При нагревании с кислотами крахмал гидролизуется по месту глюкозид-глюкозных связей, давая последовательно декстрины, мальтозу и глюкозу.
Гликоген («животный крахмал») по структуре и свойствам похож на амилопектин, но имеет еще более разветвленную полимерную цепь и является резервным полисахаридом животных, запасаемым в печени и мускульной ткани.
Гликоген является «двойником» крахмала в животном мире и играет роль депо питательных веществ и запасного углевода животных тканей (откладывается, в основном, в печени и в мышцах). Молекулярная масса гликогена очень велика – около 100 млн. Такой размер молекул соответствует их биологической функции резервного углевода. Макромолекула гликогена из-за большого размера не проходит через мембрану и остаётся внутри клетки, пока не возникнет потребность в энергии. В перерывах между приёмами пищи гликоген понемногу расщепляется до глюкозы, которая поступает в кровь и затем используется клетками организма. У хорошо упитанного взрослого человека запасы гликогена достигают 0,5 кг.
Одним из важнейших полисахаридов является целлюлоза. Она образует главную составную часть стенок растительных клеток. Целлюлоза представляет собой полимер, полностью состоящий из звеньев b-D-глюкопиранозы, которые связаны гликозидными b(1®4)-связями.
Целлюлоза — линейный полимер, цепи которой могут содержать более 10000 звеньев:
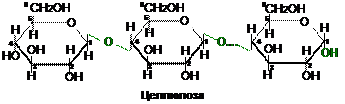 |
Чистая целлюлоза является белым волокнистым веществом, нерастворимым в воде, эфире или спирте. Такая устойчивость по отношению к растворителям объясняется уникальной структурой целлюлозы.
Этот полисахарид состоит из остатков D-глюкозы, связанных только гликозидной b(1®4)-связью; молекулы целлюлозы нитевидные и не имеют разветвлений. Высокоупорядоченная структура, подтвержденная данными рентгеноструктурного анализа, обусловливает необычайную прочность и упругость целлюлозы, равно как и отсутствие растворимости в большинстве применяемых растворителей.
Любопытно, что целлюлоза растворяется в реактиве, приготовленном смешиванием Сu(ОН)2 с концентрированным водным раствором аммиака (реактив Швейцера), а также в подкисленном растворе ZnCl2 при нагревании или в концентрированной серной кислоте, т.е. в тех средах, состав которых обусловливает возможность разрыва водородных связей в молекулах целлюлозы и образование новых связей с растворителем.
Благодаря наличию свободных спиртовых гидроксильных групп целлюлоза способна реагировать со спиртами и кислотами с образованием эфиров. Целлюлоза выполняет функции структурного полисахарида, используемого организмом для построения остова клеточной ткани.
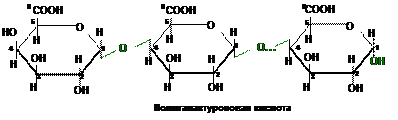 Пектиновые вещества содержатся в плодах и овощах, для них характерно желеобразование в присутствии органических кислот, что используется в пищевой промышленности для изготовления желе и мармеладов.
Пектиновые вещества содержатся в плодах и овощах, для них характерно желеобразование в присутствии органических кислот, что используется в пищевой промышленности для изготовления желе и мармеладов.
В основе пектиновых веществ лежит
пектовая - полигалактуроновая кислота.
Пектовая кислота состоит из остатков
D-галактуроновой кислоты, связанных
a(1®4)-гликозидной связью.
Некоторые пектиновые вещества оказывают противоязвенное действие и являются основой ряда препаратов, например, плантаглюцид из подорожника.
Гетерополисахариды(макромолекулы которых построены из остатков более, чем одного моносахарида) также достаточно широко распространены в природе.
Альгиновые кислоты содержатся в бурых водорослях. Неразветвленная цепь построена из соединенных (1®4) -связями остатков D-маннуроновой и L-гулуроновой кислот. Альгиновые кислоты как гелеобразователи используются в пищевой промышленности. Морские водоросли служат источником многих полисахаридов. Например, широко применяемый в биохимических исследованиях агар представляет собой гетерополисахарид, содержащий большое число сульфатных групп. Агар состоит из смеси агарозы и агаропектина. В полисахаридной цепи агарозы чередуются остатки D-галактозы и L-лактозы.
Полисахариды соединительной ткани. Соединительная ткань распределена по всему организму и обусловливает прочность и упругость органов, эластичность их соединения, стойкость к проникновению инфекций. Полисахариды соединительной ткани связаны с белками.
Наиболее полно изучены хондроитинсульфаты (кожа, хрящи, сухожилия), гиалуроновая кислота (стекловидное тело глаза, пуповина, хрящи, суставная жидкость), гепарин (печень). Эти Полисахариды обладают общими чертами в строении: их неразветвленные цепи построены из дисахаридных остатков, в состав которых входят уроновые кислоты (D-глюкуроновая, D-галактуроновая, L-идуроновая) и N-ацетилгексозамины (N-ацетилглюкозамин, N-ацетилгалактозамин). Некоторые из них содержат остатки серной кислоты.
Гиалуроновая кислота построена из дисахаридных остатков, соединенных b(1®4)-гликозидными связями. Дисахаридный фрагмент состоит из остатков D-глюкуроновой кислоты и N-ацетил-О-глюкозамина, связанных b(1®3)-гликозидной связью. Гиалуроновая кислота имеет большую молекулярную массу – 2-7 млн., растворы обладают высокой вязкостью, с чем связывают её барьерную функцию, обеспечивающую непроницаемость соединительной ткани для патогенных микроорганизмов.
 |
Xондроитинсульфаты состоят из дисахаридных остатков N-ацетилированного хондрозина, соединенных b(1®4)-гликозидными связями. В состав хондрозина входят D-глюкуроновая кислота и D-галактозамин, связанные между собою b(1®3)-гликозидной связью.
 |
Сульфатная группа образует эфирную связь с гидроксильной группой N-ацетил-О-галактозамина, находящейся либо в 4-м, либо в 6-м положении, Молекулярная масса хондроитинсульфатов составляет 10 000 - 60 000.
Хондроитинсульфаты и гиалуроновая кислота содержатся не в свободном, а в связанном виде с полипептидными цепями.
– Конец работы –
Эта тема принадлежит разделу:
По курсу БИО Органическая химия
Государственное образовательное учреждение... Высшего профессионального образования... Тамбовский государственный университет им Г Р Державина...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: ТЕМА 12. Углеводы: моно, ди- и полисахариды
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов