Уровни структурной организации белковых молекул - раздел Химия, БИОХИМИЯ. БЕЛКИ. АМИНОКИСЛОТЫ -- СТРУКТУРНЫЕ КОМПОНЕНТЫ БЕЛКОВ Пептидные Цепи Содержат Десятки, Сотни И Тысячи Аминокислотных Остатков, Соед...
Пептидные цепи содержат десятки, сотни и тысячи аминокислотных остатков, соединенных прочными пептидными связями. За счет внутримолекулярных взаимодействий белки образуют определенную пространственную структуру, называемую "конформация “белков.
Структура белковых молекул отличается значительной сложностью и своеобразной организацией. Различают 4 уровня структурной организации белка: первичную, вторичную, третичную и четвертичную.
Первичная структура – это последовательность аминокислот в полипептидной цепи, соединенных пептидными связями. К настоящему времени полностью расшифрована первичная структура многих белков: инсулина, гемоглобина, миоглобина, трипсиногена, лизоцима и др. Установлены не только межвидовые, но и выявляются индивидуальные особенности первичной структуры отдельных белков.
Последовательность аминокислот в полипептидной цепи определяет последующие уровни структурной организации белка, его важнейшие физико-химические, биологические свойства и является уникальной в каждом отдельном случае (закрепленной генетически).
Вторичная структура – это конфигурация полипептидной цепи в пространстве, образующаяся в результате взаимодействий между функциональными группами, входящими в состав пептидного остова.


Вторичная структура белков (a-спираль). Полипептидная цепь образует спираль вращением вокруг воображаемого цилиндра.
Вид с торца a-спирали – проекции боковых групп ориентированы произвольно.
Отдельные участки полипептидной цепи существуют в виде a -спирали, бета- структуры (складчатого листа), нерегулярные вторичные структуры (кольца, изгибы, петли).
Вторичная структура характеризует организацию полипептидного скелета. Внешне альфа-спираль похожа на слегка растянутую спираль телефонного шнура. Термин “альфа-спираль” предложил Л. Полинг, открывший такую укладку в кератине. На один виток спирали в среднем приходится 3,6 аминокислотных остатка, а шаг спирали составляет 0,54 нм. альфаспираль стабилизируется (т.е. удерживается) с помощью большого количества водородных связей, которые образуются между атомами водорода и атомами более электоотрицательного кислорода - атомов, входящих в состав пептидных групп.
Это означает, что группа >С=О одной пептидной связи образует водородную связь с группой -N-Н другой пептидной связи, отстающей от первой на четыре аминокислотных остатка. Водородные связи между >С=О и - N-H направлены параллельно оси спирали.
Водородные связи как бы сшивают спираль, удерживая полипептидную цепь в закрученном состоянии. Некоторые аминокислоты в силу строения их боковых групп препятствуют спирализации цепи. Например, пролин или оксипролин не содержат атома водорода в пептидной группе и, следовательно, не могут образовывать водородные связи. Поэтому участки полипептидной цепи, где есть пролин или оксипролин не способны к спирализации и полипептидная цепь делает изгиб “шпильку”.
Структура бета - складчатого листа. Эта структура напоминает меха аккордеона.


Структура складчатого листа
бета – структура формируется между линейными участками одной полипептидной цепи, образуя при этом складки или между разными полипептидными цепями. Полипептидые цепи или их части могут формировать параллельные и антипараллельные альфа-структуры.
Структура складчатого листа характерна для фибриллярных белков (нитевидных).
Соединительные петли - это участки полипептидной цепи, которые по конформации нельзя отнести ни к a-спирали, ни к b-складчатому листу. В соединительных петлях не все пептидные группы участвуют в образовании водородных связей и такие участки чаще находятся на поверхности белковой глобулы, в области ее контакта с водой.
Во многих белках одновременно имеются a-спиральные участки, b-структуры и соединительные петли. Природных белков, состоящих на 100% из a-спирали практически нет. Белки имеют неодинаковую степень спирализации. Высокая степень альфа-спирализации характерна для белков миоглобина, гемоглобина.
Напротив, белки опорных тканей кератин , коллаген (белок сухожилий, кожи) имеют в основном b-структуру.
Определенные сочетания альфа-спиралей и бета-структур в некоторых белках называют супервторичной структурой белков. Они имеют специфические названия: структура «бета-бочонка», «цинковый палец» и др.
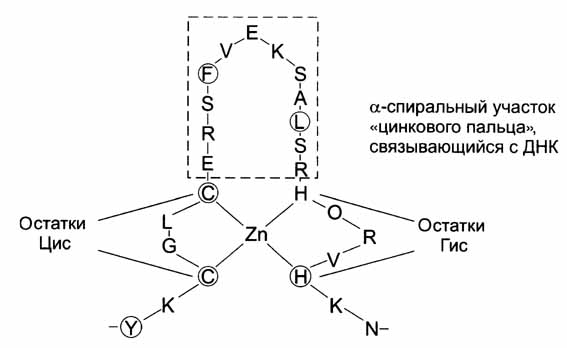

Фрагмент ДНК-связывающего белка в форме «цинкового пальца»
«Цинковый палец» - фрагмент белка, содержащий около 20 аминокислотных остатков, в котором атом цинка связан с боковыми группами 4 аминокислот: с двумя остатками цистеина и двумя гистидина. Два близко лежащих остатка цистеина отделены от 2 других остатков гистидина аминокислотной последовательностью состоящей из 12 аминокислотных остатков. Этот участок белка образует ? – спираль, которая может специфически связываться с регуляторными участками ДНК.
Третичная структура - это способ укладки полипептидной цепи в пространстве в виде компактной упаковки, за счет связей между радикалами. Эти взаимодействия могут возникать между группами, расположенными на значительном расстоянии друг от друга и полипептидная цепь, многократно изгибаясь, складываясь, образует глобулы или фибриллы, В поддержании третичной структуры важную роль играют слабые, но многочисленные водородные связи, ионные и гидрофобные взаимодействия, а также сильные дисульфидные связи.
а) Дисульфидные связи возникают между молекулами цистеина, расположенными на различных участках полипептидной цепи (идет окислительно-восстановительный процесс).
б) Ионные взаимодействия возможны между различными участками полипептидной цепи, имеющими разноименно заряженные группы. Этот вид взаимодействия возможен между моноаминодикарбоновыми кислотами (асп, глу), боковые цепи которых имеют отрицательный заряд и диаминомонокарбоновыми аминокислотами (лизин, аргинин), боковые цепи которых имеют положительный заряд.
в) Гидрофобные взаимодействия
Полипептидная цепь укладывается таким образом, что гидрофильные боковые группы (R- группы) аминокислот обращены наружу, а гидрофобные располагаются внутри. Гидрофобные группировки, испытывая отвращение к воде, стремясь избежать соприкосновения с ней, теснее сближаются друг с другом и взаимодействуют между собой.
Третичная структура - уникальное для каждого белка расположение в пространстве полипептидной цепи, зависящее от количества и чередования аминокислот, т.е. предопределенное первичной структурой. Благодаря наличию третичной структуры определяется форма белковой молекулы, характерная для каждого белка и необходимая для проявления его специфических, биологических свойств.
По форме белковых молекул белки бывают двух типов: фибриллярные(нитевидные) полипептидные цепи, они расположены параллельно друг другу, глобулярные, в которых полипептидные цепи плотно свернуты и образуют компактные структуры округлой формы - глобулы.
Примером фибриллярных белков являются белки соединительных тканей коллаген, эластин. Типичными глобулярными белками являются гемоглобин, миоглобин. Некоторые белки могут существовать как в глобулярной, так и в фибриллярной форме. Например, сократительный белок мышц актин.
Характерным глобулярным белком является миоглобин, содержащийся в мышцах. В молекуле миоглобина имеется одна полипептидная цепь, состоящая из 153 аминокислотных остатков и ядра гема. Эта полипептидная цепь очень компактно упаковывается, образуя глобулу. Основная функция миоглобина - связывание кислорода, в отличие от гемоглобина он в 5 раз быстрее связывает кислород. В этом кроется большой биологический смысл, поскольку миоглобин находится в глубине мышечной ткани (где низкое парциальное давление кислорода). Жадно связывая кислород, миоглобин создает кислородный резерв, который расходуется по мере необходимости, восполняя временный недостаток кислорода.


Типы связей, участвующих в стабилизации третичной структуры.
Все темы данного раздела:
Биохимия
1. Введение в биохимию 1.1. БЕЛКИ. АМИНОКИСЛОТЫ -- СТРУКТУРНЫЕ КОМПОНЕНТЫ БЕЛКОВ 1.2. Строение и классификация аминокислот 1.3. Уровни структурной организации
IV. Иминокислота
Вместе с тем в настоящее время общепринятой является классификация аминокислот на основе признаков, свойственных R-группам, в частности, их полярности, т.е. способности R-групп взаимодейств
Полярные положительно заряженные.
Аминокислоты, содержащие неполярные R-группы.
В боковой цепи этих аминокислот содержатся неполярные, неионные группы. К данному классу относятся алифатическ
К этой группе относят аспарагиновую и глутаминовую аминокислоты, имеющие в боковой цепи дополнительную карбоксильную группу, способную к диссоциации.
Следовательно, боковые группы данных аминокислот – анионы. Ионизированные формы глутаминовой и аспарагиновой кислот называют соответственно глутаматом и аспартатом.
Белковые модули (домены)
Обычно белки, образованные одной полипептидной цепью, представляют собой компактное образование, каждая часть которого не может функционировать и существовать отдельно, сохраняя прежнюю структуру.
Активный центр белка и взаимодействие его с лигандом.
Активный центр белка –это центр связывания белка с лигандом. На поверхности глобулы образуется участок, который может присоединять к себе другие молекулы называемые
Физико-химические свойства белков
Физико-химические свойства белков
Первичная структура белков в значительной степени определяет вторичную, третичную структуры и особенности четвертичной структуры. В свою очередь, первична
Характеристика простых белков.
К простым белкам относят гистоны, протамины, альбумины и глобулины, проламины и глютелины, протеиноиды.
Гистоны - тканевые белки многочисленных организмов, связаны с ДНК х
Альбумины и глобулины.
Альбумины (А) и глобулины (Г).
А и Г белки, которые есть во всех тканях. Сыворотка крови наиболее богата этими белками. Содержание альбуминов в ней составляет 40-45 г/л, глобулинов 20-30 г
Проламины и глютелины.
Это группа растительных белков, которые содержатся исключительно в клейковине семян злаковых растений, где выполняют роль запасных белков. Характерной особенностью проламинов является то, что они н
Протеиноиды.
Белки опорных тканей ( костей, хрящей, сухожилий, связок ), кератины - белки волос, рогов, копыт, коллагены - белки соединительной ткани, эластин - белок эластических волокон.
Все эти белк
Гемоглобин (Нв).
Гемоглобин имеет четвертичную структуру, молекулярная масса его 66-68 тыс.Да. Как следует из названия Нв представляет собой соединение гема с белком глобином. Это олигомерный белок, состоящий из 4
Типы гемоглобинов.
Гемоглобины могут различаться по белковой части. Различают физиологические и аномальные типы гемоглобинов. Физиологические типы образуются на разных этапах нормальног
ПРОТЕОГЛИКАНЫ
ГП - это сложные белки, содержащие олигосахаридные (гликановые) цепи, ковалентно связанные с белковой основой. К этой группе химических соединений относятся многие белки внешней поверхности цитопла
Участвуют в процессе свертывания крови.
Протромбин, фибриноген – являются белками свертывающей системы крови.
ПРОТЕОГЛИКАНЫ.
Это углевод-белковые комплексы, углеводный компонент кото
Высшие жирные кислоты
С17 Н35 СООН
Предельная
Стеариновая
С15 Н31 СООН
Пальмитиновая
Свободные липопротеины.
Содержатся в плазме крови, все они имеют разную плотность (от 0,92 до 1,21 кг/л) благодаря липидному компоненту. В крови человека присутствуют несколько фракций ЛП, отличающихс
Структурные липопротеины ( протеолипиды ).
Они входят в состав биологических мембран и растворяются в неполярных растворителях (хлороформ, метанол). Причина такого поведения протеолипидов в том, что белок составляет сердцевину их молекулы,
НУКЛЕОПРОТЕИНЫ
Нуклепротеины – это сложные белки, небелковая часть которых представлена нуклеиновыми кислотами. Поскольку нуклеиновые кислоты бывают двух типов, нуклеопротеины делятся по составу на 2 группы: рибо
Номенклатура наиболее распространенных нуклеотидов.
РИБОНУКЛЕОЗИДМОНОФОСФАТЫ:
1. Аденозинмонофосфат ( АМФ ), адениловая кислота.
2. Гуанозинмонофосфат ( ГМФ ), гуаниловая кислота.
3. Цитидинмонофосфат ( ЦМФ ), цитид
Структура нуклеиновых кислот.
Первичные структуры РНК и ДНК построены однотипно, они представляют собой линейные полимеры – полинуклеотиды, состоящие из мононуклеотидов, соединенных 3',5' – фосфодиэфирными связями.
При
Вторичная структура ДНК.
Особенностью нуклеотидного состава ДНК является то, что число адениловых нуклеотидов равно числу цитидиловых: А=Т, Г=Ц, следовательно, А+Г=Т+Ц, т.е. число пуриновых нуклеотидов равно числу пиримиди
Вторичная структура РНК.
Молекулы РНК построены из одной полинуклеотидной цепи. Отдельные участки цепи РНК образуют спирализованные петли "шпильки", за счет водородных связей между комплементарными азотистыми осн
Основные типы РНК.
По особенностям структуры и функциям различают 3 типа рибонуклеиновых кислот – транспортные РНК (тРНК), матричные РНК (мРНК) и рибосомальные РНК (рРНК). Они различаются по первичной структуре, моле
Третичная структура нуклеиновых кислот.
Одноцепочные РНК характеризуются компактной и упорядоченной третичной структурой, возникающей путем взаимодействия спирализованных участков вторичной структуры. Третичная структура РНК стабилизируе
ФОСФОПРОТЕИНЫ.
Фосфопротеины – это сложные белки, содержащие в своем составе в качестве простетической части фосфорную кислоту. Фосфорная кислота связана сложно – эфирной связью с белковой частью молекулы через г
Производные моносахаридов
Модификация имеющихся групп или введение новых заместителей в молекулу моносахаридов дает различные их производные. Они используются для построения разнообразных полимерных углеводов. Некоторые из
Олигосахариды
К олигосахаридам относятся сложные углеводы, имеющие от 2 до 10 звеньев моносахаридов соединенных гликозидными связями. Среди наиболее распространенных олигосахаридов следует отметить дисахариды –
Гомополисахариды (ПС).
Структурные различия между полисахаридами определяются:
- строением моносахаридов, составляющих цепь
- типом гликозидных связей, соединяющих мономеры в цепь
- последовате
Гетерополисахариды
Гликозамингликаны – линейные отрицательно заряженные гетерополисахариды. Раньше их называли мукополисахаридами, так как они обнаруживались в слизистых секретах (мукоза) и придавали этим секретам вя
Жирные кислоты и ацилглицеролы.
ЖИРНЫЕ КИСЛОТЫ.
Жирные кислоты – структурные компоненты различных липидов. Жирные кислоты липидов человека представляют собой углеводородную неразветвленную цепь на одном конце которой нах
ФОСФОЛИПИДЫ
Фосфолипиды – группа липидов, содержащих в своем составе остаток фосфорной кислоты. Фосфолипиды делят на глицерофосфолипиды, основу которых составляет глицерол и сфингофосфолипиды – производные ами
Сфинголипиды
Сфинголипиды – производные аминоспирта сфингозина. Аминоспирт сфингозинсостоит из 18 атомов углерода, содержит гидроксильные группы и аминогруппу.Примером сфинголипидов служат церамиды и сфингомиел
Стероиды
Стероиды – производныециклопентанпергидрофенантрена. В организме основной стероид – холестерол,остальные стероиды – его производные. Холестерол входит в состав мембран ивлияет на структуру бислоя,
Витамины
ВИТАМИНЫ
В середине XIX века сложились представления о пищевой ценности белков, жиров, углеводов, минеральных веществ и воды. Однако экспериментальные исследования клинические наблюдения с
Рацион взрослого человека
Завтрак
яичница (2 яйца, слив.масло 10г)
творог (100г)
бутерброд (хлеб 100г, слив. масло 10г)
кофе (сахар 20г)
Содержание витаминов:
С –
Жирорастворимые витамины
Жирорастворимые витамины.
Витамин А химическое название - ретинол, клиническое название - антиксерофтальмический. Ретинол состоит из кольца бета-ионона и боковой цепи содержащий два остатк
Водорастворимые витамины
Водорастворимые витамины
Витамин С.
Клиническое название этого витамина – антискорбутный, а химическое название – аскорбиновая кислота. Витамин С не содержит карбоксильной группы,
ВИТАМИНОПОДОБНЫЕ ВЕЩЕСТВА.
Синтезируются в организме, но в недостаточном количестве.
ПАБК (ПАРААМИНОБЕНЗОЙНАЯ К-ТА)
1.Участвует в образовании ФОЛИЕВОИ кислоты,
2.Участвует в образовании ряда фермен
Ферменты и неорганические катализаторы
ПОНЯТИЕ О ФЕРМЕНТАХ.
Ферменты - это биологические катализаторы в основном белковой природы.
Роль ферментов в организме огромна. В каждой клетке организма находится до 10000 молеку
Строение ферментов
Ферменты, являясь белками, повторяют все особенности структуры и состава белков (состоят из аминокислот, имеют 4 уровня структурной организации), физико-химические свойства белков. Ферменты, как и
Коферменты
КОФЕРМЕНТЫ
Коферменты – небелковая часть сложных ферментов. Их делят на две группы:
1.Витаминные.
2.Невитаминные.
Витаминные коферменты:
1.Тиаминовые ко
Свойства ферментов
СВОЙСТВА ФЕРМЕНТОВ.
1 .Высокая каталитическая активность.
2.Ферменты, являясь белками, проявляют термолабильные свойства - чувствительность к изменению температуры.
При п
Специфичность действия ферментов.
Субстратная специфичность
1. Абсолютная специфичность. Ей обладают ферменты, которые действуют только на 1 субстрат и не действуют на другие субстраты.
Уреаза катализирует гидроли
Номенклатура ферментов
Номенклатура ферментов.
1. Тривиальная номенклатура. Пример: пепсин, трипсин.
2. Рабочая номенклатура:
название S + тип превращения + окончание «аза».
пример: ла
Синтетазы
Механизм действия ферментов
Согласно современным представлениям при взаимодействии фермента с субстратом условно можно выделить 3 стадии:
1 стадия характеризуется диффузией субстрата к фермен
Кислотно-основный катализ.
В активном центре фермента содержатся группы кислотного и основного типа. Группы кислотного типа отщепляют Н+ и имеют отрицательный заряд. Группы основного типа присоединяют Н+ и имеют поло
А). Гипотеза Фишера.
Согласно ей имеется строгое стерическое соответствие субстрата и активного центра фермента. По Фишеру, фермент - это жёсткая структура, а субстрат является как бы слепком его активного цент
Обмен углеводов
ОБМЕН УГЛЕВОДОВ
1. Основные углеводы животного организма, их биологическая роль.
2. Превращение углеводов в органах пищеварительной системы.
3. Биосинтез и распад
Биологическая роль углеводов
БИОЛОГИЧЕСКАЯ РОЛЬ УГЛЕВОДОВ:
1. ЭНЕРГЕТИЧЕСКАЯ.
При окислении1 г углеводов до конечных продуктов (СО2 и Н2О) выделяется 4,1-ккал энергии. На долю углеводов приходится около 60-70
Превращение углеводов в пищеварительном тракте
ПРЕВРАЩЕНИЕ УГЛЕВОДОВ В
ПИЩЕВАРИТЕЛЬНОМ ТРАКТЕ
Основными углеводами пищи для организма человека являются: крахмал, гликоген, сахароза, лактоза.
Поступивший с пищей крахма
Биосинтез и распад гликогена
БИОСИНТЕЗ И РАСПАД ГЛИКОГЕНА В ТКАНЯХ.
ГЛИКОГЕНОВЫЕ БОЛЕЗНИ.
Было установлено, что гликоген может синтезироваться практически во всех органах и тканях. Однако наибольшая его конце
Анаэробный гликолиз
В зависимости от функционального состояния организма, клетки органов и тканей могут находиться как в условиях достаточного снабжения кислородом, так и испытывать его недостаток, то
Аэробный гликолиз (гексозодифосфатный путь)
ГЕКСОЗОДИФОСФАТНЫЙ ПУТЬ.
Это классический путь аэробного катаболизма углеводов в тканях протекает в цитоплазме до стадии образования пирувата и завершается в митохондриях с образование кон
Аэробный гликолиз (гексозодифосфатный путь)
ГЕКСОЗОДИФОСФАТНЫЙ ПУТЬ.
Это классический путь аэробного катаболизма углеводов в тканях протекает в цитоплазме до стадии образования пирувата и завершается в митохондриях с образование кон
Гексозомонофосфатный путь
ГЕКСОЗОМОНОФОСФАТНЫЙ ПУТЬ ПРЕВРАЩЕНИЯ ГЛЮКОЗЫ
В ТКАНЯХ, ХИМИЗМ РЕАКЦИЙ.
Окисление глюкозы по этому пути протекает в цитоплазме клеток и представлено двумя последовательными ветвям
Глюконеогенез
ГЛЮКОНЕОГЕНЕЗ
Основными источниками глюкозы для организма человека являются:
1. углеводы пищи;
2. гликоген тканей;
3. глюконеогенез.
ГЛЮКОНЕОГЕНЕЗ - это
Основные липиды организма человека их биологическая роль.
ЛИПИДАМИ называются сложные органические вещества биологической природы нерастворимые в воде, но растворимые в органических растворителях.
ЛИПИДЫ являются основным продуктом питания. Они п
Переваривание липидов, ресинтез жира
Переваривание липидов.
Поступающие с пищей ЛИПИДЫ в ротовой полости подвергаются только механической переработке. ЛИПОЛИТИЧЕСКИЕ ферменты в ротовой полости не образуются. Переваривание жир
Липопротеины крови
ЛИПИДЫ являются нерастворимыми в воде соединениями, поэтому для их переноса кровью необходимы специальные переносчики, которые растворимы в воде. Такими транспортными формами являются ЛИПОПРОТЕИНЫ.
Окисление высших жирных кислот
Жировая ткань, состоящая из адипозоцитов, выполняет специфическую роль в липидном обмене. Около 65% массы жировой ткани приходится на долю отложенных в ней триацилглицеролов (ТАГ) - они представляю
Биосинтез ВЖК в тканях
Биосинтез ВЖК происходит в эндоплазматической сети клеток. Заменимые ВЖК (все предельные и непредельные, имеющих одну двойную связь) синтезируются в клетках из АЦЁТИЛ-КоА.
Условиями для би
Обмен холестерина
Обмен холестерина.
Холестерин является предшественником в синтезе стероидов: желчных кислот, стероидных гормонов, витамина D3.Холестерин является обязательным структурным компон
Переваривание белков
Переваривание белков в пищеварительном тракте
Пищевые белки подвергаются гидролитическому расщеплению под действием ПРОТЕОЛИТИЧЕСКИХ ФЕРМЕНТОВ (класс – гидролазы, подкласс - пептидазы).
Гниение аминокислот, обезвреживание продуктов гниения
ГНИЕНИЕ АМИНОКИСЛОТ
Аминокислоты, которые не подверглись всасыванию, поступают в толстую кишку, где подвергаются гниению. ГНИЕНИЕ АМИНОКИСЛОТ - это процесс распада аминокислот под действие
Метаболизм аминокислот
Метаболизм аминокислот
Источниками аминокислот в клетке являются:
1. белки пищи после их гидролиза в органах пищеварения;
2. синтез заменимых аминокислот;
Пути обезвреживания аммиака
Аммиак образуется из аминокислот при распаде других азотсодержащих соединений (биогенных аминов, НУКЛЕОТИДОВ). Значительная часть аммиака образуется в толстой кишке при гниении. Он всасывается в кр
Регуляция обмена веществ
СИГНАЛЬНЫЕ МОЛЕКУЛЫ.
Основные задачи регуляции метаболизма и клеточных функций:
1. внутриклеточное и межклеточное согласование обменных процессов;
2. исключение «холостых
Гормоны гипоталамуса
ГОРМОНЫ ГИПОТАЛАМУСА
ГИПОТАЛАМУС является компонентом и своеобразным «выходным каналом» лимбической системы.
Это отдел промежуточного мозга, контролирующий различные параметры гом
ГОРМОНЫ ГИПОФИЗА
ГОРМОНЫ ГИПОФИЗА
В гипофизе выделяют переднюю (аденогипофиз) и заднюю доли (нейрогипофиз).
Гормоны аденогипофиза можно разделить на 3 группы в зави
ГОРМОНЫ ГИПОФИЗА
ГОРМОНЫ ГИПОФИЗА
В гипофизе выделяют переднюю (аденогипофиз) и заднюю доли (нейрогипофиз).
Гормоны аденогипофиза можно разделить на 3 группы в зави
Биосинтез йодтиронинов
Синтез йодтиронинов происходит в составе белка – тиреоглобулина, который находится в фолликулах щитовидной железы. Тиреоглобулин представляет собой гликопротеин, содержащий 115 остатков тирозина. П
Обмен липидов
В печени жировой ткани гормоны стимулируют липолиз. Указанные эффекты на обмен углеводов и липидов связывают с повышением чувствительности клеток к действию адреналина под влиянием тиреоидных гормо
Гипосекреция
В детском возрасте снижение секреции приводит к задержке физического и умственного развития (кретинизм).
У взрослых тяжелым проявлением недостатка гормонов щитовидной железы является миксе
Гиперсекреция
Диффузный токсический зоб (базедова болезнь) наиболее распространенное заболевание, сопровождающееся повышенной продукцией йодтиронинов. При этом заболевании размеры щитовидной железы увеличены и р
ГОРМОНЫ ПАРАЩИТОВИДНЫХ ЖЕЛЕЗ
Паратгормон синтезируется в паращитовидных железах и состоит из 84 аминокислотных остатков. Гормон хранится в секреторных гранулах. Секреция ПТГ регулируется уровнем кальция в крови: при сни
Гормоны половых желез
Гормоны половых желез
По химической природе представляют собой стероиды. Выделяют:
1. Андрогены;
2. Эстрогены;
3. Прогестины.
Гормоны надпочечников
Гормоны надпочечников
Надпочечники – железы внутренней секреции, в которых выделяют корковое и мозговое вещество. В корковом слое синтезируется гормоны стероидной природы, в мозгово
Гормоны поджелудочной железы
Гормоны поджелудочной железы
Функции поджелудочной железы:
· экзокринная;
· эндокринная.
Экзокринная функция заключается в синтезе и секреции пищеварительных фер
Экзаменационные вопросы
ФАРМАЦЕВТИЧЕСКИЙ ФАКУЛЬТЕТ (ЗАОЧНОЕ ОТДЕЛЕНИЕ)
Экзаменационные вопросы по биологической химии
для студентов 3 курса (6 семестр)
1. Биохимия, ее задачи. Связь биохимии с ф















Новости и инфо для студентов