рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Образование
- /
- Расчетные зависимости
Реферат Курсовая Конспект
Расчетные зависимости
Расчетные зависимости - раздел Образование, Расчетные зависимости Любым Материальным Объектам Присущи Как Корпускулярные, Так И Волновые Свойст...
Любым материальным объектам присущи как корпускулярные, так и волновые свойства. Движущейся со скоростью V частице массой m согласно формуле де Бройля соответствует волна длины

где h – постоянная Планка; Р – импульс частицы.
Поведение частицы, волновыми свойствами которой можно пренебречь, объясняется с помощью законов классической физики. Более совершенной теорией, учитывающей как корпускулярные, так и волновые свойства частиц, является квантовая механика.
В квантовой механике поведение частиц описывается с помощью волновой функции  (r, t). Физический смысл функции
(r, t). Физический смысл функции 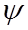 определяется соотношением
определяется соотношением
dw(r,t) =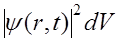 ,
,
которое означает, что вероятность dw обнаружить частицу вблизи точки r в элементарном объеме dV в момент времени t пропорциональна квадрату модуля волновой функции. Величина  имеет смысл плотности вероятности
имеет смысл плотности вероятности
 =
=  ,
,
т. е. определяет вероятность пребывания частицы в данной точке пространства.
По своему физическому смыслу волновая функция должна быть конечной, однозначной и непрерывной; первые производные от волновой функции должны быть непрерывны; волновая функция должна быть нормирована, т. е.
 .
.
Вид волновой функции определяется из решения уравнения Шредингера, которое выглядит следующим образом:
 . (5.1)
. (5.1)
Величины, входящие в уравнение (5.1), имеют следующие значения:
i – мнимая единица; m – масса частицы; U – потенциальная энергия частицы;
 – оператор Лапласа;
– оператор Лапласа;  .
.
Рассмотрим систему, состоящую из неподвижного ядра с зарядом Ze (Z – целое число) и двигающегося вокруг него электрона. При Z>1 такая система называется водородоподобным ионом; если Z = 1, она представляет собой атом водорода. Потенциальная энергия электрона в такой системе
U = 
где r – расстояние электрона от ядра.
Можно показать, не прибегая к постулатам Бора, что уравнение Шредингера для рассматриваемой задачи имеет требуемые (т. е. однозначные, конечные и непрерывные) решения в следующих случаях:
1) при любых положительных значениях полной энергии электрона Е;
2) при дискретных отрицательных значениях энергии
 (п = 1, 2, 3,...). (5.2)
(п = 1, 2, 3,...). (5.2)
Случай Е>0 соответствует свободному электрону, а случай Е<0 соответствует электрону, связанному с ядром. При этом каждому из полученных значений энергии соответствуют собственные волновые функции  , содержащие четыре параметра: n,
, содержащие четыре параметра: n, 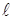 ,m, ms. Параметр n называют главным квантовым числом. Он совпадает с номером уровня энергии (см. формулу 5.2) водородоподобной системы. Параметр
,m, ms. Параметр n называют главным квантовым числом. Он совпадает с номером уровня энергии (см. формулу 5.2) водородоподобной системы. Параметр  представляет собой орбитальное квантовое число, которое определяет орбитальный момент импульса электрона выражением
представляет собой орбитальное квантовое число, которое определяет орбитальный момент импульса электрона выражением
 (
( =0, l, 2, ... , n-l).
=0, l, 2, ... , n-l).
m – магнитное квантовое число, определяющее проекцию орбитального момента импульса на физически выделенное направление
Lz = m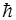 (m = 0, ± l, ± 2, ... , ±
(m = 0, ± l, ± 2, ... , ±  ).
).
ms – магнитное спиновое квантовое число.
Электроны характеризуются собственным спиновым моментом импульса
Ls= ,
,
где s – спиновое квантовое число (s = 1/2);
ms – определяет величину проекции спинового момента импульса электрона на направление внешнего поля
Lsz = ms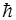 (ms= ± 1/2).
(ms= ± 1/2).
Совокупность четырех квантовых чисел (n, 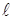 , m, ms) задает условия (энергию, орбитальный и спиновой моменты импульса, проекции указанных моментов импульса на направление поля), в которых находится электрон в атоме – электронное состояние.
, m, ms) задает условия (энергию, орбитальный и спиновой моменты импульса, проекции указанных моментов импульса на направление поля), в которых находится электрон в атоме – электронное состояние.
Согласно формуле (5.2) энергия электрона водородоподобной системы зависит только от главного квантового числа п. Следовательно, каждому собственному значению энергии Еп соответствует несколько собственных функций, отличающихся значениями квантовых чисел 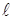 , m, ms. Это означает, что атом водорода может иметь одно и то же значение энергии, находясь в нескольких различных состояниях. В таблице 5.1 приведены состояния, соответствующие первым двум энергетическим уровням.
, m, ms. Это означает, что атом водорода может иметь одно и то же значение энергии, находясь в нескольких различных состояниях. В таблице 5.1 приведены состояния, соответствующие первым двум энергетическим уровням.
Обладая волновыми свойствами, электрон не имеет определенной траектории движения. Это означает, даже зная условия, в которых находится электрон, нельзя указать его точные координаты для определенного момента времени. Для электрона атома можно вычислить плотность вероятности обнаружения электрона при заданных условиях (см. рис. 5.1). На рис 5.1 видно, что для состояний уровня E1 водородоподобной системы  достигает максимума при r = r0 (r0 – радиус первой боровской орбиты), и отличается от нуля во всем пространстве атома.
достигает максимума при r = r0 (r0 – радиус первой боровской орбиты), и отличается от нуля во всем пространстве атома.
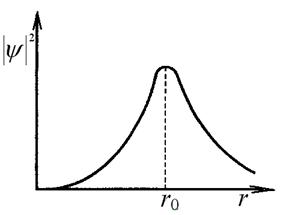 |
5.1. Зависимость плотности вероятности
 нахождения состояний электрона
нахождения состояний электрона
Таблица 5.1
Электронные состояния атома
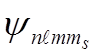
| 3начения квантовых чисел | ||||
| n | 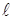
| m | ms | ||
| Е1 | 100 1/2 100 -1/2 | 1/2 -1/2 | |||
| E2 | 200 1/2 200 -1/2 211 1/2 211 -1/2 210 1/2 210 -1/2 21-1 1/2 21-1 -1/2 | -1 -1 | -1 -1 | 1/2 -1/2 1/2 -1/2 1/2 -1/2 1/2 -1/2 |
Энергия электрона в водородоподобной системе не зависит от величины и ориентации орбитального и спинового моментов импульса электрона. Схема уровней (зависимость энергии от квантового числа n атома) водорода приведена на рис. 5.2. Состояния электрона с n = 1 называют основными. В этих состояниях электроны атома обладают наименьшей энергией. Все состояния с n>1 называют возбужденными. Состояния с n =  (
( = 0) соответствуют свободному состоянию электронов.
= 0) соответствуют свободному состоянию электронов.
Возбуждение атома происходит в том случае, когда электрон атома, находясь в основном состоянии, получает энергию, достаточную для перехода на один из уровней, расположенных выше. Возбужденные атомы само-произвольно переходят в состояния с меньшей энергией, излучая квант
h =
=  =
= 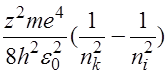
 |
где
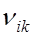 частота излучения, а ni и nk – квантовые числа тех уровней, между которыми осуществляется переход.
частота излучения, а ni и nk – квантовые числа тех уровней, между которыми осуществляется переход.
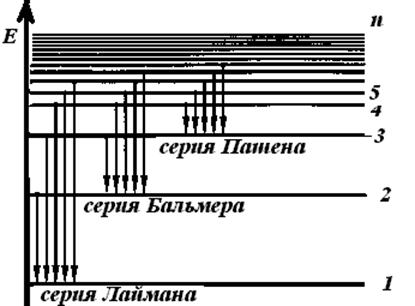
Рис.5.2. Схема уровней атома водорода
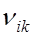 =
=  . (5.3)
. (5.3)
Формула (5.3) совпадает с экспериментально установленным выражением
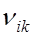 =
=  , (5.4)
, (5.4)
если принять
 =
=  .
.
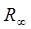 – константа, называемая постоянной Ридберга. Она равна 1,097373 107 м-1.
– константа, называемая постоянной Ридберга. Она равна 1,097373 107 м-1.
На рис. 5.2 видно, что каждая линия в спектре водорода входит в одну из спектральных серий. Для линий одной серии значение nk остается посто-янным, а ni может принимать любые значения от (nk + l) до 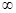 . Несложные подсчеты длин волн указывают, что линии серии Лаймана (nk= 1) расположены в ультрафиолетовой области спектра, линии серии Бальмера (nk = 2) и Пашена (nk = З) – соответственно в видимой и инфракрасной областях спектра.
. Несложные подсчеты длин волн указывают, что линии серии Лаймана (nk= 1) расположены в ультрафиолетовой области спектра, линии серии Бальмера (nk = 2) и Пашена (nk = З) – соответственно в видимой и инфракрасной областях спектра.
Постоянная Ридберга связана с длиной волны, излучаемой атомами водорода, соотношением
 т. е.
т. е.  (5.5)
(5.5)
– Конец работы –
Эта тема принадлежит разделу:
Расчетные зависимости
Федеральное агентство по образованию... Государственное образовательное учреждение... высшего профессионального образования...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Расчетные зависимости
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов