рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Образование
- /
- Электролиз
Реферат Курсовая Конспект
Электролиз
Электролиз - раздел Образование, ЗАДАНИЯ И МЕТОДИЧЕСКИЕ УКАЗАНИЯ Электролиз – Это Совокупность Окислительно-Восстановител...
Электролиз – это совокупность окислительно-восстановительных процессов, протекающих на электродах при пропускании постоянного электрического тока через раствор или расплав электролита. При электролизе происходит превращение электрической энергии в химическую энергию.
Электролиз проводят в электролизере, который представляет собой емкость, заполненную раствором или расплавом электролита, в который погружены два электрода (например, графитовые) – катод и анод. Катод подсоединяют к отрицательному полюсу внешнего источника тока, а анод – к положительному. Таким образом, катод – отрицательно заряженный электрод, а анод – положительно заряженный электрод. На катоде происходит процесс присоединения электронов катода (от внешнего источника тока) катионами, атомами, молекулами. На аноде происходит процесс отдачи электронов аноду (во внешнюю цепь) анионами, атомами, молекулами. Таким образом, на катоде протекает процесс восстановления, на аноде – процесс окисления.
Рассмотрим механизм электролиза на примере расплава соли фторида натрия NaF. Расплавы солей являются сильными электролитами, поэтому при высоких температурах полностью диссоциируют на ионы в соответствии с уравнением процесса: NaF = Na+ + F.–
Под действием электрического тока ионы приобретают направленное движение: катионы будут двигаться к катоду, а анионы – к аноду. Достигнув электродов, ионы начнут разряжаться на их поверхности. На катоде будет происходить процесс восстановления ионов Na+, а на аноде – процесс окисления ионов F–. Запишем электронные уравнения этих процессов и просуммируем их:
восстановления ионов Na+, а на аноде – процесс окисления ионов F–. Запишем электронные уравнения этих процессов и просуммируем их:
(К–): Na+ + e– → Na0 2 – процесс восстановления
(A+): 2F- – 2e– → F2 1 – процесс окисления
2Na+ + 2F- → Na0 + F2↑
Суммарное молекулярное уравнение электролиза:
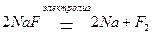
Электролиз водных растворов электролитов осложняется участием в электродных процессах молекул воды. Алгоритм рассмотрения электролиза водных растворов солей приведен в примерах решения задач.
При электролизе водных растворов электролитов необходимо учитывать особенности катодных и анодных процессов:
1. Катионы металлов от Li+ до Al3+ включительно (Е0Меn+/Ме0 < – 1,66 В) не восстанавливаются на катоде, вместо них на катоде восстанавливаются молекулы воды в соответствии с уравнением реакции: 2Н2О + 2е– = Н2 + 2ОН–
2. Катионы металлов от Mn2+ до H, восстанавливаются на катоде вместе с молекулами воды: Меn+ + ne– = Me0 ; 2Н2О + 2е– = Н2 + 2ОН–
3. Катионы металлов от Cu2+ до Au3+ полностью восстанавливаются на катоде в соответствии с уравнением реакции: Меn+ + ne– Me0
Если водный раствор электролита содержит катионы различных металлов, то при электролизе выделение их на катоде протекает в порядке уменьшения значений стандартных электродных потенциалов металлов.
4. На практике используют два типа анодов: инертные или нерастворимые (уголь, графит, золото, платина) и активные или растворимые (Cu, Ag, Ni, Zn и др). Инертные электроды не участвуют в процессе электролиза. Активные аноды сами участвуют (окисляются) в процессе электролиза в соответствии с уравнением реакции: Ме0 – ne– = Men+.
5. Анионы кислородсодержащих кислот (SO42-, NO3-, CO32-, PO43-), в которых центральный атом (S+6, N+5, C+4, P+5).находится в высшей степени окисления, а также ионы F– никогда не окисляется на аноде из водных растворов электролитов. Вместо них окисляются молекулы воды: 2Н2О – 4е– = О20 + 4Н+
Количественные соотношения между массой выделившихся на электродах веществ и количеством прошедшего электричества через раствор или расплав электролита выражают законом Фарадея:
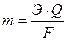 , (32)
, (32)
где m – масса вещества, выделившегося на электроде;
Э – его химический эквивалент;
Q – количество электричества (Кл);
F – число Фарадея (F= 96500 Кл).
Q = I·t, где I – сила тока (А), t – время электролиза (с).
Э=А/n, где А – атомная масса элемента; n – степень окисления его в соединении.
Тогда выражение (31) примет вид:
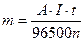 (33)
(33)
При электролизе в реальных условиях масса выделившегося вещества (его практический выход) всегда меньше массы вещества, рассчитанной по закону Фарадея. Это объясняется тем, что наряду с основными электродными процессами протекают побочные процессы, на которые расходуется часть количества электричества. Поэтому вводится понятие «выход по току»:
Впт =mпр/mтеор×100%, (33)
где mпр – масса вещества, практически полученного в процессе электролиза;
mтеор - масса вещества, теоретически рассчитанная по закону Фарадея.
Примеры решения задач
Пример 1. Составить схему электролиза нитрата свинца с угольными электродами.
Р е ш е н и е. 1) Определим состав электролита. Для этого запишем уравнение электролитической диссоциации соли Pb(NO3)2:
Pb(NO3)2 = Pb2+ + 2NO3–
(nH2O) (nH2O)
То есть в растворе присутствуют гидратированные ионы Pb2+и NO3–, а также молекулы воды, представляющие собой диполи Н+– ОН-.
2) Составляем условную схему электролиза, на которой показываем распределение ионов в пространстве и ориентацию полярных молекул воды у поверхности электродов. При прохождении тока через раствор положительно заряженные ионы будут двигаться к катоду, отрицательно заряженные – к аноду; молекулы воды будут определенным образом ориентироваться у поверхности электродов: положительно заряженным полюсом диполя у катода, а отрицательно заряженным полюсом – у анода. Таким образом, у поверхности каждого из электродов на электродах будут скапливаться два сорта частиц: у катода – катионы Pb2+ и молекулы воды, а у анода – анионы NO3– и молекулы воды. Следовательно, на каждом из электродов будут протекать два конкурирующих процесса.
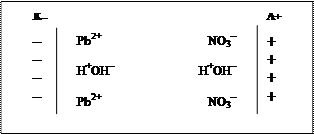
3) На основании сравнения значений стандартных электродных потенциалов определяем частицы, участвующие в катодном процессе (восстановления):
Е0Pb2+/Pb0 = – 0,13 B > Е0Н2О/Н2= –0,41 (–0,83) В, следовательно, ионы Pb2+ обладают большей окислительной активностью и поэтому они участвуют в катодном процессе в соответствии с уравнением реакции: Pb2+ + 2e– = Pb0
4) Определяем частицы, участвующие в анодном процессе (окисления).
Вспоминаем, что нитрат-ион относится к числу кислородсодержащих ионов, в котором центральный атом (N+5) находится в высшей степени окисления, поэтому ион NO3– не будет окисляться на аноде, вместо него окисляются молекулы воды:
2Н2О – 4е– = О20 + 4Н+
5) Составляем суммарное ионное, а затем – суммарное молекулярное уравнения процесса электролиза:
(K–): Pb2+ + 2e– → Pb0 2
(A+): 2Н2О – 4е– = О20 + 4Н+ 1
2Pb2+ + 2Н2О = 2Pb0 + О20 + 4Н+
2Pb(NO3)2 + 2Н2О = 2Pb0 + О20 + 4НNO3
Таким образом, при электролизе водного раствора Pb(NO3)2 с угольными электродами в процессе электролиза участвует как сам электролит, так и молекулы воды. Основными продуктами электролиза являются атомы свинца и молекулярный кислород, побочным продуктом является азотная кислота, накапливающаяся в прианодном пространстве.
Пример 2. Раствор содержит ионы Fe2+, Ag+, Bi3+, и Pb2+ одинаковой концентрации. В какой последовательности будут разряжаться эти катионы при электролизе, если напряжение достаточно для выделения любого металла?
Р е ш е н и е. При электролизе катионы разряжаются на катоде, где происходит процесс восстановления. Восстанавливаются ионы, обладающие окислительной активностью, которая тем выше, чем больше значение стандартного электродного потенциала. Следовательно, необходимо сравнить значения стандартных электродных потенциалов заданных ионов металлов:
Е0Fe2+/Fe0 = – 0,44В, Е0Ag+/Ag0 = 0,8В, Е0Bi3+/Bi0 = 0,21В, Е0Pb2+/Pb0 = – 0,13В
Сравниваем эти значения: Е0Ag+/Ag0 > Е0Bi3+/Bi0 > Е0Pb2+/Pb0 > Е0Fe2+/Fe0. Следовательно, в ряду Ag+ – Bi3+ – Pb2+ – Fe2+ окислительная активность уменьшается, поэтому легче всего восстанавливаются ионы Ag+, затем ионы Bi3+, далее – ионы Pb2+ и в последнюю очередь – ионы Fe2+. Восстановление ионов Fe2+ будет происходить совместно с молекулами воды.
Запишем электронные уравнения процессов, протекающих на катоде:
Ag+ + e– → Ag0 , Bi3+ + 3e– → Bi0 , Pb2+ +2 e– → Pb0 , Fe2+ + 2e– → Fe0
Пример 3. Написать уравнения реакций, протекающих на электродах при электролизе водного раствора хлорида никеля с никелевым анодом.
Р е ш е н и е. 1) Определяем состав электролита. Записываем уравнение электролитической диссоциации хлорида никеля: NiCl2 = Ni2+ + 2 Cl–
(nH2O) (nH2O)
2) Составляем условную схему электролиза (аналогичную схеме в задаче
№ 1), на которой показываем распределение ионов в пространстве и ориентацию полярных молекул воды у поверхности электродов. К катоду подходят катионы Ni2+ и молекулы воды, ориентированные положительным полюсом к поверхности катода; к аноду подходят анионы Cl– и молекулы воды, ориентированные отрицательным полюсом к поверхности анода.
3) Определяем, какие частицы будут участвовать в катодном процессе на основании сравнения значений стандартных электродных потенциалов:
(K–) Е0Ni2+/Ni0 = – 0,25 B, Е0Н2О/Н2 = – 0,41 (–0,83)В
Е0Ni2+/Ni0 > Е0Н2О/Н2, следовательно, ионы Ni2+ обладают большей окислительной активностью и поэтому они участвуют в катодном процессе в соответствии с уравнением реакции: Ni2+ + 2e– = Ni0
4) Определяем, какие частицы будут участвовать в анодном процессе. Для этого выписываем значения стандартных электродных потенциалов трех частиц: Cl-, H2O и Ni, поскольку материал анода также является химически активным:
(А+): Е0Cl2/2Cl- = + 1,36 В, Е0О2 / 2Н2O = + 1,23 ÷ (1,8)В , Е0Ni2+/Ni0 = – 0,25 B.
Сравнение значений Е0 показывает, что Е0Ni2+/Ni0 < Е0Cl2/2Cl-< Е0О2 / 2Н2O, поэтому большей восстановительной активностью обладают атомы никеля. Следовательно, сам никелевый анод будет участвовать в процессе окисления:
Ni0 – 2e– = Ni2+
5) Объединяем уравнения катодного и анодного процессов:
(K–) Ni2+ + 2e– = Ni0
(А+)Ni0 – 2e– = Ni2+
При суммировании получается 0 = 0, что лишено физического смысла. Поэтому рассмотрение электролиза завершают на этом этапе.
Таким образом, электролиз водного раствора NiCl2 с никелевым анодом сводится к анодному окислению атомов никеля (Ni0) и катодному восстановлению ионов никеля (Ni2+), т.е. переносу никеля с анода на катод. При этом количество электролита в растворе остается неизменным.
1.15. Свойства и получение полимеров
Высокомолекулярные соединения (ВМС) – это химические вещества с большой молекулярной массой и обладающие особыми свойствами.
Химия ВМС изучает вещества, молекулы которых состоят из огромного числа атомов, соединенных между собой ковалентными связями. Такие молекулы называют макромолекулами: (С2Н4)n – полиэтилен; (C6H10O5)n – целлюлоза; (C5H8)n – натуральный каучук. Высокомолекулярные соединения называют еще полимерами.
Макромолекулы большинства полимеров построены из одинаковых групп атомов. Эти одинаковые, многократно повторяющиеся группы атомов, связанные между собой ковалентными связями, называются элементарными звеньями. Элементарное звено, как правило, представляет собой остаток соответствующего мономера:
(С2Н4)n – полиэтилен – элементарное звено –СН2–СН2–;
(C2H3Cl)n – поливинилхлорид (ПВХ) – –СН2–СНCl–;
(C5H8)n – натуральный каучук (полиизопрен) –СН2–СН=С(СН3)–СН2–
Поэтому для изображения полимеров используют суммарные формулы:
(–СН2–СН2–)n, (–СН2–СНCl–)n , (–СН2–СН=С(СН3)–СН2–)n.
Высокомолекулярные соединения обладают следующими специфическими свойствами:
– более низкая скорость растворения (по сравнению с низкомолекулярными веществами);
– высокая вязкость (более высокая, чем вязкость концентрированных растворов мономеров);
– протекание процесса деформации во времени (вследствие медленного проявления упругих свойств полимерных материалов);
– гибкость цепных макромолекул, обеспечивающая постоянное изменение их конфигурации;
– зависимость свойств макромолекул от их геометрической формы (линейные макромолекулы обладают высокой прочностью и эластичностью; разветвленные полимеры обладают большей растворимостью по сравнению с линейными; сетчатые полимеры не растворяются и не плавятся без разложения).
В зависимости от порядка элементарных звеньев в цепи различают регулярные и нерегулярные полимеры. В регулярных полимерах отмечается правильно повторяющееся расположение атомов в макромолекуле; в нерегулярных – хаотичное расположение атомов. Например, натуральный каучук – это полимер изопрена –CH2=C(CH3)–CH=CH2, а синтетический каучук – полимер бутадиена-1,3 (CH2=CH–CH=CH2).
Сополимеры – это полимеры, макромолекулярные цепи которых построены из разных элементарных звеньев, например, бутадиеннитрильный каучук получают сополимеризацией бутадиена-1,3 (CH2=CH–CH=CH2) с акрилонитрилом (CH2=CH–CN).
Существуют следующие способы получения полимеров: метод полимеризации и метод поликонденсации. Полимеризация – это реакция соединения молекул мономера, протекающая за счет разрыва кратных связей и не сопровождающаяся выделением побочных низкомолекулярных продуктов. В реакцию полимеризацию вступают, главным образом, ненасыщенные соединения, у которых кратные связи находятся между атомами углерода:
n CH2=CHCl ® [–CH2–CHCl–]n
винилхлорид ПВХ – поливинилхлорид
n H2–CO ® [–CH2–O–]n
формальдегид полиметиленоксид
Поликонденсация – это процесс образования полимеров путем химического взаимодействия молекул мономеров, сопровождающийся выделением низкомолекулярных веществ (H2O, NH3, HCl, C2H5OH и др.):
HOOC–(CH2)4–COOH + HNH–(CH2)6–NH2 →
адипиновая кислота гексаметилендиамин
→ HOOC–(CH2)4–CO–NH–(CH2)6–NH2(CH2)6–NH2 + H2O
гексаметиленадипинат
По физическому состоянию все полимеры делятся на:
– текучие – необратимо меняют форму под действием даже незначительных нагрузок (например, полиизобутилен) и имеют аморфное строение;
– высокоэластичные (эластомеры) – обратимо деформируются под действием небольших нагрузок; имеют аморфное строение (каучук, резина);
– твердые – мало изменяют свою форму даже при больших нагрузках; после устранения нагрузки способны восстановить свою форму.
По отношению к воздействию тепла полимеры бывают
– термопластичными (способны размягчаться при нагревании и снова затвердевать при охлаждении, сохраняя свои свойства: растворимость, плавкость);
– термореактивными (способны размягчаться при нагревании, а при затвердевании – переходить в неплавкое и нерастворимое состояние).
Все полимеры подвергаются деструкции. Деструкция – это процесс разрушения полимеров, протекающий с разрывом связей основной макромолекулярной цепи, приводящим к понижению молекулярной массы полимера. Деструкция бывает следующих видов:
– химическая – протекает под действием химических реагентов (воды, спиртов, аммиака, кислот, щелочей и др.); например, кислотный гидролиз крахмала с образованием глюкозы:
(С6Н10О5)n + Н2О + H+ → nC6H12O6;
– механическая – происходит при действии механических напряжений (происходит изменение структуры и свойств полимера, связанное с разрывом макромолекулы);
– окислительная – протекает под действием окислителей, например, кислорода;
– термическая – происходит при нагревании полимеров;
– фотохимическая – происходит под действием света (l= 300 – 400 нм) и сопровождается разрывом полимерной цепи;
– радиационная – происходит под влиянием нейтронов, а также a-, b-,
g- излучения. Разрываются связи С–С, С–Н и образуются низкомолекулярные продукты;
– биологическая – протекает под действием микроорганизмов (например, нитрат целлюлозы, поливинилацетат, натуральный каучук).
2. КОНТРОЛЬНЫЕ ЗАДАНИЯ
– Конец работы –
Эта тема принадлежит разделу:
ЗАДАНИЯ И МЕТОДИЧЕСКИЕ УКАЗАНИЯ
Федеральное государственное автономное образовательное учреждение высшего профессионального образования... Российский государственный профессионально педагогический университет... Машиностроительный институт...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Электролиз
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов