рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Образование
- /
- Существует несколько способов выражения концентрации растворов.
Реферат Курсовая Конспект
Существует несколько способов выражения концентрации растворов.
Существует несколько способов выражения концентрации растворов. - раздел Образование, ЗАДАНИЯ И МЕТОДИЧЕСКИЕ УКАЗАНИЯ Молярная Концентрация, Или Молярность (СM...
Молярная концентрация, или молярность (СM) – количество вещества (ν) растворенного компонента, содержащееся в 1 литре (дм3) раствора:
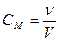 [моль/л], (14)
[моль/л], (14)
Молярная концентрация эквивалентов (Сэкв), (нормальная концентрация или нормальность N) – количество вещества эквивалентов (νэкв) растворенного компонента, содержащееся в 1 литре (дм3) раствора:
Сэкв (N) = νэкв / V [моль-экв/л] (15)
Моляльная концентрация или моляльность (b) – количество вещества (ν) растворенного компонента в 1 кг раствора:
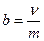 [моль/кг], (16)
[моль/кг], (16)
Массовая доля (ω) – отношение массы растворенного вещества (mр.в.) к массе раствора (mр-ра) Ее рассчитывают, выражая в долях единицы или в процентах. Массовая доля, выраженная в процентах, называется процентной концентрацией:
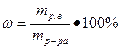 (17)
(17)
Процентная концентрация показывает массу растворенного вещества, содержащегося в 100 г раствора. Например, ω(KOH) = 3% означает, что в 100 г этого раствора содержится 3 г KOH и 97 г H2O.
Молярная доля (Ni) – отношение количества вещества растворенного компонента (nв-ва) (или растворителя, nр-ля) к суммарному количеству вещества всех компонентов раствора. Например, в системе, состоящей из растворителя и одного растворенного вещества, молярная доля растворенного вещества равна:
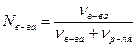 , (18)
, (18)
Молярная доля растворителя:
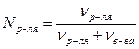 (19)
(19)
Примеры решения задач
Пример 1. Определить молярную концентрацию раствора NaOH с массовой долей 10% и плотностью r =1,1 г/см3.
Р е ш е н и е. 1) Записываем выражение для молярной концентрации раствора NaOH : 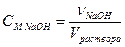
2) 10%-ный раствор – это 10гNaOH в 100г раствора. Находим количество вещества NaOH, содержащееся в 10 г:
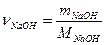 , mNaOH = 10 г, MNaOH = 23 + 16 +1 = 40 г/моль
, mNaOH = 10 г, MNaOH = 23 + 16 +1 = 40 г/моль
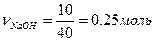 , т.е. 0,25 моль NaOH содержится в 100 г раствора.
, т.е. 0,25 моль NaOH содержится в 100 г раствора.
3) Находим объем раствора массой 100 г:
m=V×r, 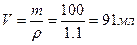 = 0,091 л
= 0,091 л
4) Рассчитываем молярную концентрацию:
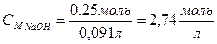
Ответ: молярная концентрация раствора гидроксида натрия с массовой долей 10% составляет 2,74 моль/л
Пример 2. Найти молярную долю растворенного вещества в растворе сахарозы с массовой долей 67%.
Р е ш е н и е. 1) Вспомним, что молярная доля растворенного вещества равна:
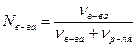
67%-ный (по массе) раствор означает, что в 100 г раствора содержится 67 г сахарозы и 33 г воды.
2) Определяем количество вещества сахарозы и количество вещества воды:
nв-ва = 67/342 = 0,196 моль, nр-ля = 33/18 = 1,83 моль
Следовательно, молярная доля сахарозы равна:

Ответ: молярная доля сахарозы в растворе сахарозы с массовой долей 67% составляет 0,097.
Пример 3. Какой объем серной кислоты с массовой долей 96% (плотностью 1,84 г/см3) и какую массу воды нужно взять для приготовления 100 мл 15%-ного (по массе) раствора H2SO4 (r = 1,10 г/см3).
Р е ш е н и е. 1) Найдем массу 100 мл 15% раствораH2SO4:
mH2SO4-р-ра = V×r = 100×1,10 =110 г
2) Из формулы массовой доли находим массу серной кислоты, содержащейся в этом растворе:
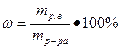 ; mH2SO4 =
; mH2SO4 = 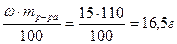
3) Найдем массу 96% раствора, содержащего 16,5 г H2SO4:
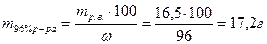
4) Находим объем 96 %-ного раствора серной кислоты:
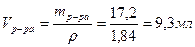
Ответ: для приготовления 100мл 15%-ного раствора H2SO4 потребуется 9,3 мл 96%-ного раствора серной кислоты и 110 – 16,5 = 93,5 г воды.
1.9. Коллоидные растворы
Дисперсные системы - это системы, состоящие как минимум из двух веществ, одно из которых измельчено и распределено в другом.
То вещество, которое образует в дисперсной системе сплошную фазу, называют дисперсионной средой,а то, что распределено в среде – дисперсной фазой.Гомогенные дисперсные системы называют истинными растворами или просто растворами. Линейные размеры их частиц не превышают размеров отдельных ионов и молекул – до 1 нм. Гетерогенные дисперсные системы подразделяются на коллоидные системы (размеры частиц от 1 до 100 нм) и грубодисперсные или микрогетерогенные системы (размеры частиц более 100 нм).
Коллоидные системы, дисперсионная среда которых жидкость, называются коллоидными растворами или золями. Их можно рассматривать как частный случай истинных растворов. Дисперсная фаза – это растворенное вещество, а дисперсионная среда – растворитель.
Для получения коллоидных растворов используются любые реакции, в результате которых образуются труднорастворимые соединения:
FeCl3 + 3H2O = Fe(OH)3↓ + 3HCl (20)
AgNO3 + KI = AgI↓ +KNO3 (21)
Ba(Cl)2 + Na2SO4 = BaSO4↓+ 2NaCl (22)
Структурной единицей коллоидного раствора является мицелла – это отдельная частица дисперсной фазы с жидкой дисперсионной средой. Рассмотрим образование мицеллы на примере реакции (21). Избыток одного из компонентов действует как стабилизатор коллоидного раствора, то есть как вещество, препятствующее агрегации коллоидных частиц в более крупные и выпадению их в осадок.
Пусть в избытке будет азотнокислое серебро. Труднорастворимый AgI образует кристаллический агрегат, состоящий из m молекул AgI. Агрегат адсорбирует на поверхности ионы Ag+, находящиеся в избытке. Они придают агрегату положительный заряд и называются потенциалопределяющими ионами.Агрегат и потенциалопределяющие ионы образуют ядро (m AgI) n Ag+. С заряженной поверхностью ядра устойчиво связано некоторое число ионов противоположного знака – противоионов –(n-x)NO3–. Потенциалопределяющие ионы и связанные противоионы образуют адсорбционный слой. Агрегат вместе с адсорбционным слоем называется гранулой или коллоидной частицей. Она имеет электрический заряд, совпадающий с зарядом потенциалопределяющего иона (х+). В состав коллоидной частицы входит только часть имеющихся в растворе противоионов. Остальные противоионы xNO3- остаются в дисперсионной среде и образуют диффузионный слой. Заряды потенциалопределяющих ионов и противоионов полностью скомпенсированы. Поэтому мицелла электронейтральна.
Строение мицеллы золя иодида серебра имеет вид:
ядро
{[mAgI]nAg+(n-x)NO3-}x+ ∙ xNO3-
агрегат адсорбционный диффузионный
слой слой
Если в растворе избыток KI, то мицелла будет иметь вид:
{[mAgI]nI-(n-x)K+ }x- ∙ xK+
Строение мицеллы золя сульфата бария, полученного по реакции (22) с избытком хлорида бария: {[m BaSO4] n Ba2+ 2(n-x)Cl-}2x+ 2xCl-
Строение мицеллы золя Fe(OH)3: {[m (FeOH)3] nFe3+ 3(n-x)Cl- }3x+ 3xCl-
– Конец работы –
Эта тема принадлежит разделу:
ЗАДАНИЯ И МЕТОДИЧЕСКИЕ УКАЗАНИЯ
Федеральное государственное автономное образовательное учреждение высшего профессионального образования... Российский государственный профессионально педагогический университет... Машиностроительный институт...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Существует несколько способов выражения концентрации растворов.
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов