рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Образование
- /
- Элементы химической термодинамики и термохимии
Реферат Курсовая Конспект
Элементы химической термодинамики и термохимии
Элементы химической термодинамики и термохимии - раздел Образование, ЗАДАНИЯ И МЕТОДИЧЕСКИЕ УКАЗАНИЯ Химическая Термодинамика – Это Часть Термодинамики, Расс...
Химическая термодинамика – это часть термодинамики, рассматривающая превращения энергии и работы при химических реакциях. Термохимия– раздел химической термодинамики в приложении к тепловым эффектам химических реакций.
Тепловой эффект химической реакции – это количество теплоты, которое выделяется или поглощается при реакции. При этом происходит изменении внутренней энергии системы (U)–суммы кинетической и потенциальной энергий всех частиц, составляющих систему: ∆U = U2 – U1 (U1 – начальное состояние системы, U2 – конечное состояние системы).
В соответствии с первым законом термодинамики (законом сохранения энергии) изменение внутренней энергии закрытой системы определяется количеством теплоты Q,полученной системой из окружающей среды, и работой A, произведенной системой над окружающей средой:
∆U = Q – A, (1)
где A = P ∆V – механическая работа расширения.
Для изобарных процессов (Р = const, ∆V ≠ 0) в термодинамике вводится новая функция энтальпия H = U + PVи Q определяется как изменение энтальпии
∆H = H2 – H1:
QP = ∆H, (2)
где ∆H – тепловой эффект химической реакции при P = const.
Реакции, протекающие с выделением теплоты, называются экзотермическими. В экзотермических реакциях внутренняя энергия и энтальпия системы уменьшаются, ∆H < 0. Реакции, протекающие с поглощением теплоты, называются эндотермическими. В эндотермических реакциях внутренняя энергия и энтальпия системы увеличиваются, ∆H > 0.
В основе термохимических расчетов лежит закон Гесса:тепловой эффект химической реакции зависит только от природы и физического состояния исходных веществ и продуктов реакции и не зависит от пути реакции, т.е. числа промежуточных стадий. Закон Гесса констатирует тот факт, что U и Hявляются функциями состояния системы,т.е. их изменение (∆U и ∆H) зависит только от начального и конечного состояния системы.
Следствие из закона Гесса:
Тепловой эффект химической реакции равен разности между суммой энтальпий образования продуктов реакции и суммой энтальпий образования исходных веществ:
∆H0298 = ∑ν ∆H0f, 298 – ∑ν′ ∆H0f, 298 , (3)
продукты исходные
реакции вещества
(конечное состояние (начальное состояние
системы) системы)
где ν и ν′ - стехиометрические коэффициенты в уравнении реакции;
∆H0f,298 – стандартная энтальпия образования вещества, кДж/моль.
Стандартная энтальпия образования вещества (∆H0f,298) – это тепловой эффект образования одного моля данного вещества из простых веществ в стандартных условиях (Т = 298К, Р = 1 атм.). Значения ∆H0f, 298 приводятся в справочной литературе (см. табл. 2). Для простых веществ ∆H0f, 298 = 0.
Наблюдения показывают, что самопроизвольно, т.е. без затраты работы извне, могут идти как экзотермические, так и эндотермические реакции, если последние сопровождаются увеличением неупорядоченности системы (например, реакции, в которых из твердых веществ образуются газообразные вещества).
Степень неупорядоченности системы выражается термодинамической величиной – энтропией S. Чем выше неупорядоченность системы, тем больше ее энтропия. S также, как U и H, является функцией состояния системы. Для вычисления изменения энтропии (∆S =S2 – S1) в химических реакциях используют следствие из закона Гесса:
∆S0298 = ∑ν ∙S0 298 - ∑ν′ ∙ S0 298 , (4)
продукты исходные
реакции вещества
где ∆S0298 – изменение энтропии реакции при стандартных условиях, Дж/моль;
ν и ν′ – стехиометрические коэффициенты в уравнении реакции;
S0 298 – стандартная энтропия вещества, Дж/моль∙К.
Известны абсолютные значения энтропии веществ, они приводятся в справочной литературе (см. табл. 2).
Термодинамическая величина, связанная с энтальпией и энтропией, называется энергией Гиббса (изобарно-изотермическим потенциалом) и обозначается буквой G:
G = H – T∙S.В изобарно-изотермических условиях
∆G = ∆H – T×∆S (5)
Величина ∆G является критерием направления и предела самопроизвольного протекания химических реакций в закрытых системах при Р,Т = const:∆G ≤ 0.
Если ∆G < 0, то реакция протекает самопроизвольно в прямом направлении (ему отвечает убыль энергии G2 < G1); если ∆G > 0, то самопроизвольно протекает обратная реакция (G2 > G1); если ∆G = 0, то система находится в состоянии равновесия, при котором G = Gmin. Так как G является функцией состояния системы, то для стандартных условий изменение энергии Гиббса химической реакции ∆G0298 рассчитывается следующим образом:
∆G0298 = ∑ν ∙ ∆G0f, 298 – ∑ν′ ∆G0f, 298 , (6)
продукты исходные
реакции вещества
где ν и ν′ - стехиометрические коэффициенты в уравнении реакции;
∆G0f, 298 – стандартная энергия Гиббса образования вещества, кДж/моль.
Стандартная энергия Гиббса образования вещества (∆G0f, 298)– это изменение энергии Гиббса при реакции образования одного моля вещества из простых веществ при стандартных условиях. Значения ∆G0f,298 – это справочные данные, для простых веществ ∆G0f, 298 = 0 (см. табл. 2). Для расчета ∆G при температуре, отличающейся от стандартной (Т ≠ 298К), используется соотношение:
∆GТ = ∆H0298 – T×∆S0298 , (7)
где ∆H0298 – тепловой эффект химической реакции при стандартных условиях, энтальпийный фактор; ∆S0298 – изменение энтропии химической реакции при стандартных условиях; T∆S0298 – энтропийный фактор.
Знак и величина ∆G, а, следовательно, и возможность самопроизвольного протекания процесса при заданных температуре и давлении зависят от соотношения энтальпийного и энтропийного факторов.
Примеры решения задач
Пример 1. Рассчитайте тепловой эффект реакции образования оксида железа (III) из простых веществ при стандартных условиях и стандартную энтальпию образования оксида железа (III), используя следующие термохимические уравнения:
2 Fe(т) + O2 (г) = 2FeO(т) , ∆H01 = - 527,4 кДж (а)
4FeO(т) + O2(г) = 2Fe2O3(т) , ∆H02 = -587,9 кДж (б)
Р е ш е н и е. 1) Записываем термохимическое уравнение образования оксида железа (III) из простых веществ:
4 Fe (т) + 3O2(г) = 2Fe2O3(т) , ∆H03 = ? , (в)
где ∆H03 – тепловой эффект этой реакции.
2) Для расчета ∆H03 необходимо провести такую комбинацию уравнений (а) и (б), которая позволит получить уравнение реакции (в). На основании закона Гесса с термохимическими уравнениями можно оперировать также, как с алгебраическими. Для получения искомого результата следует уравнение (а) умножить на 2, а затем суммировать с уравнением (б): 4Fe + 2O2 + 4FeO + O2 = 4FeO + 2Fe2O3
4Fe + 3O2 = 2 Fe2O3
3) Тепловые эффекты реакции являются составной частью термохимических уравнений, поэтому с ними проведем аналогичные преобразования:
2∙∆H01 + ∆H02 = ∆H03
4) Рассчитываем ∆H03 – тепловой эффект реакции (в):
∆H03 = 2×(–527,4) + (–587,9) = –1054,8 – 587,9 = – 1642,7 кДж.
5) Определяем стандартную энтальпию образования Fe2O3 (∆H0f, 298).
Согласно уравнению (в) в результате реакции образуются 2 моль Fe2O3, поэтому
∆H0f, 298 (Fe2O3) = ∆H03 /2 = – 1642,7 / 2 = – 821,35 кДж/моль.
Правильность расчета проверяем, сравнивая полученное значение со справочными данными табл. 2.
Пример 2. Определите возможность самопроизвольного протекания реакции восстановления оксида хрома (III) углеродом при 298К и 1500К.
Р е ш е н и е. 1) Записываем уравнение этой реакции с указанием агрегатного состояния реагирующих веществ: Cr2O3 (т) +3C(т) = 2Cr(т) + 3CO(г)
2) Согласно условию задачи необходимо ответить на вопрос: будет ли данная реакция протекать в прямом направлении? Критерием направленности химической реакции является изменение энергии Гиббса, а условием самопроизвольного протекания реакции в прямом направлении является соотношение ∆G < 0. Поэтому для решения задачи необходимо определить величину ∆G.
3) Определяем, будет ли данная реакция осуществляться при Т=298К, отвечающей стандартным условиям. Рассчитываем ∆G по уравнению (6), которое для данной реакции имеет вид:
∆G0298 = (2×∆G0f, 298Cr + 3×∆G0f, 298 CO) – (∆G0f, 298 Cr2O3 + 3×∆G0f, 298C)
Для расчета используем значения ∆G0f, 298 приведенные в табл.2
Так как ∆G0f, 298 простых веществ Cr и С равны нулю, то уравнение упрощается:
∆G0298 = 3 моль×(-137,3 кДж/моль) – 1 моль×(-1046,8 кДж/моль)=
= -411,9 кДж + 1046,8 кДж = 634,9 кДж.
Вывод: ∆G0298 > 0, поэтому в стандартных условиях невозможно самопроизвольное протекание процесса в прямом направлении, т.е. при 298К невозможно восстановить Cr2O3 до Cr.
4) Выясняем, возможна ли данная реакция при 1500К. В условиях, отличающихся от стандартных, величина ∆G0Т рассчитывается по уравнению (7):
∆GТ = ∆H0298 – T×∆S0298. Рассчитаем тепловой эффект химической реакции при стандартных условиях, используя уравнение (3) и значения ×∆H0f, 298 из табл.2.
∆H0298 = (2×∆H0f, 298 Cr + 3×∆H0f, 298 CO) – (∆H0f, 298 Cr2O3 + 3∙∆H0f, 298 С).
Но ∆H0f, 298 Cr = 0 и ∆H0f, 298 С = 0, поэтому имеем
∆H0298 = 3∙∆H0f, 298 CO – ∆H0f, 298 Cr2O3,
∆H0298 = 3 моль×(–110,5 кДж/моль) – 1 моль∙(–1141,0 кДж/моль) =
= −331,5 кДж + 1141,0 кДж = 809,5 кДж , ∆H0298 > 0, значит реакция эндотермическая.
Определим изменение энтропии реакции при стандартных условиях. Для расчета используем уравнение (4) и значения S0 298 из табл.2.
∆S0298 = (2×S0 298 Cr + 3×S0 298 CO) – (S0 298 Cr2O3 + 3×S0 298 С),
∆S0298 = (2 моль×23,8 Дж/моль∙К + 3 моль×197,4 Дж/моль∙К) – (1 моль
×81,1 Дж/моль∙К + 3 моль×5,7 Дж/моль∙К) = 639,8 – 98,2 = 541,6 Дж/К.
∆S0298 > 0, т. е. реакция сопровождается увеличением энтропии.
Рассчитаем энергию Гиббса химической реакции при Т = 1500К, т.е. величину ∆G1500: ∆G1500 = ∆H0298 –1500×∆S0298 ,
∆G1500 = 809,5 кДж – 1500К×541,6 Дж/К = 809,5 кДж – 1500×541,6 Дж.
Как видно, члены этого уравнения имеют разную размерность, поэтому приводим их к одной размерности 1 Дж = 1∙10-3 кДж и тогда имеем
∆G1500 = 809,5 – 1500×541,6/1000 = 809,5 – 812,4 = –2,9 кДж.
Вывод: ∆G1500 < 0, значит при 1500К данная реакция протекает самопроизвольно, и при этих условиях можно получить металлический хром.
Таблица 2
Термодинамические величины некоторых веществ в стандартных условиях:
∆H0f, 298 кДж/моль, S0 298 Дж/моль∙К, ∆G0f, 298 кДж/моль.
| Вещество | ∆H0f 298 | S0 298 | ∆G0f, 298 | Вещество | ∆H0f, 298 | S0 298 | ∆G0f, 298 |
| Al (т) | +23,3 | HCl(г) | -92,3 | +187,6 | -95,3 | ||
| Al2O3(т) | -1677,0 | +50,9 | -1576,4 | H2S(г) | -20,2 | +205,6 | -33,0 |
| Al2(SO4)3(т) | -3434,0 | +239,2 | -3091,9 | H2Se(г) | +86,0 | +221,0 | +71,0 |
| C(т) | +5,7 | H2Te(г) | +154,0 | +234,0 | +138,0 | ||
| CO(г) | -110,5 | +197,4 | -137,3 | Mg(т) | +32,0 | ||
| CO2(г) | -393,0 | +214,0 | -394,0 | MgO(т) | -601,2 | +26,9 | -569,6 |
| Cl2(г) | +223,0 | MgCO3(т) | -1096 | +65,7 | -1029 | ||
| CaO(т) | -635,1 | +29,7 | -604,2 | MgCl2(т) | -645,0 | +90,0 | -595,0 |
| Ca(OH)2(т) | -966,2 | +83,4 | -896,8 | N2(г) | +191,5 | ||
| CaCO3(т) | -1206,0 | +92,3 | -1128,8 | NH3(г) | -46,2 | +192,5 | -16,6 |
| Cr(т) | +23,8 | NO(г) | +90,4 | +210,6 | +86,7 | ||
| Cr2O3(т) | -1141,0 | +81,1 | -1046,8 | NO2(г) | +33,9 | +240,5 | +51,8 |
| Cu(т) | +33,0 | NH4Сl(т) | -315,4 | +94,5 | -343,6 | ||
| CuO(т) | -156,0 | +43,0 | -127,0 | O2(г) | +205,0 | ||
| Fe(т) | +27,2 | SO2(г) | -296,9 | +248,1 | -300,4 | ||
| Fe2O3(т) | -821,3 | +90,0 | -741,0 | SO3(г) | -395,2 | +256,2 | -370,4 |
| H2(г) | +130,6 | S(т) | +31,9 | ||||
| H2O(г) | -241,8 | +188,7 | -228,8 | Ti(т) | +31,0 | ||
| H2O(ж) | -285,8 | +70,0 | -237,5 | TiCl4(г) | -759,0 | +353,1 | -714,0 |
1.6. Химическая кинетика и химическое равновесие
Химическая кинетика –раздел химии, изучающий скорость и механизм химических реакций. Различают гомогенные и гетерогенные химические реакции.
Гомогенные реакции протекают в объеме одной фазы – в жидком (водном) или газовом растворе. Например, 2СО(г) + О2(г) = 2СО2(г) (8)
Гетерогенные реакции протекают на границе раздела фаз: г – ж, г – т,
т – т и т.д. Например, 2С(т) + О2(г) = 2СО(г) (9)
Скорость химической реакции (υ) – это изменение количества вещества одного из реагентов за единицу времени в единице реакционного пространства. Она зависит от природы реагирующих веществ, температуры (Т), давления (Р), концентрации (С) реагирующих веществ и других факторов. Зависимость υ от С выражается законом действующих масс: При постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам в уравнении реакции.
Например, для гомогенной реакции (8) υ = k∙С2СО ×СО2 , где k – константа скорости химической реакции, которая зависит от природы реагирующих веществ, температуры, присутствия катализатора, но не зависит от концентрации реагирующих веществ; С – молярные концентрации веществ (моль / л). Для гетерогенной реакции (9) υ = k×СО2 , так как концентрации твердых веществ постоянны и приняты равными единице, т.е. СС = 1.
Зависимость скорости химической реакции от температуры выражает правило Вант-Гоффа: при повышении температуры на каждые 10º скорость химической реакции увеличивается примерно в 2 – 4 раза. Математическое выражение закона Вант-Гоффа:

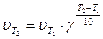 , (10)
, (10)
где υТ1 и υТ2 – скорости реакции при температурах Т1 и Т2; γ - температурный коэффициент скорости химической реакции. Он показывает, во сколько раз увеличивается скорость реакции при повышении температуры на 10º.
По полноте протекания химических процессов различают необратимые и обратимые химические реакции. Необратимые реакции протекают только в одном направлении и завершаются полным превращением исходных веществ в продукты реакции. Обратимые реакции при одной и той же температуре протекают как в прямом, так и в обратном направлении и завершаются установлением в системе химического равновесия. Они не идут до конца, в системе всегда остаются исходные вещества:
N2(г) + 3H2 (г) ⇄ 2NH3(г) (11)
Химическое равновесие – такое состояние химического взаимодействия, при котором скорости прямой и обратной реакций равны между собой, т.е. 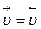 .
.
После наступления состояния равновесия концентрации реагирующих веществ при данных условиях остаются неизменными и называются равновесными концентрациями, обозначаются в квадратных скобках [ ]. Количественной характеристикой химического равновесия является константа химического равновесия К – величина, определяемая соотношением равновесных концентраций продуктов реакции и исходных веществ. Если в соотношение для константы равновесия входят равновесные концентрации, то ее обозначают символом Кс, а если используются парциальные давления газов (Рi) , то – символом Кр. Например, для реакции (11):
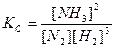 ,
, 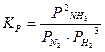
Состояние химического равновесия устанавливается и сохраняется лишь при определенных условиях (температуре, давлении и концентрации реагирующих веществ). При изменении хотя бы одного из этих условий, т.е. при каком-либо внешнем воздействии, равновесие в системе нарушается, и система переходит в новое состояние равновесия. Этот переход называется смещением химического равновесия.
Влияние внешних воздействий (изменение Т, Р или С) на состояние химического равновесия можно предсказать, пользуясь принципом Ле Шателье-Брауна:если на систему, находящуюся в равновесии, оказать внешнее воздействие, то равновесие смещается в том направлении, которое ослабляет эффект внешнего воздействия, т.е на внешнее воздействие система отвечает противодействием. Так увеличение концентрации какого-либо вещества вызовет противодействие системы – стремление уменьшить концентрацию этого вещества, что возможно путем смещения равновесия в направлении, при котором концентрация этого вещества будет уменьшаться.
Повышение Робщ или Рi; приводит к смещению равновесия в сторону протекания той реакции, которая вызывает уменьшение Робщ и Рi и наоборот, понижение Робщ или Pj смещает равновесие в направлении той реакции, которая приводит к увеличению этих параметров.
Повышение температуры вызывает смещение равновесия в направлении протекания той реакции, которая сопровождается поглощением теплоты, т.е. эндотермической (∆Н > 0). Понижение температуры будет вызывать смещение равновесия в сторону экзотермической реакции, сопровождающееся выделением теплоты (∆Н < 0).
Примеры решения задач
Пример 1. Как изменится скорость реакции 2NО(г) + О2(г) ⇄ 2NO2(г), если
одновременно концентрацию NО увеличить в 2 раза, а концентрацию О2 уменьшить в 8 раз?
Р е ш е н и е. 1) Зависимость скорости химической реакции от концентрации реагирующих веществ выражается законом действующих масс, поэтому записываем математическое выражение этого закона для данной реакции в начальный момент времени: 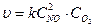
Согласно условию концентрацию NO увеличили в 2 раза, т.е. С'NO=2СNO, а концентрацию О2 уменьшили в 8 раз, т.е. С'o2 = Сo2 /8.
2) Записываем выражение для скорости реакции в конечный момент времени: υ' = k × (С' NO)2 × С'o2 или 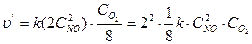
3)  Определяем, как изменяется скорость реакции. Для этого рассматриваем отношение
Определяем, как изменяется скорость реакции. Для этого рассматриваем отношение 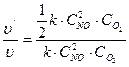 = 1/2
= 1/2
Ответ: при одновременном увеличении концентрации NО в 2 раза и уменьшении концентрации О2 в 8 раз скорость реакции уменьшается в 2 раза.
Пример 2. Определите, во сколько раз изменятся скорости прямой и обратной реакций в системе 2SO2 (г) + О2 (г) ⇄ 2SО3 (г), если объем газовой смеси уменьшить в 3 раза. Каково направление смещения равновесия в этой системе?
Р е ш е н и е. 1) Записываем выражения для скоростей прямой и обратной реакций, используя закон действующих масс: 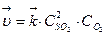 ,
, 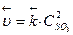
2) Рассматриваем, что происходит в реакционной системе при уменьшении ее объема. Уменьшение объема гомогенной системы в 3 раза приводит к увеличению концентрации каждого из реагирующих веществ также в 3 раза, т.е. математически это записываем в виде: С'so2 = 3С so2 , С'о2 = 3Сo2 и С'so3 = 3С so3.
3) Записываем выражение для скоростей прямой и обратной реакций после изменения объема системы:

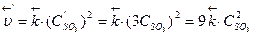
4) Определяем, во сколько раз изменяются скорости прямой и обратной реакций: 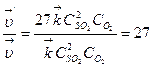 ;
; 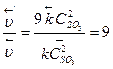
Таким образом, при уменьшении объема газовой смеси в 3 раза скорость прямой реакции увеличится в 27 раз, а скорость обратной реакции – в 9 раз.
5) Устанавливаем направление смещения равновесия в этой системе. В связи с тем, что скорость прямой реакции увеличилась в 27 раз, а обратной – только в 9 раз, равновесие сместится в направлении протекания прямой реакции, т.е. в сторону образования SO3.
Пример 3. Рассчитайте температурный коэффициент скорости химической реакции, если известно, что константа скорости этой реакции при 140°С равна 5,5 × 10-4, а при 185°С – 9,2 × 10-3.
Дано : Т1 =140° С, k1 =5,5 × 10 -4 ; Т2= 185°С, k2 = 9,2∙× 10-3. Найти γ.
Р е ш е н и е. 1) Зависимость скорости химической реакции от температуры описывается правилом Вант-Гоффа в форме: 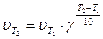
Но для проведения расчетов это уравнение необходимо прологарифмировать, т.е. 

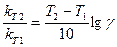
2) Рассчитываем температурный коэффициент скорости этой реакции.
а) вычисляем температуру по абсолютной шкале:
T1 = 140 + 273 = 413 К, Т2 = 185 + 273 = 458 К;
б) рассчитаем численное значение γ:
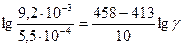 , lg 16,7 = 4,5 lgγ
, lg 16,7 = 4,5 lgγ
отсюда 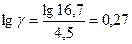 , т.е. lg γ = 0,27, и тогда γ = 1,87.
, т.е. lg γ = 0,27, и тогда γ = 1,87.
Ответ: температурный коэффициент этой реакции равен 1,87.
Пример 4. При синтезе аммиака N2 + ЗН2⇄ 2NНз равновесие установилось  при следующих концентрациях реагирующих веществ (моль/л) [N2 ] = 4; [H2] = 2 и [NH3] = 6. Рассчитайте константу равновесия и исходные концентрации Н2 и N2 .
при следующих концентрациях реагирующих веществ (моль/л) [N2 ] = 4; [H2] = 2 и [NH3] = 6. Рассчитайте константу равновесия и исходные концентрации Н2 и N2 .
Дано: [Н2]=2 моль/л, [N2] = 4 моль/л, [NH3] = 6 моль/л. Найти Кс, Сисх(Н2), Cиcx(N2).
Р е ш е н и е. 1) Записываем выражение для константы равновесия в этой системе и рассчитываем ее значение : 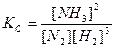 ;
; 


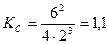
2) Определяем исходные концентрации Н2 и N2.
Для обратимых реакций ни одно из реагирующих веществ не расходуется полностью. Поэтому исходная концентрация вещества А складывается из равновесной концентрации этого вещества [А] и концентрации этого вещества, которая была израсходована на реакцию к моменту установления равновесия (условно обозначим ее X (А) . Таким образом, выражение для исходной концентрации вещества А может быть представлено в виде: Сисх(А) = [А] + Х(А).
а) Для определения Сисх(N2) и Сисх(Н2) обращаемся к уравнению реакции, согласно которому на образование 2 моль NH3 требуется 1 моль N2 и 3 моль Н2. Но поскольку равновесная концентрация NH3 равна 6 моль/л, то при этом было израсходовано 6/2 = 3 моль N2 и 3×(6 / 2) = 9 моль Н2.
б) Рассчитаем Сисх(N2) и Сисх(Н2):
Сисх(Н2) = [Н2] + Х(Н2) = 2 + 9 = 11 моль/л,
Cисх(N2) = [N2] + X(N2) = 4 + 3 = 7 моль/л.
Ответ: константа равновесия реакции равна 1,1. Исходные концентрации Н2 и N2 составляют 11 моль/л и 7 моль/л соответственно.
Пример 5. Установите направление смещения равновесия в системе
2Н2О(г)+ 2О2(г) ⇄ 2Н2О2 (г), ∆ Н = – 483,7 кДж
при понижении температуры и уменьшении общего давления.
Р е ш е н и е. Влияние внешнего воздействия на состояние химического равновесия в системах, в которых протекают обратимые реакции, оценивается с помощью принципа Ле Шателье-Брауна.
1) Рассматриваем влияние температуры на состояние равновесия в данной системе. Термохимическое уравнение реакции показывает, что ∆Н < 0, следовательно, прямая реакция экзотермическая. При понижении температуры согласно принципу Ле Шателье-Брауна система будет стремиться ослабить внешнее воздействие (т.е. повысить Т), а это возможно за счет реакции, протекающей с выделением теплоты, т.е. экзотермической реакции. Следовательно, понижение температуры приведет к смещению равновесия в направлении протекания прямой реакции.
2) Оцениваем влияние изменения давления на состояние равновесия в данной системе. Из уравнения реакции видно, что прямая реакция сопровождается уменьшением объема системы 2V (Н2О) + 2V (О2) ≠ 2V (Н2О2), т.е. ∆V ≠ 0. Поэтому общее давление (Робщ) будет влиять на состояние равновесия в данной системе. Уменьшение Робщ согласно принципу Ле Шателье-Брауна вызовет противодействие системы (увеличение Робщ) за счет смещения равновесия в сторону протекания реакции, сопровождающейся увеличением Робщ, т.е. в сторону обратной реакции. Действительно, обратная реакция приводит к увеличению числа моль газообразных веществ в системе, а это значит, что при протекании обратной реакции Робщ в системе увеличивается.
– Конец работы –
Эта тема принадлежит разделу:
ЗАДАНИЯ И МЕТОДИЧЕСКИЕ УКАЗАНИЯ
Федеральное государственное автономное образовательное учреждение высшего профессионального образования... Российский государственный профессионально педагогический университет... Машиностроительный институт...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Элементы химической термодинамики и термохимии
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов