рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Механика
- /
- Від вільної енергії Гіббса G
Реферат Курсовая Конспект
Від вільної енергії Гіббса G
Від вільної енергії Гіббса G - раздел Механика, В теоретической механике изучается движение тел относительно других тел, представляющие собой физические системы отсчёта ...
 .
.
97 Дру́гий закон термодина́міки — один із основних законів фізики, закон про неспадання ентропії в ізольованій системі. Він накладає обмеження на кількість корисної роботи, яку може здійснити тепловий двигун. На засадничому рівні другий закон термодинаміки визначає напрямок протікання процесів у фізичній системі - від порядку до безпорядку. Існує багато різних формулювань другого закону термодинаміки, загалом еквівалентних між собою. Для системи із сталою температурою існує певна функція стану S — ентропія, яка визначається таким чином, що
1. Адіабатичний перехід із рівноважного стану A в рівноважний стан B можливий лише тоді, коли
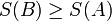 .
.
2. Приріст ентропії у квазістаціонарному процесі дорівнює
 ,
,
де T — температура.
98 Из формулировки второго начала термодинамики по Кельвину следует, что вечный двигатель второго рода — периодически действующий двигатель, совершающий работу за счет охлаждения одного источника теплоты, — невозможен. Для иллюстрации этого положения рассмотрим работу теплового двигателя (исторически второе начало термодинамики и возникло из анализа работы тепловых двигателей).
Принцип действия теплового двигателя приведен на рис. 85. От термостата* с более высокой температурой Т1, называемого нагревателем, за цикл отнимается количество теплоты Q1, а термостату с более низкой температурой Т2, называемому холодильником, за цикл передается количество теплоты Q2, при этом совершается работа А = Q1 – Q2.
*Термодинамическая система, которая может обмениваться теплотой с телами без изменения температуры.
Чтобы термический коэффициент полезного действия теплового двигателя (56.2) был равен 1, необходимо выполнение условия Q2 = 0, т. е. тепловой двигатель должен иметь один источник теплоты, а это невозможно. Tax, французский физик и инженер Н. Л. С. Карно (1796 — 1832) показал, что для работы теплового двигателя необходимо не менее двух источников теплоты с различными температурами, иначе это противоречило бы второму началу термодинамики.
Двигатель второго рода, будь он возможен, был бы практически вечным. Охлаждение, например, воды океанов на 1° дало бы огромную энергию. Масса воды в Мировом океане составляет примерно 1018 т, при охлаждении которой на 1° выделилось бы примерно 1024 Дж теплоты, что эквивалентно полному сжиганию 1014т угля. Железнодорожный состав, нагруженный этим количеством угля, растянулся бы на расстояние 1010км, что приблизительно совпадает с размерами Солнечной системы!
99 Цикл Карно́ — ідеальний термодинамічний цикл.
Цикл складається з чотирьох стадій:
1. Робоча речовина нагрівається за сталої температури (ізотермічний процес).
2. Робоча речовина розширюється за сталої ентропії (адіабатичний процес).
3. Робоча речовина охолоджується за сталої температури (ізотермічний процес).
4. Робоча речовина стискається за сталої ентропії (адіабатичний процес).
Коефіцієнт корисної дії для двигуна, що працює за циклом Карно, залежить лише від різниці температур нагрівача  і охолоджувача
і охолоджувача  .
.
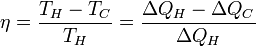
Для збільшення коефіцієнта корисної дії циклу Карно необхідно зробити температуру нагрівача якомога більшою, а температуру охолоджувача — якомога меншою.
Отсюда коэффициент полезного действия тепловой машины Карно равен
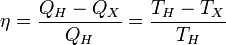 .
.
Из последнего выражения видно, что КПД тепловой машины Карно зависит только от температур нагревателя и холодильника. Кроме того, из него следует, что КПД может составлять 100 % только в том случае, если температура холодильника равна абсолютному нулю. Это невозможно, но не из-за недостижимости абсолютного нуля (этот вопрос решается только третьим началом термодинамики, учитывать которое здесь нет необходимости), а из-за того, что такой цикл или нельзя замкнуть, или он вырождается в совокупность двух совпадающих адиабат и изотерм.
Поэтому максимальный КПД любой тепловой машины будет меньше или равен КПД тепловой машины Карно, работающей при тех же температурах нагревателя и холодильника.
100 Модель идеального газа, используемая в молекулярно-кинетической теории газов, позволяет описывать поведение разреженных реальных газов при достаточно высоких температурах и низких давлениях. При выводе уравнения состояния идеального газа размерами молекул и их взаимодействием друг с другом пренебрегают. Повышение давления приводит к уменьшению среднего расстояния между молекулами, поэтому необходимо учитывать объем молекул и взаимодействие между ними. Taк, в 1 м3 газа при нормальных условиях содержится 2,681025 молекул, занимающих объем примерно 10–4 м3 (радиус молекулы примерно 10–10 м), которым по сравнению с объемом газа (1 м3) можно пренебречь. При давлении 500 МПа (1 атм = 101,3 кПа) объем молекул составит уже половину всего объема газа. Таким образом, при высоких давлениях и низких температурах указанная модель идеального газа непригодна.
При рассмотренииреальных газов — газов, свойства которых зависят от взаимодействия молекул, надо учитыватьсилы межмолекулярного взаимодействия. Они проявляются на расстояниях 10–9 м и быстро убывают при увеличении расстояния между молекулами. Такие силы называютсякороткодействующими.
По мере развития представлений о строении атома и квантовой механики, было выяснено, что между молекулами вещества одновременно действуютсилы притяжения и силы отталкивания. На рис. 88, а приведена качественная зависимость сил межмолекулярного взаимодействия от расстояния r между молекулами, где Fо и Fп — соответственно силы отталкивания и притяжения, a F —их результирующая. Силы отталкивания считаются положительными, а силы взаимного притяжения — отрицательными.
101 Рівняння Ван дер Ваальса — модельне рівняння стану неідеального газу.
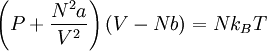 .
.
де P — тиск, V — об'єм, N — число молекул, T — температура, kB — стала Больцмана, a та b — характерні для кожного реального газу сталі, які будуть визначені нижче.
Рівняння ван дер Ваальса описує збільшення тиску при зменшенні об'єму розріджених газів, перенасичену пару, перегріту рідину, різке зменшення стисливості в рідкійфазі. Рівняння ван дер Ваальса визначає також критичну температуру, вище якої газ не зріджується при жодному тиску. Фактично рівняння Ван дер Ваальса описує різницю між станом реального та ідеального газів. Поправки a і b мають більше значення при високих тисках газів. Наприклад, для азоту при тиску порядку 80 атм розрахунки проведені за рівняннями ідеального та реального газів різняться приблизно на 5%, а при тиску порядку 400 атм різниця складає вже 100%.
102 Рідина́ — один з основних агрегатних станів речовини поряд із газом та твердим тілом. Від газу рідина відрізняється тим, що зберігає свій об'єм, а від твердого тіла тим, що не зберігає форму.
Рух рідин та тіл в рідинах вивчає розділ фізики гідродинаміка, будову та фізичні властивості рідин — фізика рідин, складова частина молекулярної фізики.
103 1. Внутрішньою енергією називається сума кінетичної і потенціальної енергії всіх молекул речовини.
Кінетична енергія – це енергія руху, а потенціальна – це енергія взаємодії. Сума кінетичних і потенціальних енергій всіх молекул речовини називається внутрішньою енергією.
Оскільки в ідеальному газі відсутні сили взаємодії, то це означає, що молекулярно-потенціальна енергія у нього відсутня. Таким чином внутрішня енергія ідеального газу представляє собою тільки суму значень кінетичних енергій хаотичного руху всіх його молекул.
Для одного моля внутрішня енергія буде виражена формулою:
А для довільної маси одноатомного газу:
- для двохатомного газу
- для багатоатомного газу
104 Поверхне́вий на́тяг — фізичне явище, суть якого в прагненні рідини скоротити площу своєї поверхні при незмінному об'ємі.
Характеризується коефіцієнтом поверхневого натягу.
Завдяки силам поверхневого натягу краплі рідини приймають максимально близьку до сферичної форми, виникає капілярний ефект, деякі комахи можуть ходити по воді.
Поверхневий натяг виникає як у випадку поверхні розділу між рідиною й газом, так і у випадку поверхні розділу двох різних рідин.
Своєю появою сили поверхневого натягу завдячують поверхневій енергії.
Для зменшення сил поверхневого натягу використовуються поверхнево-активні речовини.
105 Змочування (рос. смачивание, англ. wetting, нім. Benetzung f – дія до властивості змочуваності.
Змочування відбувається, наприклад, при змішуванні корисної копалини, гірської породи тощо з водою, пульпою, реагентом.
Про рідину, яка розпливається тонкою плівкою по твердому тілу, кажуть, що вона змочує дане тверде тіло.
Добре змочування є обов'язковою умовою формування ефективної клейової плівки зв’язуючого на твердій поверхні. Мірою змочуваності твердої поверхні зв’язуючим є крайовий кут змочування θ (див. рис.) - кут, утворений поверхнею розділу двох фаз із поверхнею третьої. Його прийнято відраховувати убік більш полярної (як правило рідкої) фази. Нульове значення крайового кута відповідає повному змочуванню, значення крайового кута θ = 180о відповідає випадку повного незмочування твердої поверхні зв’язуючим.
106 Капілярний ефект - явище підвищення або зниження рівня рідини у капілярах в порівнянні з тим значенням, яке вимагає закон сполучених посудин.
Капілярний ефект виникає через зниження або збільшення тиску рідини під меніском, який утворюється при змочуванні рідиною стінок капіляра.
Величина підвищення або зниження h залежить від радіуса капіляра r, а також від кута змочування рідиною стінок 
 ,
,
де 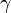 - коефіцієнт поверхневого натягу рідини,
- коефіцієнт поверхневого натягу рідини, 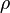 - густина рідини, g - прискорення вільного падіння.
- густина рідини, g - прискорення вільного падіння.
Приклад капілярного ефекту - всмоктування розлитої води серветкою.
107 Кристалічні й аморфні тверді тіла. Внутрішня будова кристалів
Кристалічні тіла мають певну температуру плавлення, незмінну при сталому тиску; в’язкість аморфних речовин під час нагрівання зменшується; вони переходять у рідкий стан, розм’якшуючись поступово.
Кристали характеризуються наявністю значних сил міжмолекулярної взаємодії і зберігають сталим не лише свій об’єм, а й форму. Правильна геометрична форма є істотною зовнішньою ознакою будь-якого кристала в природних умовах. Розглядаючи окремі кристали, можна переконатися, що вони обмежені плоскими, ніби шліфованими гранями у вигляді правильних багатокутників.
Кристали певної речовини можуть мати різну форму, оскільки вона залежить від умов їх утворення.
Монокристали і полікристали. Іноді весь шматок твердої речовини може становити собою один кристал. Такі, наприклад, шматочки цукру, солі, гірського кришталю тощо. Це все окремі кристали, їх називають монокристалами. В інших випадках тіла складаються з безлічі кристалів, які зрослися між собою. Кристалічну будову мають всі метали у твердому стані. Тіло, яке складається з безлічі невпорядковано розміщених дрібних кристалів називають полікристалічним, або полікристалом.
Анізотропія механічних властивостей монокристалів проявляється насамперед у тому, що їх міцність у різних напрямах різна. Монокристали легше руйнуються в одних напрямах, ніж в інших, і саме тому їх злами плоскі.
Полікристалічні тіла є ізотропними, тобто їх фізичні властивості, як і аморфних тіл, у всіх напрямках однакові. Це пояснюється тим, що полікристали складають з величезної кількості невпорядковано орієнтованих дрібних кристаликів, які зрослися між собою.
Широке застосування в сучасній фізиці і техніці дістали монокристали. Майже всі напівпровідникові прилади – це монокристали зі спеціально введеними домішками, які надають їм тих чи інших властивостей.
Внутрішня будова кристалів. Залежність фізичних властивостей кристалів від напряму і правильність їхніх геометричних форм давали підстави для припущення про впорядкованість частинок, які утворюють кристал.
Частинки, з яких складається кристал, при тепловому русі коливаються навколо положень рівноваги, які називають вузлами.
Інші кристали мають складнішу будову. В їхніх вузлах містяться атоми вуглецю. Вузол – це положення рівноваги частинки, яка входить до складу кристала, тобто точка. Відстань між вузлами умовно позначає відстань між центрами атомів і молекул.
Розрізняють чотири типи кристалів (і кристалічних решіток): іонні, атомні, металічні і молекулярні.
Іонні кристали. У вузлах решітки іонних кристалів знаходяться позитивно і негативно заряджені іони. Сили взаємодії між ними в основному електростатичні.
– Конец работы –
Эта тема принадлежит разделу:
В теоретической механике изучается движение тел относительно других тел, представляющие собой физические системы отсчёта
В теоретической механике изучается движение тел относительно других тел представляющие собой физические системы отсч та... Механика позволяет не только описывать но и предсказывать движение тел... Основные абстрактные модели реальных тел...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Від вільної енергії Гіббса G
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов