Основное свойство функций состояния





 | |||
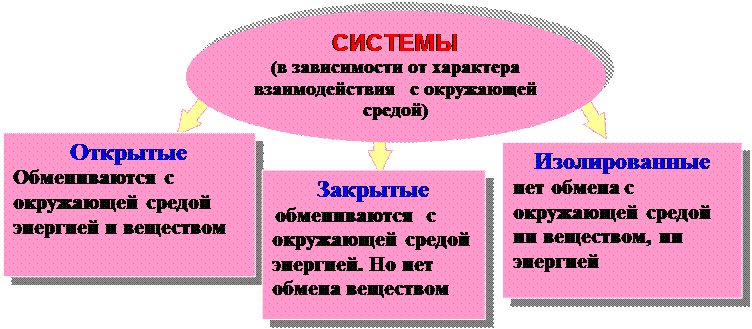 |
открытая колба,
в которой протекает батарея парового теплоизолированная
химическая реакция отопления труба теплоцентрали

 Раствор NaCl в воде Кусочки льда в воде
Раствор NaCl в воде Кусочки льда в воде

Пример:
* кусок сахара в воде Þ идет растворение Þ неравновесная система
** сладкий сироп Þ сахар полностью растворен Þ равновесная система

Основное свойство функций состояния:
Если система переходит из состояния I (P1V1T1) в состояние II(P2V2T2), то изменение значения характеристической функции .
ΔФ не зависит от пути перехода системы из состояния I в состояние II, а определяется только начальным и конечным значением этой функции.
 |
 P1V1T1 P2V2T2
P1V1T1 P2V2T2
Ф1 Ф2 ΔФ = Ф2 – Ф1
Термодинамические переходы:
|
Основные функции состояния:
Основные функции состояния:
 | |||
|
Энтальпия DН – функция состояния (теплосодержание, энергосодержание, включает внутреннюю энергию) .
 |
D Абсолютное значение U и H определить нельзя!
Первое начало (закон) термодинамики:
Q = DU + W
Q – количество теплоты, сообщенной системе;
DU = (U2 – U1 ) – приращение внутренней энергии;
W – суммарная работа, совершенная системой.
! D U - функция состояния системы
! W и Q– не функции состояния системы, то есть их
изменения зависят от пути процесса
Подводимая к системе теплота Q расходуется на приращение ее внутренней энергии DU и совершение системой работы W .
|
Пусть система совершает только работу против сил внешнего давления (работу расширения): W = рDV .
Тогда Q = DU + рDV
Рассмотрим 2 случая:
А) изохорно-изотермический процесс – Т= const, V = const; тогда DV = 0 , работа расширения системы W =0.
Тогда:
QV = DU = U2 – U1. .
!!! Таким образом, при данных условиях - QVчисленно равна изменению функции состояния, т.е. не зависит от пути процесса.
б) изобарно-изотермический процесс - Т= const,
р = const
Т.к. DV =(V2 – V1 ) и DU =( U2 – U1 ) Þ имеем :
Qp = DU + рDV=(U2 – U1) + p(V2 – V1) =(U2+ рV2)–(U1+ рV1)= = H2 – H1 = DH
Qp = H2 – H1 = DH..
!! Таким образом, при данных условиях - QРтоже численно равна изменению функции состояния, т.е. не зависит от пути процесса.
Для идеальных газов уравнение состояния: p∆V = ∆νRT,
∆ν – разница между числом молей газообразных продуктов и исходных веществ.
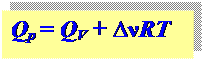 связь между Qp и QV:
связь между Qp и QV:
ТЕРМОХИМИЧЕСКИЕ РАСЧЕТЫ
Термохимия - часть термодинамики, изучающая тепловые эффекты химических процессов.
Тепловой эффект химической реакции или фазового перехода - это теплота, выделяемая или поглащаемая системой при протекании процесса при T=const.
(1841 г. русский ученый Г.И.Гесс)ПРИМЕР
СН4(г) + 2О2(г)= СО2(г) + 2Н2О(г), DrН10 298 = – 802,34 кДж
Эту же реакцию можно провести через 2 стадии:
СН4(г)+ 3/2О2(г)= СО(г) + 2Н2О (г), DrН02 = – 519,33 кДж,
затем Þ СО(г) + 1/2О2 (г)= СО2(г), DrН03 = – 283,01 кДж,
DrН01 = DrН02 + DrН03 = (– 519,33) + (– 283,01) =
КДж
Термохимические уравнения - химические уравнения реакций, в которых указаны агрегатные состояния веществ и тепловые эффекты .
В термохимических уравнениях допустимы дробные стехиометрические коэффициенты.
Если ΔrН< 0 – экзотермическая реакция Þ теплота выделяется.
Если ΔrН > 0 - эндотермическая реакция Þ теплота поглощается.
Знаки Qp и Dr H противоположны: Qp = – Dr H т.к.
Qp рассматривается со стороны окружающей среды, Dr H - со стороны системы.
Если все вещества находятся в стандартном состоянии – стандартная энтальпия реакции Dr H 0
Условия стандартного состояния веществ
Тепловой эффект реакции зависит от температуры
Þ При обозначении указывают температуру:
Dr НT или Dr НоT , например Dr Н900 или Dr Но298
Так как нельзя определить абсолютное значение H или U вещества, для расчетов введено понятие:
Энтальпия образования вещества Df Н.
Энтальпию (теплоту) образования простых веществ Df Н0298 , устойчивых при 298 К и давлении 101 кПа, принимают равной 0.
стандартные энтальпии образования веществпри стандартном состоянии и температуре 298 К сведены в таблицы Df Нo298 .…Только во второй реакции H2SO4 получается из простых, устойчивых веществ, поэтому
Dr Н0298, (2) = Δf Н0298 (H2SO4) = - 811,3 кДж/моль
Следствие из закона Гесса:

Задача Для химической реакции
С(к) + СО2, (г) = 2СО(г)
Рассчитать энтальпию ∆rН0298 и изменение внутренней энергии ∆rU0298 системы при изохорно-изотермическом протекании реакции при 298 К.
Решение
По табличным данным находим:
F Н0298 Ск = 0
Δf Н0298 СО2г = - 393,5 кДж/моль
F Н0298 СОг = - 110,5 кДж/моль
Δr Н0298 = 2Δf Н0298 СОг - Δf Н0298 Ск - Δf Н0298 СО2г =
КДж.
R Н0298 >0 - реакция эндотермическая.
Qp = QV + ∆νRT, QV = - DU, Qp = - DH, ∆ν = 2 - 1= 1
∆r U0298 = ∆r H0298 – ∆νRT =
172,5 – 1. 8,31. 298 .10-3 = 170,0 кДж. (размерность!)
Задача Для химической реакции
(1) С(к) + СО2, (г) = 2СО(г)
рассчитать Δr Н0298 (1) реакции (1), если известно:
С(к) + О2, (г) = 2СО(г) , Δr Н0298 = - 221 кДж
СО(г) + О2, (г) = 2СО2, (г) , Δr Н0298 = - 566,1 кДж.
Решение
С термохимическими уравнениями можно производить алгебраические действия:
уравнение(1) = ½уравнение(2) – ½уравнение(3) Þ
½ (2С(к)+ О2(г)) - ½ (2СО(г) + О2(г)) = ½ ×2СО(г) - ½ ×2СО2(г)
THORN; ∆rH01 = ½ (∆rH02 - ∆rH03) = ½[-221 – (-566,1)] = =172,5 кДж.
****
Любая макросистема состоит из множества микросистем , каждая из которых обладает своими микропараметрами.
Состояние системы - макросостояние - можно охарактеризовать набором микросостояний составляющих ее частиц, т.е. их мгновенными координатами и импульсами.

W – огромное число ( в 1 моле – 6,02•1023 ) частиц, поэтому используют lnW.
Энтропия S – функция состояния системы, которая служит мерой неупорядоченности этой системы .
S = R lnW..
W - термодинамическая вероятность системы,
R - универсальная газовая постоянная; 8,31Дж/моль.К.
Размерность энтропии [S] = [ Дж / моль.К ]
Можно определить абсолютное значение энтропии вещества.
Чем больше число микросостояний Þ тем более вероятна реализация данного макросостояния Þ тем больше энтропия S системы.
Постулат (1911г. М. Планк):
|
Стандартная энтропия – S0 , Дж/моль×К
Энтропия вещества, находящегося в стандартном состоянии. В справочниках - S 0298 при 298 К.
. .Энтропия вещества S растет с ростом температуры:
Т Þ S
. .Энтропия вещества зависит от его фазового состояния Þ скачкообразно увеличивается при переходе из твердого состояния в жидкое и из жидкого состояния в газообразное Þ Газы – «носители энтропии»:
SH2O (г ) > SH2O (ж ) > SH2O (к )
Энтропия вещества растет с увеличением массы
и сложности молекул:
SN2O3 (г ) > SNO2 (г ) > SNO (г )
РАСЧЕТ энтропии реакции Δr S. .
Энтропия – функция состояния системы: DS= S2-S1 ®
Изменение энтропии химической реакции Δr S
рассчитывают на основе следствия из закона Гесса:
|
То есть энтропия химической реакции Δr S равна разности суммарной энтропии продуктов реакции и суммарной энтропии исходных веществ .
Стандартную энтропию реакции при 298К Δr S0298 рассчитывают, используя энтропию образования веществ S0f, 298 – из таблиц : ююΔr S0298 = ∑ S0f ,298 продуктов - ∑ S0f ,298 исх веществ … Пример:Н2,г + N2,г ® 2NH3,г ; Dr S0 = -90 Дж/К < 0 – за счет
уменьшения объема системы, числа молей газов;
Alк + Sbк = AlSbк; Dr S0 = -1,1 Дж/К @ 0 – объем системы практически не изменяется, твердофазная реакция.
: :
Направление химических процессов
Энергия Гиббса Энергия Гельмгольца
В любой системе существуют две по сути противоположных движущих силы самопроизвольного процесса:Однозначным критерием возможности самопроизвольного протекания реакции в прямом направлении в изобарно-изотермических условиях
Является
Уменьшение энергии Гиббса DrGT химической реакции
R GТ = (∆r HТ – T∆r SТ) < 0
Преобладающий фактор ∆r Н < 0 или Т∆r S > 0 определяет знак ∆rGТ и направление процесса в целом .
знак Принципиальная возможность и условия протекания прямого процесса ∆rН ∆rS …Однозначным критерием возможности самопроизвольного протекания процесса в прямом направлении в изохорно-изотермических условиях
Является уменьшение
Энергии Гельмгольца системы F = U – ТS
R FТ = (∆r UТ – T∆r SТ) < 0
Если система изолирована, то самопроизвольно в ней могут протекать процессы только в сторону увеличения энтропии, то есть ∆r SТ > 0, поскольку тепловой эффект в таких системах ∆r UТ =0.
RSТ > 0 – однозначный критерий возможности самопроизвольного протекания процесса в изолированных системах.
! Абсолютное значение G и F определить нельзя,
так как невозможно определить абсолютное значение U.
Для расчетов используют .
Энергии образования веществ ∆f G и∆f F

Энергию Гиббса образования простых веществ Df G0298 устойчивых при 298 К и давлении 100 кПа, принимают равной 0.
Стандартные значения энергии Гиббса образования веществпри стандартном состоянии и температуре 298 К сведены в таблицы Df Go298 . Размерность: [ Df Go ]= [кДж/моль]
Расчет энергии Гиббса
Два способа: 1) как изменение функции состояния системы по разности суммарной энергии… .. Δr GT = ∑Δf GТ продуктов - ∑Δf GT исх веществТΔrS – «связанная энергия», - та часть теплового эффекта, которая бесполезно рассеивается в окружающую среду.
Чем более отрицательно значение DG (больше Aпол ), тем полнее протекает процесс
ОПЫТЫ
1. «ВУЛКАН»
Q = ↑ΔU + ↑A
подводим ув. ув.
разложение
NH4)2Cr2O7 → N2 + 4H2O + Cr2O3 + Q
бихромат ув. объем системы за счет
аммония выделения газов
2. «ФАКЕЛ»
H2SO4 + nH2O → H2SO4 . nH2O + Q , ΔrH < 0
конц. выделяется теплота Þ эфир горит
серная
кислота
3. «ПРИМЕРЗАНИЕ»
NH4NO3 + nH2O → NH4NO3 . nH2O - Q , ΔrH > 0
нитрат поглощается теплота
аммония