рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Образование
- /
- ОСНОВНЫЕ ПОНЯТИЯ О РЕАКЦИОННОЙ СПОСОБНОСТИ ОРГАНИЧЕСКИХ МОЛЕКУЛ
Реферат Курсовая Конспект
ОСНОВНЫЕ ПОНЯТИЯ О РЕАКЦИОННОЙ СПОСОБНОСТИ ОРГАНИЧЕСКИХ МОЛЕКУЛ
ОСНОВНЫЕ ПОНЯТИЯ О РЕАКЦИОННОЙ СПОСОБНОСТИ ОРГАНИЧЕСКИХ МОЛЕКУЛ - раздел Образование, ОСНОВНЫЕ ПОНЯТИЯ О РЕАКЦИОННОЙ СПОСОБНОСТИ ОРГАНИЧЕСКИХ МОЛЕКУЛ Химические Реакции Представляют Собой Процессы, В Которых Происходит Перерасп...
Химические реакции представляют собой процессы, в которых происходит перераспределения электронов. Направление (образование определенных продуктов) и механизм реакции в существенной степени зависят от распределения электронов, вступающих во взаимодействие молекул. Обычно, электронная плотность в молекулах распределена неравномерно, что связанно с целым рядом факторов.
Прежде всего, распределение электронов находится в зависимости от природы связанных атомов и взаимного влияния их друг на друга.
Электронодонорные заместители (ЭД) –заместители, увеличиваю-щие электронную плотность в системе.
Электроноакцепторные заместители (ЭА) – заместители, умень-шающие электронную плотность в системе.
В молекулах осуществляется взаимное влияние не связанных атомов, которое может реализовываться двумя путями. В связи с этим различают два механизма электронных смещений в молекуле: индуктивное влияние (индукционный эффект); мезомерный эффект или эффект сопряжения.
Индуктивный эффект. Понятие индуктивного эффекта было предложено Дж. Льисом. Индукционный эффект состоит в передаче влияния путем последовательной поляризации σ-связей и распространяется вдоль цепи связанных атомов по механизму электростатической индукции.

Характерная особенность индуктивного механизма передачи влияния атомов в молекуле состоит в том, что все смещаемые электронные пары σ-связей остаются на своих первоначальных октетах. Изменения касаются только их положения относительно связанных атомов.
Индукционный эффект оказывает воздействие на все атомы насыщенной цепи в одном направлении.
Направление индуктивного влияния определяют по частичному заряду, который приобретает заместитель (Х), его вызывающий.
  
| Н–СR3 | 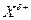  
|
| –I | IH = 0 | +I |
Индукционный эффект атома водорода принят равным нулю. Сила индукционного эффекта зависит от природы заместителя, а именно от его электроноакцепторых или электронодонорных свойств. Для электроно-акцепторых заместителей –I эффект возрастает с электроотрицательностью атома и увеличением числа электроотрицательных атомов.
Электроотрицательность атома галогена возрастает от йода к фтору. Соответственно, усиливается вызываемый ими –I эффект, и увеличиваются кислотные свойства галогензамещенных карбоновых кислот.
Ненасыщенные группы обнаруживают слабый –I эффект. Причина такой зависимости состоит в увеличении электроотрицательности атома углерода, связанного с карбоксилом, и изменением типа его гибридизации от sp3 к sp2 и sp.
Насыщенные алкильные радикалы вызывают слабый +I. При этом +I алкильного радикала возрастает с увеличением длины цепи и степени его разветвленности:
| СH3– < СH3–СH2– < СH3–СH2–СH2– < (СH3)2СН– < (СH3)3С– |
| увеличение +I |
Учитывая указанные взаимоотношения, различные заместители можно объединить в ряд индуктивного влияния относительно атома водорода:
| –NO2, –+NH3, –F > –OR > –NR2 > –C≡CR > –C6H5 > –CH=CR2 > H(IH = 0) |
| ослабление –I |
| О-– > (СH3)3С– > (СH3)2СН– > СH3–СH2– > СH3– > H(IH = 0) |
| ослабление I |
Однако, влияние конкретного заместителя зависит от окружения. Так, в металлорганических соединениях, в силу ярко выраженных электронодонорных свойств металла, электронодонорная пара связи сильно смещена к алкильному радикалу R Ме.
Ме.
Еще одной характерной чертой индукционного эффекта является его быстрое затухание по цепи простых связей. Этим объясняется резкое убывание кислотных свойств в ряду α-, β- и γ-хлормаслянных кислот.
Мезомерный эффект (эффект сопряжения, резонансный эффект). Мезомерный эффект представляет собой механизм передачи взаимного влияния атомов, не связанных друг с другом. Под действием мезомерного эффекта происходит перераспределение электронной плотности в молекуле. Однако, в отличие от индуктивного влияния это перераспределение осуществляется не через систему σ-связей, а главным образом с участием π- и p-электронов (НЭП). Более того, если при индуктивном влиянии σ-электроны частично смещаются относительно исходных положений, то в случае мезомерного эффекта происходит частичное перемещение электронных пар в соседние октеты, вызывающее аналогичное отталкивание взаимодействующих электронных пар вдоль цепи π-связей вплоть до крайнего атома, на котором локализуется избыток электронной плотности.
Подобное перемещение с точки зрения квантовой химии осуществляется в результате перекрывания соответствующих атомных орбиталей. Поэтому мезомерный эффект можно определить как перераспределение электронной плотности путем перекрывания π-электронных облаков с соседними π- и p- или σ-С–Н-электронными облаками и образовании в результате общего π-электронного облака, в составе которого происходят электронные смещения. Условием такого перекрывания является параллельность и пространственная близость соответствующих орбиталей.
Мезомерный эффект может быть неполярным, положительным и отрицательным.
Направление эффекта определяется, как правило, по знаку частичного заряда, появляющегося на заместителе, ответственном за данный М:

| 
| 
|
| +М | М | –М |
| винилхлорид | 1,3-бутадиен | акролеин |
В отличие от индукционного мезомерный эффект передается по системе π-связей практически не ослабевая, стабилизируя молекулу и понижая ее систему. Мезомерный эффект оказывает сильное влияние на строение молекул, их свойства и реакционную способность.
Например:
· +М в винилгалогенидах –I приводит к уменьшению полярности молекулы и снижению ее реакционной способности;
· –М в акролеине –I усиливает полярность этой молекулы по сравнению с аналогичными производными предельного ряда.
Особое положение в ряду различных видов мезомерного эффекта занимает σ, π-сопряжение или сверхсопряжение (гиперконъюгация). Перекрывание является частичным и неэффективным и происходит в силу поляризуемости σ-молекулярной орбитали С–Н-связи:

Оно значительно слабее π, π- и p, π-сопряжения, т. к. перекрываются π-электронные облака двойной связи с облаками соседних σ-С–Н-связей. Следовательно, мезомерный эффект ослабевает при переходе от метильного радикала к более разветвленным радикалам с большей длины цепи:
| СH3– < СH3–СH2– < СH3–СH2–СH2– < (СH3)2СН– < (СH3)3С– |
| убывание +М возрастание +I |
Для объяснения мезомерного эффекта К. Ингольд (1926 – 1933 г.) разработал представление о мезомерии (гр. meso – между, meros – часть), согласно которому распределение электронной плотности в реальной сопряженной молекуле является промежуточным между двумя структурами. Полярные сопряженные системы могут быть изображены при помощи нескольких граничных формул. Первые предложения о своеобразном распределении электронов в сопряженных системах (о мезоформе) принадлежат русскому химику В.А. Измальскому (1915 г.).
– Конец работы –
Эта тема принадлежит разделу:
ОСНОВНЫЕ ПОНЯТИЯ О РЕАКЦИОННОЙ СПОСОБНОСТИ ОРГАНИЧЕСКИХ МОЛЕКУЛ
Концепция теории мезомерии... Делокализацию электронов изображают стрелками...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: ОСНОВНЫЕ ПОНЯТИЯ О РЕАКЦИОННОЙ СПОСОБНОСТИ ОРГАНИЧЕСКИХ МОЛЕКУЛ
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов