рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Образование
- /
- Радикальные реакции
Реферат Курсовая Конспект
Радикальные реакции
Радикальные реакции - раздел Образование, ОСНОВНЫЕ ПОНЯТИЯ О РЕАКЦИОННОЙ СПОСОБНОСТИ ОРГАНИЧЕСКИХ МОЛЕКУЛ · Проходят В Неполярных Растворителях Или В Газовой Фазе; · Ускоряют...
· проходят в неполярных растворителях или в газовой фазе;
· ускоряются под действием света, нагревания или свободными радикалами, образующимися при разложении других веществ;
· замедляются веществами, легко реагирующими со свободными радикалами;
· в кинетическом отношении являются цепными.
Таблица 10 – Типы реакций (примеры)
| Класс | Название реакционного центра | Атакующий реагент | Тип, механизм реакции |
| Алканы Циклоалканы | тетрагональный атом углерода с неполярными связями

| свободный радикал | SR |
| Алкены | тригональный атом углерода (sp2), экранированный с двух сторон π-облаком | электрофильный | AE |
| Алкины | дигональный атом углерода (sp), экранированный цилиндрическим π-облаком | электрофильный | AE |
| Арены | sp2-гибридизованные атомы углерода, экранированные замкнутым π-облаком | электрофильный | SE |
| Спирты, галогенопроизводные углеводородов | тетрагональный (sp3) или тригональный (sp2) электрофильный атом углерода

| нуклеофильный | SN1 или SN2 |
| Альдегиды Кетоны | sp2-гибридизованный электрофильный (электронодефицитный) атом углерода

| нуклеофильный | AN SN (AN®E) |
| Продолжение 10 | |||
| Спирты, фенолы, | ОН-кислотый центр SH-кислотный центр | основание | диссоц-я, образов-е |
| енолы, карбоновые кислоты, сульфоновые кислоты, тиолы | 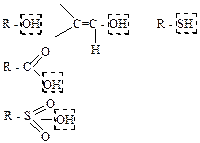
| солей | |
| Галогеналканы Спирты | β-СН-кислотный центр | основание | Е1 или Е2 |
| Альдегиды Кетоны | α-СН-кислотный центр
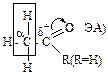
| основание | альд. конден-я, галоформ. реакция |
| Карбоновые кислоты | α-СН-кислотный центр

| основание | галоген-е |
| Амины Амиды кислот | Основный центр

| кислота | образов-е солей |
Символы обозначения механизмов реакций:
· SR – реакция радикального замещения;
· АЕ – реакция электрофильного присоединения;
· AN – реакция нуклеофильного присоединения;
· SE – реакция электрофильного замещения;
· SN1 – мономолекулярная реакция нуклеофильного замещения;
· SN2 – бимолекулярная реакция нуклеофильного замещения;
· Е1 – мономолекулярная реакция элиминирования;
· Е2 – бимолекулярная реакция элиминирования;
· ААС2 – кислотно-катализируемая ацильная бимолекулярная реакция;
· ВАС2 – ацильная бимолекулярная реакция, катализируемая основанием.
– Конец работы –
Эта тема принадлежит разделу:
ОСНОВНЫЕ ПОНЯТИЯ О РЕАКЦИОННОЙ СПОСОБНОСТИ ОРГАНИЧЕСКИХ МОЛЕКУЛ
Концепция теории мезомерии... Делокализацию электронов изображают стрелками...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Радикальные реакции
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов