рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Образование
- /
- Способы получения.
Реферат Курсовая Конспект
Способы получения.
Способы получения. - раздел Образование, ОСНОВНЫЕ ПОНЯТИЯ О РЕАКЦИОННОЙ СПОСОБНОСТИ ОРГАНИЧЕСКИХ МОЛЕКУЛ Промышленные Методы: 1. Получение Из Нефти...
Промышленные методы:
1. Получение из нефти. Алканы С1 – С40 является основной составляющей нефти, где наряду с предельными углеводородами содержатся циклоалканы, ароматические углеводороды, сернистые соединения и другие компоненты. В зависимости от числа атомов углерода алканы, содержащиеся в нефти, подразделяются на следующие группы:
· газообразные алканы состава С1 – С4 содержатся в газовой фракции нефти;
· жидкие алканы от С5 до С10 входят в состав бензиновых фракций, выделены в чистом виде все 5 изомеров гексана, 7 из 9 изомерных гептанов, 16 из 18 изомеров октана и 24 из 35 теоретически возможных изомеров нонана;
· углеводороды состава С11 – С20 содержатся в средних фракциях нефти (180–350 оС), причем содержание нормальных алканов снижается с увеличением молекулярной массы;
· твердые алканы С16 и выше находятся в высококипящих фракциях (350 – 500 оС), их называют в зависимости от состава и температуры плавления парафинами (в основном алканы с Тпл= 45–65 оС) и церезинами (разветвленные алканы).
2. Природный газ. Природный газ состоит на 75% из СН4, 15% СН3–СН3, 5% СН3–СН2–СН3, остальное составляют высшие алканы и другие соединения. Природный газ используют как топливо и сырье для химической промышленности.
3. Гидрогенизация угля. (400–500 оС, 30 МПа, Ф. Бергиус, 1925 г.). катализатор – оксиды и сульфиды молибдена, никеля, кобальта:
С+Н2  СН4
СН4
4. Метод Фишера – Тропша. Каталитическое гидрирование СО и СО2 обычно дает метан. В качестве катализатора используют никель (П. Сабатье, И. Сандеран, 1902 г.):
СO+3Н2  СН4+H2O
СН4+H2O
СO2+4Н2  СН4+2H2O
СН4+2H2O
Процесс каталитического гидрирования СО протекает в зависимости от применяемого катализатора и температуры. В основном образуются низкомолекулярные неразветвленные алканы (Ф. Фишер, Х. Тропш 1913 – 1926 г.):
СO+3Н2  СН4+H2O
СН4+H2O
В последующие годы метод был усовершенствован: изменен катализатор, давление и температура реакции (Ф. Фишер, Х. Пихлер 1936 – 1941 г.). В настоящее время методом Фишера – Тропша могут быть получены моторные топлива и отдельные углеводороды (алканы, циклоалканы, арены). В основе реакции лежит сорбция СО поверхностью катализатора в результате чего образуются карбонилы кобальта. Водород присоединяется к сорбированному оксиду углерода, образуя карбены и метильные радикалы. Карбен может внедрятся по связи Со – СН3, что приводит к росту углеродной цепи:

В качестве побочных продуктов могут образовываться кислородсодержащие соединения (спирты, альдегиды).
5. Воздействие анаэробных бактерий на растительные остатки:
(С6Н10О5)n + H2O  3n СO2 + 3n СН4
3n СO2 + 3n СН4
Лабораторные методы:
6. Реакция металлорганических соединений с водой.Соединения, содержащие связь металл – углерод, в большинстве случаев легко реагируют с водой, образуя углеводороды.
6.1 Гидролиз карбидов:
Al4C3+12 H2O 3 СН4 + 4 Al(OH)3
3 СН4 + 4 Al(OH)3
CaC2, SrC2 и BaC2 в реакции с водой образуют ацетилен, а Fe3C и Ni3C в реакции с кислотами образуют смеси углеводородов.
6.2 Гидролиз алкилмагнийгалогенидов(реактивов Гриньяра):
R–MgHal + H2O R–H + Mg(OH)Hal
R–H + Mg(OH)Hal
R–Hal + 
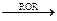 Rδ––δ++MgHal–
Rδ––δ++MgHal–  R–H + Mg(OH)Hal
R–H + Mg(OH)Hal
7. Гидрирование ненасыщенных углеводородов. Реакция присоединения водорода по кратным связям происходит при обычных температурах и давлении на катализаторе, в качестве которого используют металлы с недостроенным d-подуровнем, чаще всего это металлы VIII группы (никель, платина, палладий). Гидрирование осуществляют молекулярным водородом, который активируется катализатором и присоединяется к непредельному соединению:
7.1 гидрирование алкенов:
R–CH=CH–R + Н2  R–CH2–CH2–R
R–CH2–CH2–R
7.2 гидрирование алкадиенов:
R–CH=CH–CH2–CH=CH–R + 2Н2  R–CH2–CH2–CH2–CH2–CH2–R
R–CH2–CH2–CH2–CH2–CH2–R
7.3 гидрирование алкинов:
R–C≡C–R + 2Н2  R–CH2–CH2–R
R–CH2–CH2–R
8. Восстановление галогенпроизводных алканов. Восстановление проводят амальгамой натрия, гидридами металлов, водородом на палладии, а также йодистым водородом:
R–Hal + H2  R–H + HHal
R–H + HHal
R–I + HI R–H + I2
R–H + I2
9. Реакция Вюрца (Ш. Вюрц, 1855 г.):
2R–Hal + 2Na R–R + 2NaHal
R–R + 2NaHal
3R–Hal + 3R1–Hal + 6Na 2R–R + 2R1–R1 + 2R–R1 + 6NaHal
2R–R + 2R1–R1 + 2R–R1 + 6NaHal
Механизм реакции осуществляется с образованием ион – радикалов и алкильных радикалов:
2Rδ+–Halδ– + 2
 2[R
2[R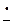 Hal]•–Na+
Hal]•–Na+ 2R• +2Hal– + 2Na+
2R• +2Hal– + 2Na+ R–R + 2NaHal
R–R + 2NaHal
R• +
 RNa
RNa R–R + 2NaHal
R–R + 2NaHal
10. Реакция Вюрца – Гриньяра, катализатор – соли кобальта:
R–Hal + R1–MgHal R–R1 + MgHal2
R–R1 + MgHal2
11. Реакция Кори – Хауса:
R–I + 2Li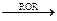 R–Li +LiI
R–Li +LiI
2 R–Li +CuI  R2CuLi + LiI
R2CuLi + LiI
R1–I + R2CuLi 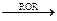 2R1– R + CuI + LiI
2R1– R + CuI + LiI
12. Электролиз солей карбоновых кислот (реакция Кольбе, 1849 г.):

13. Декарбоксилирование солей карбоновых кислот (синтез Дюма):

14. Сплавление гидразонов альдегидов и кетонов со щелочью (реакция Киннера):
R–CH=N–NH2 R–CH– H2 + N2
R–CH– H2 + N2
15. Восстановление карбонильных соединений (метод Клемменсена):

Физические свойства. Алканы представляют собой бесцветные вещества, в обычных условиях газообразные или жидкие, алканы с большим числом углеродных атомов являются твердыми веществами.
Газообразные и твердые алканы не имеют запаха, жидкие имеют характерный бензино-керосиновый запах.
Температура плавления нормальных углеводородов в гомологическом ряду увеличивается медленно. Главным фактором, влияющим на температуру плавления вещества, является плотность упаковки молекулы в кристаллической решетке. Чем симметричнее молекула, тем плотнее ее упаковка в кристалле и тем выше температура плавления (у н-пентана –132°С, у неопентана –20 °С).
Связи С–С и С– Н в молекулах алканов практически неполярны, и, следовательно, единственными силами, участвующими в притяжении молекул друг к другу, являются ван-дер-ваальсовы взаимодействия. В связи с этим алканы имеют низкие температуры кипения по сравнению со многими соединениями с близкой молекулярной массой.
Температура кипения у всех разветвленных алканов ниже, чем у нормальных алканов, и притом тем ниже, чем более разветвлена углеродная цепь молекулы (табл. 19).
Температура плавления оказывается самой высокой у изомеров с максимально разветвленной углеродной цепью. Эти закономерности объясняются следующими причинами:
· превращению жидкости в газ препятствуют ван-дер-ваальсовы силы взаимодействия между атомами отдельных молекул. Поэтому чем больше атомов в молекуле, тем выше температура кипения вещества, следовательно, в гомологическом ряду температура кипения должна равномерно расти. Если сравнить силы взаимодействия молекул н-пентана и неопентана, то ясно, что эти силы больше для молекулы с нормальной цепью углеродных атомов, чем для разветвленных, так как в молекуле неопентана центральный атом вообще выключен из взаимодействия;
· форма разветвленной молекулы стремится к сферической, при этом площадь поверхности соприкосновения уменьшается, что приводит к уменьшению взаимодействия и, следовательно, для преодоления слабых сил взаимодействия требуется меньшая энергия;
· каждая дополнительная группа СН2 вносит довольно постоянный вклад в температуру кипения и плотность и несколько меньший вклад в температуру плавления (рис. 21).

Рисунок 21 – Зависимость температур плавления, кипения и плотности,  от числа атомов углерода (n) для алканов с неразветвленной цепью
от числа атомов углерода (n) для алканов с неразветвленной цепью
Таблица 19 – Физические свойства алканов
| Соединение | 
| Формула | Температура, °С | Плотность, 
| |
| плавления | кипения | ||||
| метан | СН4 | –182,5 | –161,5 | 0,415* | |
| этан | СН3-СН3 | –183,3 | –88,6 | 0,546* | |
| пропан | СН3СН2СН3 | –187,7 | –42,1 | 0,501* | |
| бутан | СН3(СН2)2СН3 | –138,3 | –0,5 | 0,579* | |
| изобутан | СН3СН(СН3)СН3 | –159,6 | –11,7 | 0,557* | |
| пентан | СН3(СН2)3СН3 | –129,7 | 36,1 | 0,626 | |
| изопентан | СН3СН(СН3)СН2СН3 | –159,9 | 27,9 | 0,620 | |
| гексан | СН3(СН2)4СН3 | –95,3 | 68,7 | 0,660 | |
| гептан | СН3(СН2)5СН3 | –90,6 | 96,4 | 0,684 | |
| октан | СН3(СН2)6СН3 | –56,8 | 125,1 | 0,702 | |
| изооктан | СН3С(СН3)2СН2СН(СН3)2 | –107,4 | 99,2 | 0,692 | |
| нонан | СН3(СН2)7СН3 | –53,5 | 150,8 | 0,718 | |
| декан | СН3(СН2)8СН3 | –29,7 | 174,1 | 0,730 | |
| пентадекан | СН3(СН2)13СН3 | 9,9 | 270,6 | 0,768 | |
| эйкозан | СН3(СН2)18СН3 | 36,8 | 342,7 | 0,789** | |
| триконтан | СН3(СН2)28СН3 | 65,8 | 446,4 | 0,810** | |
| гектан | СН3(СН2)98 СН3 | 115,2 | – | – | |
| полиэтилен (ПЭВД) | 30 – 800 тыс. | –(СН2)n– | – | – | 0,918-0,930 |
| полиэтилен (ПЭНД) | 30 – 800 тыс. | –(СН2)n– | – | – | 0,955-0,968 |
*– При температуре кипения. **Для переохлажденной жидкости.
Алканы практически нерастворимы в воде, так как их молекулы малополярны и не взаимодействуют с молекулами воды. Алканы намного легче воды. Жидкие алканы легко смешиваются друг с другом. Они хорошо растворяются в неполярных органических растворителях, таких как бензол, тетрахлорметан (четыреххлористый углерод), диэтиловый эфир и др.
– Конец работы –
Эта тема принадлежит разделу:
ОСНОВНЫЕ ПОНЯТИЯ О РЕАКЦИОННОЙ СПОСОБНОСТИ ОРГАНИЧЕСКИХ МОЛЕКУЛ
Концепция теории мезомерии... Делокализацию электронов изображают стрелками...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Способы получения.
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов