рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Образование
- /
- Химические свойства.
Реферат Курсовая Конспект
Химические свойства.
Химические свойства. - раздел Образование, ОСНОВНЫЕ ПОНЯТИЯ О РЕАКЦИОННОЙ СПОСОБНОСТИ ОРГАНИЧЕСКИХ МОЛЕКУЛ Предельные Углеводороды Являются Наименее Реакционно-Способными Органическими...
Предельные углеводороды являются наименее реакционно-способными органическими соединениями. Их часто называют парафинами (от лат. parum affinis – малое сродство).
1. Реакции замещения атомов водорода при взаимодействии с активными радикалами.
1.1 Галогенирование. Алканы вступают в реакцию со всеми галогенами, скорость реакции галогенирования снижается в ряду:
F > Cl > Br > I
1.1.1 Фтор:
СН4 + 4F2  СF4 + 4HF
СF4 + 4HF
1.1.2 Хлор (катализатор – сера, йод, хлориды олова, меди, сурьмы, алюминия):
СН4 + Cl2  СH3Cl + HCl
СH3Cl + HCl
1.1.3 Бром:
СН4 + Br2  СH3Br + HBr
СH3Br + HBr
1.1.4 Фотохимическое иодированиене удается осуществить вследствие низкой реакционной способности радикала иода.
Механизм реакции галогенирования (SR):
а) инициирование цепи реакции:
Hal2 2Hal•
2Hal•
б) рост цепи:
R–H + Hal• R• + HHal
R• + HHal
R• + Hal2  R–Hal + Hal•
R–Hal + Hal•
в) обрыв цепи:
2Hal•  Hal2
Hal2
R• + R•  R–R
R–R
R• + Hal• R–Hal
R–Hal
Наличие в углеводородной цепи различных углеродных атомов может приводить к образованию различных изомеров. При низких температурах реакция проходит избирательно, которая зависит от двух причин:
· легкость отщепления водорода от углеродного атома, которая изменяется в ряду третичный > вторичный > первичный;
· различная устойчивость алкильных радикалов.

Образующиеся радикалы обладают различной устойчивостью, которая уменьшается в ряду:
третичный > вторичный > первичный > СH3•
Стабильность радикалов определяется делокализацией неспаренных электронов, которая осуществляется за счет сверхсопряжения с С–Н связями. Чем больше таких связей, тем эффективнее делокализация и, следовательно, устойчивее радикал.


Делокализация неспаренного электрона у вторичного атома осуществляется между шестью атомами водорода и одним углеродным атомом.

Устойчивость радикалов определяет направление реакции и реакционную способность во многих реакциях, в которых образуются свободные радикалы.
При высоких температурах соотношение продуктов реакции определяется активностью радикальных частиц, которые эффективно преодолевают энергетический барьер разрыва при сближении с любым атомом водорода. Поэтому, на первый план выступает общая частота столкновений и ориентация молекул.
Процесс хлорирования в присутствии катализаторов, например, хлоридов некоторых металлов, может иметь ионный цепной характер:
Сl:Cl + AlCl3  AlCl4– + Cl+
AlCl4– + Cl+
Cl+ +H–СН3  HCl + СН3+
HCl + СН3+
СН3+ + Сl:Cl  Сl: СН3 + Cl+
Сl: СН3 + Cl+
1.2 Сульфохлорирование и сульфоокисление.:
R–H + H2SO4 (дымящая)  R – SO3H + H2O
R – SO3H + H2O
R–H + SO2 + Cl2  R–SO2Cl + HCl
R–SO2Cl + HCl
R – H + SO2 + O2  R – SO3H
R – SO3H
Соли сульфокислот имеют широкое практическое значение – это анионные ПАВ, моющие средства, эмульгаторы, флотореагенты, присадки к техническим маслам, ингибиторы коррозии.
1.3 Нитрование. В зависимости от условий протекания различают:
· жидкофазное нитрование (7 – 20% азотная кислота, нормальное давление и температура 110 – 140оС), реакция Коновалова (1888 г.):
R–H + HNO3  R–NO2 + H2O
R–NO2 + H2O
· парофазное нитрование (оксидами азота при давлении 2 – 4,5 МПа, температура 150 – 220оС в присутствии кислорода), реакция Титова:
R–CH2–R + HNO3 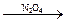 R–NO2 + R–CH2–NO2 + H2O
R–NO2 + R–CH2–NO2 + H2O
Азотная кислота действует как окислитель, а радикал нитрозония амбидентен, поэтому могут образовываться эфиры азотистой кислоты наряду с нитросоединениями, а так же спирты, карбонильные соединения и карбоновые кислоты.
2. Окисление. В присутствии большого избытка кислорода (воздуха) или окислителей (K2CrO4, K2Cr2O7) при высоких температурах алканы сгорают до воды и углекислого газа:
R–H + O2  СO2 + H2O
СO2 + H2O
При ограниченном доступе кислорода возможно образование продуктов неполного сгорания предельных углеводородов:
R–H + O2  СO + H2O
СO + H2O
R–H + O2  С + H2O
С + H2O
В определенных условиях возможно проведение контролируемого окисления при котором происходит расщепление связей С–С при неполном окислении атомов углерода:
· Парофазное окисление используется для получения высших жирных карбоновых кислот. Катализатор – ацетат марганца, температура 150 оС:

· Жидкофазное окисление (А.Н. Башкиров, 1959 г.) в присутствии катализатора, например соединений марганца и температуре 200 оС:
СnН2n+2. СnН2n+1ОН
СnН2n+1ОН
· Твердофазное окисление (окислительная деструкция) характерна для старения олефинов под действием атмосферного кислорода, инициированная облучением, перекисью, нагреванием:
R–R  2R•
2R•
R• + O=O  R–O–O•
R–O–O•
R–O–O• + R–H  R–O–O–H + R•
R–O–O–H + R•
R–O–O–H  R–O• + •O–H
R–O• + •O–H
R–O• + R–H  R–OH + R•
R–OH + R•
R–O• + 2R–H  H2O + 3R•
H2O + 3R•
3. Термические превращения алканов.Различают следующие процессы:
3.1 Пиролиз (от гр. pyr – огонь, lysis – распад, разложение). Включает разложение и деструктивные превращения высокомолекулярных алканов при температурах выше 600 оС:
2СН4 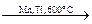 СН2= СН2 + 2Н2
СН2= СН2 + 2Н2
2СН4  СН≡СН + 3Н2
СН≡СН + 3Н2
СН4  С + 2Н2
С + 2Н2
3.2 Крекинг (от англ. cracking – расщепление) в отличие от пиролиза протекает при более низких температурах до 600 оС (В.Г. Шухов и С. Гаврилов, 1890 г.) Существует несколько видов крекинга, наиболее известны:
· термический крекинг;
· каталитический крекинг.
Термический крекинг протекает в основном по цепному радикальному механизму с разрывом С–С и С–Н связей. Так как концентрация радикалов небольшая, основными являются процессы диспропорционирования и β-распада, при температуре 300–350 оС, но наиболее оптимальными являются температуры 450–600 оС.
Каталитический крекинг обеспечивает глубокую переработку нефти при температурах 450–520 оС, катализаторы – алюмосиликаты (Э. Гудри, 1936 г.). Проходят процессы изомеризации, деалкилирования, циклизации и др.
1.5.3. Риформинг (Н.Д. Зелинский, 1902 г.). Катализатор – платина и палладий, алюмоплатиновые, би- и полиметаллические. Основные процессы дегидрогенизация с образованием ароматических соединений.
Широкое распространение получили два варианта риформинга гидроформинг (гидрокрекинг) и платформинг. Основной целью риформинга является получение высококачественных бензина и керосина.
Гидроформинг (350–450 °С, 3–14 МПа, катализатор – оксиды и сульфиды Мо, Ni на алюмосиликатах). Применение водорода обеспечивает гидрирование на катализаторе высокомолекулярных и сернистых соединений с последующим их распадом, гидрирование алкенов.
Платформинг – каталитический крекинг, осуществляемый с помощьюпалладия, платины (менее 1%) на оксиде алюминия и алюмосиликатах. Основные процессы изомеризация, дегидроциклизация, ароматизация.
Термические некаталитические и каталитические превращения алканов осуществляются по следующей схеме:

Применение алканов. Алканы являются не только простым и относительно дешевым топливом, но и исходным сырьем для крупнотоннажного производства. Промышленное использование алканов можно иллюстрировать на примере превращений метана:
4СН4  СН2= СН2 + СН≡СН + 5Н2
СН2= СН2 + СН≡СН + 5Н2
СН4  HCN
HCN 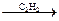 СН2=СН–CN
СН2=СН–CN  синт. волокно нитрон, натур. каучук
синт. волокно нитрон, натур. каучук
СН4 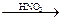 CН3NО2
CН3NО2  NО2С(CН2ОН)3
NО2С(CН2ОН)3  взрывчатые вещества
взрывчатые вещества
СН4  СО + H2
СО + H2  CН3ОН
CН3ОН  CН2О
CН2О  пластмассы
пластмассы
СН4  С + H2 (сажа, резиновая промышленность)
С + H2 (сажа, резиновая промышленность) 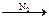 NH3
NH3
СН4 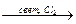 СH2Cl2
СH2Cl2  (СH3)2SiCl2
(СH3)2SiCl2  силиконы
силиконы
СН4  СHCl3 (хлороформ)
СHCl3 (хлороформ)  СCl4
СCl4  ССl2F2 (фреон)
ССl2F2 (фреон)
Высшие жирные и твердые парафины используются как топливо (дизельное), смазочный материал, в виде твердого парафина, озокерита, а их производные, в виде солей карбоновых кислот, как моющие средства.
Экологическое послесловие. Загрязнение алканами атмосферы, почвы, водоемов, подземных вод в значительных масштабах происходит при добыче нефти, газа, транспортировке жидких и газообразных углеводородов, переработке, производстве, применении углеводородов.
Экология почвы.Наиболее крупными источниками загрязнения почвы углеводородами являются нефтеразведка, добыча, транспортировка нефти и нефтепродуктов, при их применении и хранении. Особую опасность представляют загрязнение и нарушение верхнего слоя почв северных территорий, что обусловлено очень медленной скоростью их естественного восстановления.
Экология водоемов, подземных вод.Основные источники загрязнения – добыча нефти, транспортировка нефти и нефтепродуктов, промышленные стоки, технологии очистки промышленных стоков, связанные с закачкой их в подземные горизонты.
Экология атмосферы.Основными источниками загрязнения атмосферы являются: выделение углекислого газа в результате сжигания углеводородов, поступление газообразных углеводородов в атмосферу при газо-, нефтедобыче, разрывах газопроводов, промышленных газообразных выбросах, испарениях при переработке, транспортировке, хранении, заполнении различных емкостей нефтью и нефтепродуктами, сушке лакокрасочных покрытий.
– Конец работы –
Эта тема принадлежит разделу:
ОСНОВНЫЕ ПОНЯТИЯ О РЕАКЦИОННОЙ СПОСОБНОСТИ ОРГАНИЧЕСКИХ МОЛЕКУЛ
Концепция теории мезомерии... Делокализацию электронов изображают стрелками...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Химические свойства.
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов