КООРДИНАЦИОННАЯ ТЕОРИЯ А. ВЕРНЕРА
ОТВЕТ НА 1 ВОПРОС
Комплексные соединения, как правило, образованы двумя составляющими:… Чему равно координационное число? Это зависит от заряда центрального иона, размеров комплексообразователя, природы…Название комплексного аниона содержит суффикс -ат
K2 [PtCl6] - гексахлорплатинат(IV) калия
Na[Cr(H2O)3F2] дифторотриаквохромат (III) натрия
Катионный комплекс:
[Ag(NH3)2]OH – гидроксиддиаммин серебра.
[Ag(NH3)2]ClO4 – перхлоратдиаммин серебра.
Нейтральный комплекс
***Заряд комплексообразователя равняется алгебраической сумме зарядов… Входящие в состав комплексного иона нейтральные молекулы оказывают влияния на заряд. Если вся внутренняя сфера…КООРДИНАЦИОННАЯ ТЕОРИЯ А. ВЕРНЕРА
Строение комплексных соединений
Комплексными соединениями называются соединения, существующие как в… которых является наличие центрального атома, окруженного лигандами. Комплексные соединения можно рассматривать как…. . . . . . . . . . . . . . .
MLn-1 + L ↔ MLn
При этом число связей, образуемых комплексообразователем с лигандами, называется ко-ординационным числом центрального атома. Координационное число (КЧ) может иметь любые целые значения от 2 до 12, однако, наиболее часто встречающиеся координацион-ные числа – 2, 4 и 6. Например, [Ag(NH3)2]+ (КЧ = 2), [Cu(NH3)4]2+ (КЧ = 4), [Ni(NH3)6]2+ (КЧ = 6).
Координационное число, как правило, выше степени окисления центрального атома и часто равно удвоенному заряду иона-комплексообразователя, но не всегда (смотри выше приведенные примеры аммиакатов серебра, меди и никеля). Поэтому реально для каждого лиганда под термином «дентатность» понимают число координационных связей, которые этот лиганд образует с центральным атомом в данном комплексе.
Типы комплексных соединений.
Например, в комплексных соединениях K2[PtCl4] и [Pt(NH3)4]Cl2 внутреннюю сферу составляют комплексные частицы [PtCl4]2- и [Pt(NH3)4]2+, а внешнюю… В зависимости от заряда внутренней сферы комплексы могут быть… Для неэлектролитных комплексов заряд внутренней сферы равен нулю (z = 0) и у них отсутствует внешняя сфера,…Ответ на вопрос номер 3
III. Равновесие в растворах комплексных соединений. Устойчивость
Рассмотрим комплексную соль K4[Fe(CN)6]. Эта соль – сильный электролит, поэтому диссоциирует полностью: K4[Fe(CN)6] → 4K+ + [Fe(CN)6]4-Ответ на вопрос 4
Принцип жёстких и мягких кислот и оснований
Материал из Википедии — свободной энциклопедии Принцип жёстких и мягких кислот и оснований (принцип ЖМКО, принцип ЖМКО Пирсона, англ. HSAB theory) — в химии принцип,…Содержание
[убрать]
· 1 Суть принципа
· 2 Применение в органической химии
· 3 См. также
· 4 Примечания
· 5 Литература
o 5.1 Оригинальные работы
o 5.2 Обзоры
Суть принципа[править | править исходный текст]
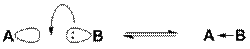

Кислота Льюиса (А) является акцепторомэлектронной пары основания Льюиса (В) и образует с ним ковалентную связь
Принцип ЖМКО касается взаимодействий, рассматриваемых в теории кислот и оснований Льюиса. Согласно этой теории, основание Льюиса B отдаёт электронную пару на образованиековалентной связи с кислотой Льюиса A, которая имеет вакантную орбиталь. Эффективность такого взаимодействия зависит от химического состава и электронного строения реагирующих кислоты и основания. Данные параметры учтены Пирсоном при классификации кислот и оснований на мягкие и жёсткие.
Согласно Пирсону, жёсткие кислоты — это акцепторы электронной пары, обладающие малым размером, большим положительным зарядом, большой электроотрицательностью и низкойполяризуемостью. Молекулярная орбиталь, на которую переходит электронная пара, у жёстких кислот имеет низкую энергию. Соответственно, жёсткие основания — это доноры с тем же свойствами (с большим положительным зарядом, большой электроотрицательность и низкой поляризуемостью). Их орбиталь, с которой отдаётся электронная пара, также имеет низкую энергию. Мягкие кислоты — это кислоты Льюиса с малым положительным зарядом, большим размером, низкой электроотрицательностью и высокой поляризуемостью. Мягкие основания— это основания Льюиса с теми же свойствами. Как у мягких кислот, так и у мягких оснований энергия орбиталей, участвующих в реакции высока. Поскольку такие свойства как заряд, электроотрицательность и поляризуемость изменяются плавно, существует ряд кислот и оснований Льюиса, которые занимают промежуточное положение между жёсткими и мягкими[5].
Жёсткость кислоты или основания означает его склонность образовывать связи преимущественно ионного характера, а мягкость кислоты или основания — склонность к образованию связей ионного характера[6].
| Классификация кислот и оснований в рамках принципа ЖМКО[5][6] | ||
| Жёсткие кислоты | Промежуточные кислоты | Мягкие кислоты |
| H+, Li+, Na+, K+, Mg2+, Ca2+, Al3+, Cr3+, Fe3+, BF3, B(OR)3, AlR3, AlCl3, SO3, BF3, RCO+, CO2, RSO2+ | Cu2+, Fe2+, Zn2+, SO2, R3C+, C6H5+, NO+ | Ag+, Cu+, Hg2+, RS+, I+, Br+, Pb2+, BH3, карбены |
| Жёсткие основания | Промежуточные основания | Мягкие основания |
| OH-, RO-, F-, Cl-, RCOO-, NO3-, NH3, RNH2, H2O, ROH, SO42-, CO32-, R2O, NR2-, NH2- | Br-, C6H5NH2, NO2-, C5H5N | RS-, RSH, I-, H-, R3C-, алкены, C6H6, R3P, (RO)3P |
Помимо условного деления на три типа, можно также проследить зависимость жёсткости или мягкости в рядах отдельных кислот и оснований Льюиса. Например, при движении по группе периодической системы сверху вниз жёсткость оснований уменьшается[7]:
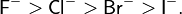
Для изоэлектронных соединений жёсткость возрастает при движении по группе слева направо[7]:
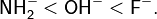
Жёсткость кислот уменьшается при движении по группе сверху вниз[7]:
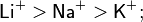

Применение в органической химии[править | править исходный текст]
В органической химии принцип ЖМКО широко применяется для предсказания или объяснения протекания химических реакций.
Например, реакцию между тиоэфиром CH3COSR и алкоголят-ионом RO– можно представить как переход ацильного катиона CH3CO+ (жёсткой кислоты Льюиса) от мягкого основания Льюиса RS– к жёсткому основанию Льюиса RO–. Согласно принципу ЖМКО, аддукт жёсткой кислоты и жёсткого основания более устойчив, поэтому равновесие в реакции сдвинуто вправо[7].

Принцип Пирсона также полезен для предсказания реакционной способности соединений с двумя реакционными центрами, например, енолят-ионов или α,β-ненасыщенных соединений. Последние, например, склонны к реакциям с нуклеофилами по двум положениям, причём преимущественное направление реакции зависит от жёсткости нуклеофила как основания Льюиса[7].

См. также
Ответ на 9 вопрос