рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Образование
- /
- Строение комплексных соединений
Реферат Курсовая Конспект
Строение комплексных соединений
Строение комплексных соединений - раздел Образование, КООРДИНАЦИОННАЯ ТЕОРИЯ А. ВЕРНЕРА При Взаимодействии Частиц Наблюдается Взаимная Координация Частиц, Которую Мо...
При взаимодействии частиц наблюдается взаимная координация частиц, которую можно определить как процесс комплексообразова-ния. Например, процесс гидратации ионов заканчивается образованием аквакомплексов. Реакции комплексообразования сопровождаются переносом электронных пар и приводят к образованию или разрушению соединений высшего порядка, так называемых комплексных (координационных) соединений.Особенностью комплексных соединений является наличие в них координационной связи, возникшей по донорно-акцепторному механизму:

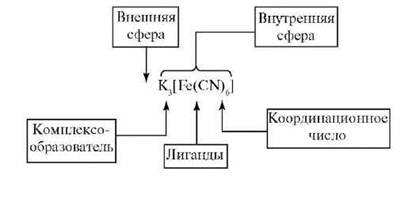
Комплексными соединениями называются соединения, существующие как в кристаллическом состоянии, так и в растворе, особенностью
которых является наличие центрального атома, окруженного лигандами. Комплексные соединения можно рассматривать как сложные соединения высшего порядка, состоящие из простых молекул, способных к самостоятельному существованию в растворе.
 Комплексные (координационные) соединения – это сложные частицы, которые могут самостоятельно существовать как в кристаллическом состоянии, так и в растворе.
Комплексные (координационные) соединения – это сложные частицы, которые могут самостоятельно существовать как в кристаллическом состоянии, так и в растворе.
Особенностью комплексных соединений является наличие центрального атома и связанных с ним ковалентной связью лигандов.
Центральный атом (комплексообразователь) – положительно заряженный ион ме-талла (Мz+), имеющий свободные s-, p-, d- или f-орбитали.
Лиганд (L) – нейтральная молекула или отрицательно заряженный анион (ацидоли-ганд), имеющие неподеленную электронную пару.
При взаимодействии иона-комплексообразователя с лигандом возникает химическая связь, для образования которой лиганд отдает свою неподеленную электронную пару (до-нор электронов), а металл принимает электроны, предоставляя пустую орбиталь (акцептор электронов):
M + :L ↔ M :L
Такой механизм образования химической связи называют донорно-акцепторным, а хими-ческую связь – донорно-акцепторной или координационной (здесь и далее для краткости и простоты восприятия заряды частиц не указаны). Координационная связь является разно-видностью ковалентной связи.
Координационную связь «металл-нейтральный лиганд» принято обозначать стрел-кой, направленной от лиганда к металлу (M L, например, Ag NH3), а связь «металл-ацидолиганд» одинарной чертой (M – L, например, Ag – CN).
Центральный атом может образовывать координационные связи с несколькими ли-гандами, последовательно присоединяя их (ступенчатое комплексообразование):
M + L ↔ ML
ML + L ↔ ML2
– Конец работы –
Эта тема принадлежит разделу:
КООРДИНАЦИОННАЯ ТЕОРИЯ А. ВЕРНЕРА
K PtCl гексахлорплатинат IV калия... Na Cr H O F дифторотриаквохромат III натрия... Катионный комплекс Ag NH OH гидроксиддиаммин серебра...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Строение комплексных соединений
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов