рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Образование
- /
- Фармакопейные статьи
Реферат Курсовая Конспект
Фармакопейные статьи
Фармакопейные статьи - раздел Образование, МЕТОДИЧЕСКИЕ УКАЗАНИЯ Аскорбиновая Кислота(Фс 42-0218-07) (5R...
Аскорбиновая кислота(ФС 42-0218-07)
(5R)-5-[(1S)-1,2-Дигидроксиэтил]-2,3-дигидроксифуран-2(5H)он
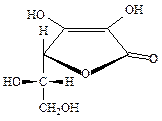
| C6H8O6 | М.м. 176,13 |
Cодержит не менее 99,0 % C6H8O6.
Описание. Белый или почти белый кристаллический порошок или бесцветные кристаллы; на свету постепенно темнеет.
Растворимость. Легко растворим в воде, практически нерастворим в хлороформе.
Подлинность. Инфракрасный спектр субстанции, снятый в диске с калия бромидом, в области от 4000 до 400 см-1 по положению полос поглощения должен соответствовать рисунку спектра аскорбиновой кислоты.
Ультрафиолетовый спектр поглощения 0,001 % раствора субстанции в 0,1 М растворе хлористоводородной кислоты в области от 230 до 300 нм должен иметь максимум при 243 нм.
0,05 г субстанции растворяют в 2 мл воды и прибавляют 0,5 мл раствора серебра нитрата; выпадает темный осадок.
К 1 мл 5 % раствора субстанции прибавляют 2 мл 0,1 М раствора йода;
реактив обесцвечивается.
Прозрачность раствора. Раствор 1 г субстанции в 20 мл воды должен быть прозрачным или выдерживать сравнение с эталоном I.
Цветность раствора. Раствор, полученный в испытании на Прозрачность раствора, должен выдерживать сравнение с эталоном BY7.
Удельное вращение. От +20,5 до +21,5 º (10 % раствор; определяют тотчас после приготовления испытуемого раствора).
рН. От 2,1 до 2,6 (5 % раствор).
Кислота щавелевая. Испытуемый раствор. 0,25 г субстанции растворяют в 5 мл воды, нейтрализуют по лакмусовой бумаге 10 % раствором натрия гидроксида, прибавляют 1 мл 12 % раствора уксусной кислоты и 0,5 мл 7,35 % раствора кальция хлорида.
Раствор сравнения. 0,070 г щавелевой кислоты помещают в мерную колбу вместимостью 500 мл, растворяют в воде, доводят объем раствора водой до метки и перемешивают. К 5 мл полученного раствора прибавляют
1 мл раствора уксусной кислоты разведенной 12 % и 0,5 мл 7,35 % раствора кальция хлорида. Раствор готовят одновременно с испытуемым раствором.
Через 1 ч опалесценция испытуемого раствора не должна превышать опалесценцию раствора сравнения (не более 0,2 %).
Медь. Исходный стандартный раствор меди (10 мкг/мл). Около
0,393 г (точная навеска) меди сульфата (эквивалент около 0,1 г меди) помещают в мерную колбу вместимостью 100 мл, растворяют в воде и доводят объем раствора водой до метки. Непосредственно перед использованием 1 мл полученного раствора помещают в мерную колбу вместимостью 100 мл, доводят объем раствора водой до метки и перемешивают.
Стандартные растворы. 2 мл, 4 мл и 6 мл исходного стандартного раствора меди помещают в мерные колбы вместимостью 100 мл, доводят объемы растворов 0,1 М раствором азотной кислоты до метки и перемешивают. Используют свежеприготовленные растворы.
Испытуемый раствор. Около 2,0 г (точная навеска) субстанции помещают в мерную колбу вместимостью 25 мл, растворяют в 0,1 М растворе азотной кислоты, доводят объем раствора тем же растворителем до метки и перемешивают.
Измеряют поглощение стандартных растворов на атомно-абсорбционном спектрометре при длине волны 324,8 нм, используя в качестве источника излучения лампу с полым медным катодом и воздушно-ацетиленовое пламя. Базовую линию устанавливают по 0,1 М раствору азотной кислоты.
Строят калибровочный график зависимости величины поглощения от концентрации меди (мкг/мл).
В тех же условиях измеряют поглощение испытуемого раствора.
Содержание меди в препарате в процентах (Х) вычисляют по формуле:
С × 25 × 100 С
Х = —————– = –––––––– , где
а × 1000000 а × 400
C – концентрация меди в испытуемом растворе, определенная по калибровочному графику;
А – навеска субстанции в гаммах.
Содержание меди в препарате должно быть не более 0,0005 %.
Железо. Исходный стандартный раствор железа (20 мкг/мл). Около 0,863 г (точная навеска) квасцов железоаммониевых (эквивалент около 0,1 г железа) помещают в мерную колбу вместимостью 500 мл, растворяют в 50 мл 1 М раствора серной кислоты (если необходимо, при нагревании), доводят объем раствора водой до метки и перемешивают. Непосредственно перед использованием 10 мл полученного раствора помещают в мерную колбу вместимостью 100 мл, доводят объем раствора водой до метки и перемешивают.
Стандартные растворы. 1 мл, 2 мл и 3 мл исходного стандартного раствора железа помещают в мерные колбы вместимостью 100 мл, доводят объемы растворов 0,1 М раствором азотной кислоты до метки и перемешивают. Используют свежеприготовленные растворы.
Испытуемый раствор. Около 5,0 г (точная навеска) субстанции помещают в мерную колбу вместимостью 25 мл, растворяют в 0,1 М растворе азотной кислоты, доводят объем раствора тем же растворителем до метки и перемешивают.
Измеряют поглощение растворов сравнения на атомно-абсорбционном спектрометре при длине волны 248,3 нм, используя в качестве источника излучения лампу с полым железным катодом и воздушно-ацетиленовое пламя. Базовую линию устанавливают по 0,1 М раствору азотной кислоты.
Строят калибровочный график зависимости величины поглощения от концентрации железа (мкг/мл).
В тех же условиях измеряют поглощение испытуемого раствора.
Содержание железа в препарате в процентах (Х) вычисляют по формуле:
С × 25 × 100 С
Х = —————– = –––––––– ,
а × 1000000 а × 400
C – концентрация железа в испытуемом растворе, определенная по калибровочному графику;
А – навеска субстанции в гаммах.
Содержание железа в препарате должно быть не более 0,0002 %.
Сульфатная зола и тяжелые металлы. Сульфатная зола из 1 г (точная навеска) субстанции не должна превышать 0,1 % и должна выдерживать испытание на тяжелые металлы (не более 0,001 % в препарате).
Остаточные органические растворители.Всоответствии с требованиями ОФС «Остаточные органические растворители».
Бактериальные эндотоксины. Не более 1,2 ЕЭ на 1 мг субстанции.
Для проведения испытания готовят исходный раствор субстанции (концентрация 50 мг/мл), а затем разводят его не менее чем в 100 раз.
Испытание проводят для субстанции, предназначенной для приготовления инъекционных лекарственных форм.
Микробиологическая чистота.В соответствии с требованиями ОФС «Микробиологическая чистота».
Количественное определение. Около 0,1 г (точная навеска) субстанции растворяют в 20 мл воды, прибавляют 0,5 мл 1 % раствора калия йодида, 1 мл 2 % раствора хлористоводородной кислоты и титруют 0,0167 М раствором калия йодата до появления стойкого слабо-синего окрашивания (индикатор - 2 мл раствора крахмала).
Параллельно проводят контрольный опыт.
1 мл 0,0167 М раствора калия йодата соответствует 8,806 мг C6C8O6.
Хранение. В сухом защищенном от света месте, в хорошо укупоренной неметаллической таре.
Ацетилсалициловая кислота(ФС 42-0220-07)
Кислота 2-ацетоксибензойная
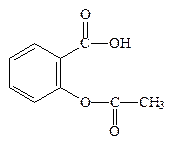
С9Н8O4М.м. 180,15
Cодержит не менее 99,5 % С9Н8O4 в пересчете на сухое вещество.
Описание. Бесцветные кристаллы или белый кристаллический порошок, без запаха или со слабым запахом.
Растворимость. Легко растворим в спирте 96 %, растворим в хлороформе, в растворах щелочей едких и углекислых, мало растворим в воде.
Подлинность. Инфракрасный спектр субстанции, снятый в диске с калия бромидом, в области от 4000 до 400 см-1, по положению полос поглощения должен соответствовать рисунку спектра ацетилсалициловой кислоты .
Ультрафиолетовый спектр поглощения 0,007 % раствора субстанции в хлороформе в области от 260 до 350 нм должен иметь максимум при
278 нм.
Ультрафиолетовый спектр поглощения 0,001 % раствора субстанции в 0,1 М растворе серной кислоты в области от 220 до 350 нм должен иметь максимумы при 228 нм и 276 нм и минимум 257 нм.
0,5 г субстанции кипятят в течение 3 мин с 5 мл раствора натрия гидроксида, охлаждают, нейтрализуют серной кислотой разведенной 16 %; образуется белый кристаллический осадок. К осадку прибавляют 0,1 мл раствора железа(III) хлорида; появляется фиолетовое окрашивание.
К 0,2 г субстанции прибавляют 0,5 мл серной кислоты концентрированной, перемешивают, прибавляют 0,1 мл воды; появляется запах уксусной кислоты. Прибавляют 0,1 мл формалина; появляется розовое окрашивание.
Прозрачность раствора. Раствор 2 г субстанции в 20 мл спирта 96 % должен быть прозрачным или выдерживать сравнение с эталоном I.
Цветность раствора. Раствор, полученный в испытании на Прозрачность раствора, должен быть бесцветным или выдерживать сравнение с эталоном В9.
Вещества, нерастворимые в растворе натрия карбоната. 0,5 г субстанции растворяют в 10 мл теплого 10 % раствора натрия карбоната. Полученный раствор должен быть прозрачным или выдерживать сравнение с эталоном I.
Салициловая кислота свободная. Испытуемый раствор. Около 0,3 г субстанции (точная навеска) помещают в мерную колбу вместимостью 25 мл, растворяют в 10 мл спирта 96 %, прибавляют 1 мл 0,2 % раствора квасцов железоаммониевых, доводят объем раствора водой до метки и перемешивают.
Стандартный раствор. Около 0,06 г (точная навеска) салициловой кислоты (стандарт ВP или аналогичного качества) помещают в мерную колбу вместимостью 100 мл, растворяют в спирте 96 %, доводят объем раствора спиртом 96 % до метки и перемешивают. К 1 мл полученного раствора прибавляют 39 мл спирта 96 %, 4 мл 0,2 % раствора железоаммониевых квасцов и количественно разбавляют водой до 100 мл.
Используют свежеприготовленные растворы.
Измеряют оптическую плотность испытуемого и стандартного раствора на спектрофотометре в максимуме поглощения при длине волны 520 нм в кювете с толщиной слоя 50 мм.
Содержание салициловой кислоты свободной в субстанции в процентах (Х) вычисляют по формуле:
А1 × а0 × 0,25
Х = ————————,
А0 × a1
где: А1 - оптическая плотность испытуемого раствора;
А0 - оптическая плотность стандартного раствора;
а1 - навеска субстанции, в граммах;
а0 - навеска салициловой кислоты стандарта, в граммах.
Содержание салициловой кислоты свободной должно быть не более 0,05 %.
Посторонние примеси. Испытуемый раствор. 0,1 г субстанции помещают в мерную колбу вместимостью 10 мл, растворяют в ацетонитриле и доводят объем раствора ацетонитрилом до метки.
Раствор сравнения. 0,05 г салициловой кислоты помещают в мерную колбу вместимостью 50 мл, растворяют в подвижной фазе (ПФ) и доводят объем раствора ПФ до метки. 1 мл полученного раствора помещают в мерную колбу вместимостью 100 мл и доводят объем раствора ПФ до метки.
Раствор для проверки пригодности системы. 0,01 г салициловой кислоты (стандарт ВP или аналогичного качества) растворяют в 10 мл ПФ. 1 мл полученного раствора помещают в мерную колбу вместимостью 100 мл, прибавляют 0,2 мл испытуемого раствора и доводят объем раствора ПФ до метки.
Используют свежеприготовленные растворы.
Хроматографические условия
| Колонка | - | 15 × 0,46 см с октадецилсилил силикагелем (С18), 5 мкм; |
| ПФ | - | фосфорная кислота концентрированная – ацетонитрил – вода (1:200:300); |
| Скорость потока | - | 1,0 мл/мин; |
| Детектор | - | спектрофотометрический, 237 нм. |
| Объем пробы | - | 10 мкл. |
Хроматографируют раствор для проверки пригодности хроматографической системы. Разрешение меду пиками ацетилсалициловой кислоты и салициловой кислоты должно быть не менее 6.
Хроматографируют испытуемый раствор и раствор сравнения. Время регистрации хроматограммы испытуемого раствора должно не менее чем в 7 раз превышать время удерживания пика ацетилсалициловой кислоты.
На хроматограмме испытуемого раствора площадь пика любой примеси должна быть не более площади пика на хроматограмме раствора сравнения (не более 0,1 %); суммарная площадь пиков примесей должна быть не более двух с половиной кратной площади пика на хроматограмме раствора сравнения (не более 0,25 %).
Хлориды. 1,5 г субстанции взбалтывают в течение 2 мин с 30 мл воды и фильтруют. 10 мл фильтрата должны выдерживать испытание на хлориды (не более 0,004 % в субстанции).
Сульфаты. 10 мл фильтрата, полученного в испытании на Хлориды, должны выдерживать испытание на сульфаты (не более 0,02 % в субстанции).
Потеря в массе при высушивании. Около 1 г субстанции (точная навеска) сушат при температуре от 80 до 85 ºС до постоянной массы. Потеря в массе не должна превышать 0,5 %.
Сульфатная зола и тяжелые металлы. Сульфатная зола из 1 г субстанции (точная навеска) не должна превышать 0,1 % и должна выдерживать испытание на тяжелые металлы (не более 0,001 % в субстанции).
Остаточные органические растворители.Всоответствии с требованиями ОФС «Остаточные органические растворители»
Микробиологическая чистота.В соответствии с требованиями ОФС «Микробиологическая чистота».
Количественное определение. Около 0,5 г субстанции (точная навеска) растворяют в 10 мл нейтрализованного по фенолфталеину и охлажденного до температуры 8-10 ºС спирта 96 % и титруют 0,1 М раствором натрия гидроксида до появления розового окрашивания (индикатор - 0,1 мл 1 % раствора фенолфталеина).
1 мл 0,1 М раствора натрия гидроксида соответствует 18,02 мг С9Н8O4.
Хранение. В сухом месте.
Ацикловир(ФС 42-0221-07)
2-Амино-9-[(2-гидроксиэтокси)метил]-1,9-дигидро-6H-пурин-6-он
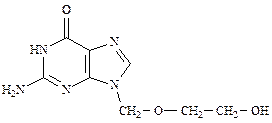
| C8H11N5O3 | М.м. 225,21 |
Cодержит не менее 98,5 % и не более 101,0 % C8H11N5O3 в пересчете на безводное вещество.
Описание. Белый или почти белый кристаллический порошок.
Растворимость. Легко растворим в диметилсульфоксиде, мало растворим в воде, очень мало растворим в спирте 96 %, практически нерастворим в хлороформе.
Подлинность. Инфракрасный спектр субстанции, снятый в диске с калия бромидом, в области от 4000 до 400 см-1 по положению полос поглощения должен соответствовать спектру стандартного образца ацикловира.
Прозрачность раствора. Раствор 0,2 г субстанции в 20 мл 0,1 М раствора натрия гидроксида должен быть прозрачным или выдерживать сравнение с эталоном I.
Цветность раствора. Раствор, полученный в испытании Прозрачность должен быть бесцветным или выдерживать сравнение с эталоном Y7.
Посторонние примеси.
Метод ТСХ.
Испытуемый раствор. 0,1 г субстанции растворяют в диметилсульфоксиде и разбавляют диметилсульфоксидом до 10 мл.
Раствор сравнения. 0,01 г стандартного образца примеси А ацикловира (2-[(2-амино-6-оксо-1,6-дигидро-9H-пурин-9-ил)метокси]этилацетат, стан-дарт ВР или аналогичного качества) растворяют в диметилсульфоксиде и разбавляют диметилсульфоксидом до 20 мл. 1 мл полученного раствора разбавляют диметилсульфоксидом до 10 мл.
10 мкл (100 мкг) испытуемого раствора и 10 мкл (0,5 мкг) раствора сравнения наносят на пластинку со слоем силикагеля F 254. Пластинку с нанесенными пробами сушат в токе теплого воздуха, помещают в камеру со смесью растворителей раствор аммиака концентрированный 25 % - метанол - метиленхлорид (1:10:40) и хроматографируют восходящим методом. Когда фронт подвижной фазы дойдет до конца пластинки, ее вынимают из камеры, сушат на воздухе и просматривают в УФ свете при 254 нм.
Пятно посторонней примеси на хроматограмме испытуемого раствора, находящееся на уровне пятна примеси А, по совокупности величины и интенсивности поглощения не должно превышать пятно на хроматограмме раствора сравнения (не более 0,5 %).
Метод ВЭЖХ.
Подвижная фаза (ПФ). 6,0 г натрия фосфата однозамещенного и 1,0 г натрия декансульфоната растворяют в 900 мл воды, доводят рН раствора до 3,0 ± 0,1 ортофосфорной кислотой концентрированной, прибавляют 40 мл ацетонитрила и разбавляют водой до 1000 мл.
Испытуемый раствор. 0,05 г субстанции растворяют в 10 мл смеси уксусная кислота ледяная – вода (1:4) и разбавляют ПФ до 100 мл.
Раствор сравнения А. 1 мл испытуемого раствора помещают в мерную колбу вместимостью 200 мл и доводят объем раствора ПФ до метки.
Раствор сравнения Б. 0,007 г (точная навеска) гуанина (2-амино-1,7-дигидро-6Н-пурин-6-он; стандарт ВР или аналогичного качества) помещают в мерную колбу вместимостью 100 мл, растворяют в 0,1 М растворе натрия гидроксида и доводят объем раствора 0,1 М раствором натрия гидроксида до метки (раствор 1). 1 мл раствора 1 помещают в мерную колбу вместимостью 20 мл и доводят объем раствора ПФ до метки.
Раствор для проверки пригодности системы. 0,01 г стандартного образца примеси А ацикловира (2-[(2-амино-6-оксо-1,6-дигидро-9H-пурин-9-ил)метокси]этилацетат; стандарт ВР или аналогичного качества) растворяют в смеси уксусная кислота ледяная – вода (1:4), прибавляют 4 мл испытуемого раствора и разбавляют смесью уксусная кислота ледяная – вода (1:4) до 10 мл. 1 мл полученного раствора разбавляют ПФ до 10 мл.
Хроматографические условия
| Колонка | - | 10 × 0,46 см с октадецилсилил силикагелем (С18), 3 мкм; |
| Скорость потока | - | 2,0 мл/мин; |
| Детектор | - | спектрофотометрический, 254 нм. |
| Объем пробы | - | 20 мкл. |
Хроматографируют раствор для проверки пригодности хроматографической системы. Разрешение (R) между пиком ацикловира и пиком примеси А должно быть не менее 1,5. Число теоретических тарелок для пика примеси А должно быть не менее 1500.
Хроматографируют раствор сравнения А не менее 5 раз. Относительное стандартное отклонения площади пика ацикловира не должно превышать 5 %.
Хроматографируют раствор сравнения А, раствор сравнения Б и испытуемый раствор. Время регистрации хроматограммы испытуемого раствора должно не менее чем в 7 раз превышать время удерживания основного пика.
Площадь пика гуанина на хроматограмме испытуемого раствора должна быть не более площади пика на хроматограмме раствора сравнения Б (не более 0,7 %); площадь пика любой другой посторонней примеси на хроматограмме испытуемого раствора должна быть не более площади пика на хроматограмме раствора сравнения А (не более 0,5 %); сумма площадей всех пиков посторонних неидентифицированных примесей должна быть не более двукратной площади пика на хроматограмме раствора сравнения А (не более 1 %).
Сульфаты. 0,5 г субстанции взбалтывают с 10 мл воды и фильтруют. Полученный раствор должен выдерживать испытание на сульфаты (не более 0,02 % в субстанции).
Вода. Не более 6,0 %. Определение проводят методом К.Фишера из точной навески около 0,5 г субстанции.
Сульфатная зола и тяжелые металлы. Сульфатная зола из 1 г (точная навеска) субстанции не должна превышать 0,1 % и должна выдерживать испытание на тяжелые металлы (не более 0,001 % в субстанции).
Остаточные органические растворители.Всоответствии с требованиями ОФС «Остаточные органические растворители».
Микробиологическая чистота.В соответствии с требованиями ОФС «Микробиологическая чистота».
Количественное определение. Около 0,15 г субстанции (точная навеска) растворяют в 60 мл уксусной кислоты ледяной и титруют 0,1 М раствором хлорной кислоты. Конечную точку титрования определяют потенциометрически.
Параллельно проводят контрольный опыт.
1 мл 0,1 М раствора хлорной кислоты соответствует 22,52 мг C8H11N5O3.
Хранение. Список Б. В сухом, защищенном от света месте.
Бромгексина гидрохлорид(ФС 42-0223-07)
N-(2-Амино-3,5-дибромбензил)-N-метилциклогексиламина гидрохлорид
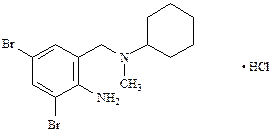
| C14H20Br2N2 · HCl | М.м. 412,6 |
Cодержит не менее 98,5 % и не более 101,5 % C14H20Br2N2 . HCl в пересчете на сухое вещество.
Описание. Белый или почти белый кристаллический порошок.
Растворимость. Очень мало растворим в воде, мало растворим в спирте 96 % и метиленхлориде.
Подлинность. Инфракрасный спектр субстанции, снятый в диске с калия бромидом, в области от 4000 до 400 см-1 по положению полос поглощения должен соответствовать спектру стандартного образца бромгексина гидрохлорида. Если в спектрах обнаруживаются различия, субстанция и стандартный образец раздельно растворяют в метаноле, упаривают досуха и вновь снимают спектры полученных образцов.
0,025 г субстанции растворяют в смеси 0,6 мл серной кислоты разведенной 16 % и 50 мл воды, прибавляют 2 мл метиленхлорида, 5 мл раствора хлорамина 5 %, встряхивают и оставляют до разделения слоев; в нижнем слое появляется коричнево-желтое окрашивание.
0,001 г субстанции растворяют в 3 мл 0,1 М раствора хлористоводородной кислоты. Полученный раствор дает характерную реакцию на амины первичные ароматические.
0,02 г субстанции растворяют в 1 мл метанола, прибавляют 1 мл воды и перемешивают. Полученный раствор дает характерную реакцию на хлориды.
Прозрачность раствора. Раствор 0,3 г субстанции в 10 мл метанола должен быть прозрачным или выдерживать сравнение с эталоном I.
Цветность раствора. Раствор, полученный в испытании на Прозрачность раствора, должен выдерживать сравнение с эталоном Y6.
Посторонние примеси.Определение проводят методом ВЭЖХ.
Буферный раствор с рН 7,0. 0,5 мл фосфорной кислоты концентрированной растворяют в 950 мл воды, доводят рН раствора триэтиламином до значения 7,0, доводят объем раствора водой до 1000 мл и перемешивают.
Испытуемый раствор. 0,05 г субстанции растворяют в 10 мл метанола.
Раствор сравнения. 1 мл испытуемого раствора помещают в мерную колбу вместимостью 100 мл, доводят объем раствора метанолом до метки и перемешивают. 1 мл полученного раствора переносят в мерную колбу вместимостью 10 мл, доводят объем раствора метанолом до метки и перемешивают.
Раствор для проверки пригодности системы. 0,005 г стандартного образца примеси С бромгексина [N-(2-аминобензил)-N-метилциклогекс-амин; стандарт ВР или аналогичного качества] растворяют в 9 мл метанола, прибавляют 1 мл испытуемого раствора и перемешивают.
Хроматографические условия
Колонка - 12 * 0,46 см с октадецилсилил силикагелем (С18), 3 мкм
ПФ - ацетонитрил – буферный раствор с рН 7,0 (80:20);
Скорость потока - 1,0 мл/мин;
Детектор - спектрофотометрический, 248 нм;
Объем пробы - 10 мкл.
Хроматографируют раствор для проверки пригодности системы. Относительные времена удерживания компонентов: примесь С бромгексина - около 0,4; бромгексин – 1,00 (около 11 мин). Разрешение (R) между пиками должно быть не менее 12,0.
Хроматографируют раствор сравнения и испытуемый раствор. Время регистрации хроматограммы испытуемого раствора должно не менее чем в 2,5 раза превышать время удерживания основного пика.
Площадь пика любой одной посторонней примеси на хроматограмме испытуемого раствора не должна более чем в 2 раза превышать площадь пика на хроматограмме раствора сравнения (не более 0,2 %); площадь пика любой другой посторонней примеси на хроматограмме испытуемого раствора должна быть не более площади пика на хроматограмме раствора сравнения (не более 0,1 %); сумма площадей всех пиков посторонних примесей не должна более чем в 3 раза превышать площадь пика на хроматограмме раствора сравнения (не более 0,3 %). Не учитывают пики, площадь которых составляет менее половины площади пика на хроматограмме раствора сравнения (0,05 %).
Потеря в массе при высушивании. Около 1 г (точная навеска) субстанции сушат при температуре от 100 до 105 ºС до постоянной массы. Потеря в массе не должна превышать 1,0 %.
Сульфатная зола и тяжелые металлы. Сульфатная зола из 1 г (точная навеска) субстанции не должна превышать 0,1 % и должна выдерживать испытание на тяжелые металлы (не более 0,001 % в субстанции).
Остаточные органические растворители.Всоответствии с требованиями ОФС «Остаточные органические растворители».
Микробиологическая чистота.В соответствии с требованиями ОФС «Микробиологическая чистота».
Количественное определение. Около 0,3 г (точная навеска) субстанции растворяют в 70 мл спирта 96 %, прибавляют 1 мл 0,1 М раствора хлористоводородной кислоты и титруют потенциометрически 0,1 М раствором натрия гидроксида. Расход титранта определяют по разности объемов титранта между двумя точками перегиба на кривой титрования.
1 мл 0,1 М раствора натрия гидроксида соответствует 41,26 мг
C14H20Br2N2 . HCl.
Хранение. Список Б. В сухом защищенном от света месте.
– Конец работы –
Эта тема принадлежит разделу:
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
профессионального образования Сибирский государственный медицинский университет Федерального агентства по здравоохранению... и социальному развитию ГБОУ ВПО СибГМУ Росздрава... Кафедра фармацевтической химии...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Фармакопейные статьи
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов