Ксантинола никотинат - раздел Образование, МЕТОДИЧЕСКИЕ УКАЗАНИЯ (Фс 42-2596-94 Взамен Фс 41-2596-88)
7 - [2-Г...
(ФС 42-2596-94 Взамен ФС 41-2596-88)
7 - [2-Гидрокси –3- (N - метил - ß гидроксиэтиламино) пропил]
теофиллина никотинат
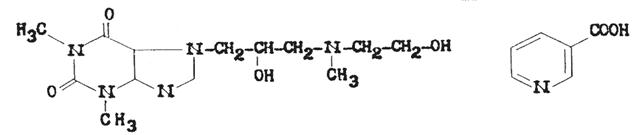
С13Н21N5О4´С6Н5NО2 М.м.434,5
Препарат содержит не менее 98,5% С13Н21 N5О4´С6Н5NО2 в пересчете на сухое вещество.
Описание. Белый кристаллический порошок без запаха.
Растворимость. Легко растворим в воде, очень мало растворим в спирте 95%, практически нерастворим в хлороформе и эфире (ГФ XI, вып.1, с. 175).
Подлинность. Ультрафиолетовый спектр 0,0025% раствора препарата в 0,1 М растворе кислоты хлористоводородной в области от 250 до 275 нм имеет плечо в интервале от 252 до 264 нм и максимум поглощения при 267 нм ± 2 нм.
0,25 г препарата растворяют в I мл воды, прибавляют 4 мл спирта метилового и перемешивают. На линию старта пластинки Силуфол УФ 254 размером 8 х 15 см наносят 0,01 мл (500 мкг) раствора препарата и рядом 0,01 мл (140 мкг) раствора стандартного образца вещества свидетеля (СОВС) кислоты никотиновой. Пластинку с нанесенными пробами сушат на воздухе в течение 5 мин, помещают в камеру со смесью спирт н-бутиловый - спирт метиловый - аммиака раствор концентрированный - хлороформ (8:9:6:14) и хроматографируют восходящим методом. Когда фронт растворителя дойдет до конца пластинки, ее вынимают из камеры, сушат на воздухе в течение 10 мин и просматривают в ультрафиолетовом свете при длине волны 254 нм. На хроматограмме анализируемого образца наблюдаются пятно основания препарата и пятно кислоты никотиновой, расположенное на уровне пятна СОВС.
Примечание. I. Приготовление раствора СОВС кислоты никотиновой. 0,07г кислоты никотиновой (ФС 42-2357-94) растворяют в 2 мл горячей воды, прибавляют 3 мл спирта 95 % и перемешивают.
Раствор используют свежеприготовленный.
2. Перед хроматографированием камеру следует насыщать парами подвижной фазы не менее 3 ч.
0,05 г препарата помещают в фарфоровую чашку, прибавляют 0,5 мл пергидроля, 0,5 мл кислоты хлористоводородной разведенной и выпаривают на водяной бане досуха.
Температура плавления. От 180 до 186°С (ГФ XI, вып.1, с. 16).
Прозрачность раствора. Раствор 0,5 г препарата в 10 мл воды должен быть прозрачным или выдерживать сравнение с эталонным раствором I (ГФXI, вып.1, с. 198).
Цветность раствора. Раствор 0,75 г препарата в 5 мл воды должен быть бесцветным (ГФ XI, вып.1, с. 194).
рН. От 5,8 до 6,8 (5% раствор, потенциометрически; ГФ XI, вып.1, с. 113).
Теофиллин. На линию старта пластинки Силуфол УФ 254 размером 8 х 15 см наносят 0,01 мл (500 мкг) раствора препарата, используемого для хроматографической пробы в разделе "Подлинность", и рядом 0,01 мл (2,5 мкг) раствора стандартного образца вещества свидетеля (СОВС) теофиллина. Пластинку с нанесенными пробами сушат на воздухе в течение 5 мин, помещают в камеру со смесью спирт н-бутиловый - спирт метиловый - аммиака раствор концентрированный - хлороформ (8:9:6:14) (см. примечание 2 к разделу "Подлинность") и хроматографируют восходящим методом. Когда фронт растворителя дойдет до конца пластинки, ее вынимают из камеры, сушат на воздухе в течение 10 мин и просматривают в ультрафиолетовом свете при длине волны 254 нм. На хроматограмме анализируемого образца наблюдаются два пятна, соответствующие кислоте никотиновой и основанию препарата (в порядке возрастания подвижности). Любое постороннее пятно не должно по величине и интенсивности превышать пятна СОВС (посторонних примесей не более 0,5% в препарате).
Примечание.Приготовление раствора СОВС теофиллина. 0,025 г теофиллина растворяют в мерной колбе вместимостью 100 мл в смеси вода - спирт 95% (1:2) и доводят объем раствора этой же смесью до метки. Срок годности раствора 14 сут.
Хлориды. 0,1 г препарата растворяют в 10 мл воды. Полученный раствор должен выдерживать испытание на хлориды (не более 0,02% в препарате; ГФ XI, вып.1, с. 165).
Потеря в массе при высушивании. Около 0,5 г препарата (точная навеска) сушат при температуре от 100 до 105°С до постоянной массы. Потеря в массе не должна превышать 0,5% (ГФ XI, вып.1, с. 176).
Сульфатная зола и тяжелые металлы. Сульфатная зола из I г препарата (точная навеска) не должна превышать 0,1% (ГФ XI, вып.2, с. 25) и должна выдерживать испытание на тяжелые металлы (не более 0,001% в препарате; ГФ XI, вып.1, с. 165).
Микробиологическая чистота. Препарат должен выдерживать испытание на микробиологическую чистоту (ГФ XI, вып.2, с. 193).
Количественное определение. Около 0,1 г препарата (точная навеска) растворяют в 2 мл кислоты уксусной ледяной, затем прибавляют 18 мл ангидрида уксусного и титруют 0,1 М раствором кислоты хлорной потенпиометрически со стеклянным индикаторным электродом.
Параллельно проводят контрольный опыт.
I мл 0,1 М раствора кислоты хлорной соответствует 0,01448 г С13Н21 N5О4 · С6Н5 NО2
Упаковка. По 15 кг в пакеты бумажные типа I и П по ГОСТ 24370-80 из бумаги оберточной марки А по ГОСТ 8273-75 с вкладышем из пергамента марки А по ГОСТ 1341-84 или подпергамента по ГОСТ 1760-86, снабженные этикеткой из бумаги этикеточной по ГОСТ 7625-86 или писчей по ГОСТ I85IO-87.
Вторичная и транспортная тара в соответствии с ОСТ 64-034-87.
Маркировка. На этикетке указывают предприятие-изготовитель и его товарный знак, название препарата на латинском и русском языках, количество, условия хранения, регистрационный номер, номер серии, срок годности.
Маркировка транспортной тары в соответствии с ГОСТ 14192-77.
Транспортирование. В соотвествии с ОСТ 64-034-87.
Хранение. Список Б. В защищенном от света месте.
Срок годности. 4 года.
Средство улучшающее периферическое и церебральное кровообращение.
Примечание. Реактивы, титрованные растворы и индикаторы, приведенные в настоящей фармакопейной статье, описаны в соответствующих разделах Государственной фармакопеи СССР XI издания.
Все темы данного раздела:
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
на семинарские и лабораторные занятия по
фармацевтической химии
Определение чистоты лекарственных средств
&nbs
I. Учебные цели
Актуальность изучения темы обусловлена тем, что раздел чистоты является обязательной составной частью любой фармакопейной статьи на субстанции, из которых затем готовят различные лекарственные форм
В результате изучения темы «Определение чистоты лекарственных средств» студенты должны
«знать»:
· структуру нормативной документации, регламентирующей чистоту лекарственных средств: ОФС «Правила пользования фармакопейными статьями», ОФС «Фармацевтические суб
По подготовке к занятиям
При подготовке к занятиям необходимо ответить на вопросы для подготовки; ознакомиться с ОФС, ФС, ФСП, приказом №377, рекомендуемой литературой, обратив особое внимание на материал, который нашел от
Основные положения
Качество (доброкачественность) лекарственных средств регламентируется Государственной фармакопеей РФ (ГФ), общими фармакопейными статьями (ОФС), фармакопейными статьями (ФС), фармакопейными статьям
Работа на занятии
План занятия:
1. Семинар (см. «вопросы для обсуждения на семинаре»).
2. Решение задач.
Вопросы для обсуждения на семинаре:
1. К
Работа на занятии
План занятия:
Семинар (см. «вопросы для обсуждения на семинаре»).
Вопросы для обсуждения на семинаре:
1. Приведите определение стабильно
Работа на занятии
План занятия:
1. Семинар (см. «вопросы для обсуждения на семинаре»).
2. Решение задач.
Вопросы для обсуждения на семинаре:
1. Ч
Работа на занятии
План занятия:
1. Семинар (см. «вопросы для обсуждения на семинаре»).
2. Решение задач.
Вопросы для обсуждения на семинаре:
1. П
Масса тигля после второго взвешивания m=20,9964г.
Точную массу препарата (около 1г, если в соответствующей частной статье нет другого указания) отвешивают на ручных аптечных весах и пересыпают в предварительно прокаленный и взвешенный тигель, кото
Масса тигля с сульфатной золой после второго взвешивания m=20,9973г.
m навески – 100%
m сульфатной золы
Работа на занятии
План занятия:
1. Семинар (см. «вопросы для обсуждения на семинаре»).
2. Решение задач.
Вопросы для обсуждения на семинаре:
1. В
Работа на занятии
План занятия:
1. Проведение тестового контроля.
2. Приготовление эталонных растворов на ионы хлора, сульфата, аммония, кальция и цинка согласно требованиям ОФС «И
ТЕСТОВЫЕ ЗАДАНИЯ
Выберите один правильный ответ:
1. МАССУ СЛЕДУЕТ СЧИТАТЬ ПОСТОЯННОЙ, ЕСЛИ РАЗНОСТЬ РЕЗУЛЬТАТОВ ДВУХ ПОСЛЕДУЮЩИХ ВЗВЕШИВАНИЙ НЕ ПРЕВЫШАЕТ
1) 0,0001 2) 0,0003 3) 0,0005 4) 0,0010
III. Учебно-материальное обеспечение
Литература (обязательная)
1. Государственная фармакопея СССР вып. 1 / МЗ СССР – ХI-е изд. доп. – М.: Медицина, 1989. – 334 с.
2. Государственная фармакопея Российс
ОБЩИЕ ФАРМАКОПЕЙНЫЕ СТАТЬИ
ПРАВИЛА ПОЛЬЗОВАНИЯ ФАРМАКОПЕЙНЫМИ СТАТЬЯМИ(ОФС 42-0031-07 ГФ XII)
Описание.Указывают характеристики физического состояния и цвет лекарственного ср
Фармацевтические СУБСТАНЦИИ
(ОФС 42-0074-07 ГФXII)
Фармацевтическая субстанция – стандартизованное биологически активное вещество или стандартизованная смесь биологически активных веществ, полученные методами
Общие положения
1.1. Под сроком годности лекарственных средств понимается время, в течение которого лекарственные средства полностью отвечают всем требованиям нормативной документации, в соответствии с которой они
Общие замечания
1. Вода и все реактивы должны быть свободны от ионов, на содержание которых проводят испытания.
2. Пробирки, в которых проводят наблюдения, должны быть бесцветными и одинакового диаметра (
Общие замечания
1. Вода и все реактивы должны быть свободны от ионов, на содержание которых проводят испытания.
2. Пробирки, в которых проводят наблюдения, должны быть бесцветными и одинакового диаметра.
Испытание на хлориды
Растворы хлоридов в зависимости от их концентрации образуют с раствором нитрата серебра белый творожистый осадок, белую муть или опалесценцию, не исчезающие от прибавления азотной кислоты и легко и
Испытание на сульфаты
Растворы сульфатов в зависимости от их концентрации образуют с растворами солей бария белый осадок или муть, не исчезающие от прибавления разведенной хлористоводородной кислоты.
Предельная
МЕТОД I
Растворы солей аммония в зависимости от их концентрации образуют с реактивом Несслера желто-бурый осадок или желтое окрашивание.
Предельная чувствительность реакции 0,0003 мг (0,3 мкг) ион
МЕТОД II
Соли аммония при прибавлении едкого натра выделяют аммиак, который определяют по запаху или посинению смоченной водой красной лакмусовой бумаги.
Предельная чувствительность реакции 0,003 м
ОПРЕДЕЛЕНИЕ КАЛЬЦИЯ В НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЯХ
К 10 мл раствора испытуемого препарата, приготовленного, как указано в соответствующей частной статье, прибавляют 1 мл раствора хлорида аммония, 1 мл раствора аммиака и 1 мл раствора оксалата аммон
Испытание на соли железа
Растворы солей двух- и трехвалентного железа в зависимости от концентрации образуют с раствором сульфосалициловой кислоты в аммиачной среде коричнево-красные или желтые растворы феррилсульфосалицил
Испытания на соли цинка
Растворы солей цинка в зависимости от концентрации образуют с раствором ферроцианида калия белый осадок или муть, нерастворимые в разведенных кислотах.
Предельная чувствительность реакции
ОПРЕДЕЛЕНИЕ ТЯЖЕЛЫХ МЕТАЛЛОВ В РАСТВОРАХ ПРЕПАРАТОВ
К 10 мл раствора испытуемого препарата, приготовленного, как указано в соответствующей частной статье, прибавляют 1 мл разведенной уксусной кислоты, 2 капли раствора сульфида натрия
В ЗОЛЬНОМ ОСТАТКЕ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
Зольный остаток, полученный после сжигания 1 г органического вещества в присутствии серной кислоты, обрабатывают при нагревании на сетке 2 мл насыщенного раствора ацетата аммония, нейтрализованного
МЕТОД I
Соединения, мышьяка под действием цинка и хлористоводородной или серной кислоты восстанавливаются в мышьяковистый водород, который, соприкасаясь с бумагой, пропитанной раствором дихлорида ртути, ок
Подготовка препаратов для определения в них мышьяка.
Неорганические препараты:
а) Препараты, не содержащие азотной кислоты, нитратов и нитритов, не выделяющие в условиях проведения испытаний галогенов, сероводорода, сернисто
МЕТОД II
Метод II применяют в случае определения наряду с мышьяком селена и теллура, а также при определении мышьяка в препаратах сурьмы, висмута, ртути и серебра, препаратах, содержащих сульфиды и сульфиты
Метод 2
Испытуемый раствор. 10 мл раствора испытуемого образца, приготовленного как указано в частной фармакопейной статье.
Эталонный раствор. 10 мл стандартного раствора железо(III)
Определение солей железа в зольном остатке органических соединений
Испытуемый раствор. Зольный остаток, полученный после сжигания навески испытуемого образца с серной кислотой концентрированной, обрабатывают при нагревании на водяной бане 2 мл хлористоводор
Стандартные растворы железо(III)-иона
Стандартный раствор 200 мкг/мл железо(III)-иона
0,8634 г железа(III) аммония сульфата или количество железа(III) аммония сульфата, соответствующее 0,1000 г железо(III)-иона и рассчи
Определение тяжелых металлов в растворах лекарственных средств
Испытуемый раствор. 10 мл раствора испытуемого образца, приготовленного, как указано в частной фармакопейной статье.
Эталонный раствор. К 2 мл стандартного раствора свинец-ио
Лекарственных средств
Испытуемый раствор. Зольный остаток, полученный после сжигания 1 г (если не указано иначе в частной фармакопейной статье) испытуемого образца в присутствии серной кислоты концентрированной,
Стандартные растворы свинец-иона
Стандартный раствор 100 мкг/мл свинец-иона
0,0799 г свинца нитрата помещают в мерную колбу вместимостью 500,0 мл и растворяют в 50 мл воды с добавлением 0,5 мл азотной кислоты конце
Метод высушивания
Точную навеску вещества помещают в предварительно высушенный и взвешенный бюкс и сушат до постоянной массы (условия высушивания, температура и навеска приводятся в соответствующих частных статьях).
Определение воды
Определение проводят в приборе (ГОСТ 1594—69), состоящем из стеклянной круглодонной колбы вместимостью от 250 до 500 мл, приемника, представляющего собой градуированную пробирку вместимостью 10 мл,
Метод титрования реактивом К. Фишера
Реактив К. Фишера представляет собой раствор двуокиси серы, йода и пиридина в метиловом спирте. Взаимодействие этого реактива с водой протекает в две стадии стехиометрически по уравнениям:
Приготовление исходных растворов
Желтый раствор. 46 г (точная навеска) железа (III) хлорида (FeC13·6 Н2О; М.м. 270,30) растворяют в 900 мл смеси, приготовленной из 25 мл концентрированной
Стандартные растворы
Стандартные растворы
Желтый
исходный раствор, мл
Красный исходный раствор, мл
Голубой исходный раствор, мл
1 % раство
ПРОЗРАЧНОСТЬ И СТЕПЕНЬ МУТНОСТИ ЖИДКОСТЕЙ
(ОФС 42-0051-07 ГФ XII)
Прозрачность и степень мутности жидкостей определяют путем сравнения испытуемой жидкости с растворителем или эталонами визуально или инструментальным методом
В соответствии с требованиями настоящей ОФС
Ацетон
3-Метил-1-бутанол
Анизол
Метилизобутилкетон
1-Бутанол
2-Метил-1-пропанол
Фармакопейные статьи
Аскорбиновая кислота(ФС 42-0218-07)
(5R)-5-[(1S)-1,2-Дигидроксиэтил]-2,3-дигидроксифуран-2(5H)он
Glucoza
ФС 42-2419-86
Срок введения установлен 7.05.1986 г.
Срок действия до 30.12.1991 г.
С6Н12О6 Н2О М.м. 198,17
Натрия хлорид
СТАНДАРТ КАЧЕСТВА ЛЕКАРСТВЕННОГО СРЕДСТВА
ФАРМАКОПЕЙНАЯ СТАТЬЯ ПРЕДПРИЯТИЯ
ОТКРЫТОЕ АКЦИОНЕРНОЕ ОБЩЕСТВО «ВОСТОКВИТ»
СПЕЦИФИКАЦИЯ
Бактериальные эндотоксины.
Содержание бактериальных эндотоксинов в 1 г препарата не более 5 ЕЭ.
Примечание: Тест «Пирогенность» или «Бактериальные эндотоксины» проводят для препарата, используемого для пригот
По организации хранения в аптечных учреждениях различных групп лекарственных средств и изделий медицинского назначения
В целях обеспечения высокого качества и сохранности лекарственных средств и изделий медицинского назначения в аптечных учреждениях, создания безопасных условий труда при работе с ни
Требования к устройству и эксплуатация помещений хранения.
2.1. Устройство, состав, размеры площадей и оборудование помещений•хранения аптечных складов и аптек должны отвечать всем требованиям•действующей нормативно-технической документации (СНиП, методиче
Общее требования к организации хранения лекарственных средств я изделий медицинского назначения.
3.1. Лекарственные средства, изделия медицинского назначения в помещениях хранения необходимо размещать с учетом наиболее полного использования площади, создания наилучших условий труда для складск
Требования, предъявляемые к хранению различных групп лекарственных средств я изделий медицинского назначения.
Все лекарственные средства, в зависимости от физических и физико-химических свойств, воздействия на них различных факторов внешней среды, делят на:
- требующие защиты от света;
-
Особенности хранения лекарственных средств, требующих защиты света.
4.1.1. К числу лекарственных средств, требующих защиты от света, относятся: антибиотики, галеновые препараты (настойки, экстракты, концентраты из растительного сырья), растительное лекарственное сы
Особенности хранения лекарственных средств, требующих защиты от влаги.
4.2.1. К числу лекарственных средств, требующих защиты от воздействия влаги, относятся: гигроскопичные вещества и препараты (например, ацетат калия, сухие экстракты, растительное лекарственное сырь
Особенности хранения лекарственных средств, требующих защиты от воздействия пониженной температуры.
4.6.1. К числу лекарственных средств, требующих защиты от воздействия пониженной температуры, относятся такие, физико-химическое состояние которых после замерзания изменяется и при последующем согр
Особенности хранения лекарственных средств, требующих защиты от воздействия газов, содержащихся в окружающей среде
4.7.1. К группе лекарственных средств, изменяющихся под влияние газов, находящихся в окружающей среде, относят:
- вещества, реагирующие с кислородом воздуха: различные соединения алифатиче
Особенности хранения пахучих и красящих лекарственных средств и парафармацевтической продукции.
4.8.1. Группу пахучих составляют лекарственные средства как летучие, так и практически нелетучие, обладающие сильным запахом.
4.8.2. К группе красящих лекарственных средств относят веществ
Особенности хранения готовых лекарственных средств.
4.9.1. Хранение готовых лекарственных средств должно отвечать требованиям ГФ и всем общим требованиям настоящей Инструкции, предъявляемым к хранению лекарственных средств с учетом свойств ингредиен
Особенности хранения лекарственного растительного сырья.
5.1. Лекарственное растительное сырье должно храниться в сухом, хорошо вентилируемом помещении в хорошо закрытой таре, в аптеках - стеклянной, металлической, в ящиках с крышкой, на складах — в тюка
Общие правила подготовки лекарственных средств и изделий медицинского назначения к использованию после хранения.
7.1. Все лекарственные вещества "ангро" перед работой с ними должны быть перемешаны. Особое внимание следует обращать на смешивание верхних и пристеночных слоев лекарственного веще
Хранение изделий медицинского назначения.
8.1. Резиновые изделия •
8.1.1. Для наилучшего сохранения резиновых изделий в помещениях хранения необходимо создать:
- защиту от света, особенно прямых солнечных лучей, вы
Перевязочные средства и вспомогательный материал
10.1. Перевязочные средства хранят в сухом проветриваемом помещении в шкафах, ящиках, на стеллажах и поддонах, которые должны быть выкрашены изнутри светлой масляной краской и, содержаться в чистот
Изделия медицинской техники.
11.1. Хирургические инструменты и другие металлические изделия надлежит хранить в сухих отапливаемых помещениях при комнатной температуре. Температура и относительная влажность воздуха в помещениях
Медицинские пиявки.
12.1. Помещение для хранения медицинских пиявок должно быть светлым, без запаха лекарств. Не допускается резких колебаний температуры, так как это вызывает гибель пиявок.
12.2. Содержать п
Медицинского назначения.
13.1. Лекарственные средства и изделия медицинского назначения следует хранить и транспортировать в первичной, вторичной, групповой транс портной таре, предусмотренной действующей нормативно-технич








Новости и инфо для студентов