В закрытых системах - раздел Педагогика, ЛЕКЦИЯ 1. Предмет и метод термодинамики. Термодинамическая система Основными Процессами, Весьма Важными И В Теоретическом, И В Прикладном Отнош...
Основными процессами, весьма важными и в теоретическом, и в прикладном отношениях, являются: изохорный, протекающий при постоянном объеме; изобарный, протекающий при постоянном давлении; изотермический, происходящий при постоянной температуре; адиабатный — процесс, при котором отсутствует теплообмен с окружающей средой, и политропный, удовлетворяющий уравнению 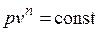 .
.
Метод исследования процессов, не зависящий от их особенностей и являющийся общим, состоит в следующем:
выводится уравнение процесса, устанавливающее связь между начальными и конечными параметрами рабочего тела в данном процессе;
вычисляется работа изменения объема газа;
определяется количество теплоты, подведенной (или отведенной) к газу в процессе;
определяется изменение внутренней энергии системы в процессе;
определяется изменение энтропии системы в процессе.
Изохорный процесс.При изохорном процессе выполняется условие
dv = 0 или v = const. Из уравнения состояния идеального газа следует, что p/T=R/v=const, т. е. давление газа прямо пропорционально его абсолютной температуре:
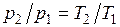 .
.
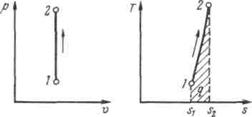
Рисунок 5.1 - Изображение изохорного процесса в р,v- и T, s-координатах
Работа расширения в этом процессе равна нулю, так как dv= 0.
Количество теплоты, подведенной к рабочему телу в процессе 12 при 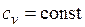 , определяется как:
, определяется как:
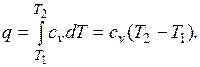
При переменной теплоемкости 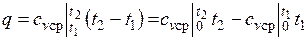 , где
, где 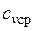 — средняя массовая изохорная теплоемкость в интервале температур от t1 до t2.
— средняя массовая изохорная теплоемкость в интервале температур от t1 до t2.
Так как 1= 0, то в соответствии с первым законом термодинамики 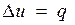 и
и


Поскольку внутренняя энергия идеального газа является функцией только его температуры, то полученные формулы справедливы для любого термодинамического процесса идеального газа.
Изменение энтропии в изохорном процессе определяется по формуле
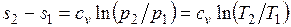 ,
,
т. е. зависимость энтропии от температуры на изохоре при сv = const имеет логарифмический характер.
Изобарный процесс.Из уравнения состояния идеального газа при р=const находим 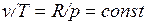 , или
, или 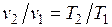 , т. е. в изобарном процессе объем газа пропорционален его абсолютной температуре (закон Гей-Люссака, 1802 г.). На рисунке изображен график процесса.
, т. е. в изобарном процессе объем газа пропорционален его абсолютной температуре (закон Гей-Люссака, 1802 г.). На рисунке изображен график процесса.
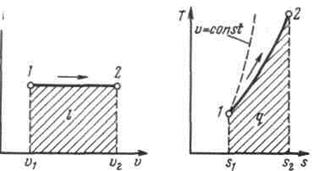
Рисунок 5.2 - Изображение изобарного процесса в p,v- и T,s-координатах
Из выражения 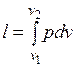 следует, что
следует, что 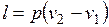 .
.
Так как 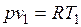 и
и 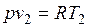 , то одновременно
, то одновременно
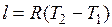
Количество теплоты, сообщаемое газу при нагревании (или отдаваемое им при охлаждении):
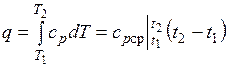 ,
,
где 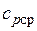 — средняя массовая изобарная теплоемкость в интервале температур от t1 до t2 при
— средняя массовая изобарная теплоемкость в интервале температур от t1 до t2 при 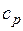 = const
= const
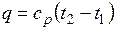 .
.
Изменение энтропии при ср = const согласно равно
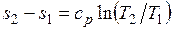 ,
,
т. е. температурная зависимость энтропии при изобарном процессе тоже имеет логарифмический характер, но поскольку ср>сv, то изобара в Т,s-диаграмме идет более полого, чем изохора.
Изотермический процесс.При изотермическом процессе температура постоянна, следовательно, pv = RT = const, или
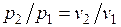 ,
,
т. е. давление и объем обратно пропорциональны друг другу, так что при изотермическом сжатии давление газа возрастает, а при расширении — падает (закон Бойля — Мариотта, 1662 г.).
Графиком изотермического процесса в р,v –координатах является равнобокая гипербола, для которой координатные оси служат асимптотами .
Работа процесса:
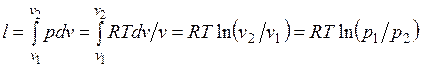 .
.
Так как температура не меняется, то внутренняя энергия идеального газа в данном процессе остается постоянной (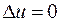 ) и вся подводимая к газу теплота полностью превращается в работу расширения:
) и вся подводимая к газу теплота полностью превращается в работу расширения:
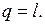

Рисунок 5.3 - Изображение изотермического процесса в р, v- и T, s-координатах.
При изотермическом сжатии от газа отводится теплота в количестве, равном затраченной на сжатие работе.
Изменение энтропии в изотермическом процессе выражается формулой
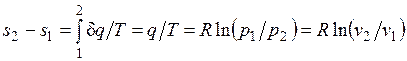 .
.
Адиабатный процесс.Процесс, происходящий без теплообмена с окружающей средой, называется адиабатным, т. е.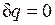 . Для того чтобы осуществить такой процесс, следует либо теплоизолировать газ, т. е. поместить его в адиабатную оболочку, либо провести процесс настолько быстро, чтобы изменение температуры газа, обусловленное его теплообменом с окружающей средой, было пренебрежимо мало по сравнению с изменением температуры, вызванным расширением или сжатием газа. Как правило, это возможно, ибо теплообмен происходит значительно медленнее, чем сжатие или расширение газа.
. Для того чтобы осуществить такой процесс, следует либо теплоизолировать газ, т. е. поместить его в адиабатную оболочку, либо провести процесс настолько быстро, чтобы изменение температуры газа, обусловленное его теплообменом с окружающей средой, было пренебрежимо мало по сравнению с изменением температуры, вызванным расширением или сжатием газа. Как правило, это возможно, ибо теплообмен происходит значительно медленнее, чем сжатие или расширение газа.
Уравнения первого закона термодинамика для адиабатного процесса принимают вид: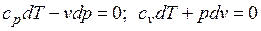 . Поделив первое уравнение на второе, получим
. Поделив первое уравнение на второе, получим
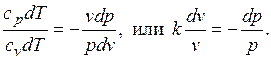
Интегрируя последнее уравнение при условии, что k =cp/cv=const, находим
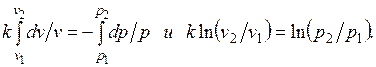
После потенцирования имеем
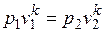 . *
. *
Это и есть уравнения адиабаты идеального газа при постоянном отношении теплоемкостей (k = const). Величина
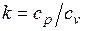
называется показателем адиабаты. Подставив cp = cv-R, получим k. Согласно классической кинетической теории теплоемкость газов не зависит от температуры, поэтому можно считать, что величина k также не зависит от температуры и определяется числом степеней свободы молекулы. Для одноатомного газа k=1,66 для двухатомного k=1,4, для трех- и многоатомных газов k=l,33.
Поскольку k>1, то в координатах р,v линия адиабаты идет круче линии изотермы: при адиабатном расширении давление понижается быстрее, чем при изотермическом, так как в процессе расширения уменьшается температура газа.
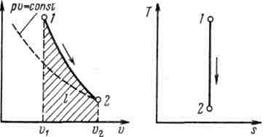
Рисунок 5.4 - Изображение адиабатного процесса в р, v- и Т, s-координатах
Определив из уравнения состояния, написанного для состояний 1и 2, отношение объемов или давлений, получим уравнение адиабатного процесса в форме, выражающей зависимость температуры от объема или давления:
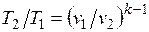 ;
;
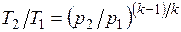 .
.
Работа расширения при адиабатном процессе согласно первому закону термодинамики совершается за счет уменьшения внутренней энергии и может быть вычислена по одной из следующих формул:
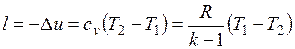 .
.
Так как 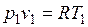 и
и 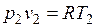 , то
, то
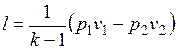 .
.
В данном процессе теплообмен газа с окружающей средой исключается, поэтому q=0. Выражение  показывает, что теплоемкость адиабатного процесса равна нулю.
показывает, что теплоемкость адиабатного процесса равна нулю.
Поскольку при адиабатном процессе 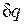 = 0, энтропия рабочего тела не изменяется (ds=0 и s=const). Следовательно, на Т,s-диаграмме адиабатный процесс изображается вертикалью.
= 0, энтропия рабочего тела не изменяется (ds=0 и s=const). Следовательно, на Т,s-диаграмме адиабатный процесс изображается вертикалью.
Политропный процесс и его обобщающее значение.Любой произвольный процесс можно описать в р,v-координатах (по крайней мере на небольшом участке) уравнением
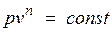 ,
,
подбирая соответствующее значение п. Процесс, описываемый таким уравнением, называется политропным. Показатель политропы n может принимать любое численное значение в пределах от 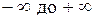 , но для данного процесса он является величиной постоянной.
, но для данного процесса он является величиной постоянной.
Из уравнения Клапейрона нетрудно получить выражения, устанавливающие связь между р, v и Т в любых двух точках на политропе, аналогично тому, как это было сделано для адиабаты:
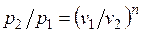 ;
; 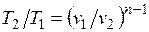 ;
; 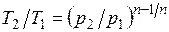 . (5.1)
. (5.1)
Работа расширения газа в политропном процессе имеет вид 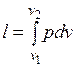 .
.
Так как для политропы в соответствии с (5.1)
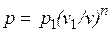 ,
,
то
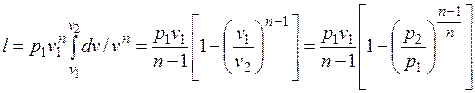 (5.2)
(5.2)
Уравнение (5.1) можно преобразовать к виду:
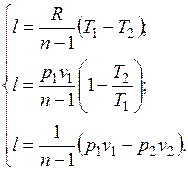
Количество подведенной (или отведенной) в процессе теплоты можно определить с помощью уравнения первого закона термодинамики: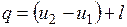 .
.
Поскольку 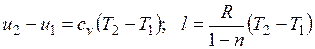 , то
, то
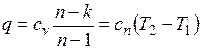 ,
,
где
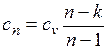
представляет собой теплоемкость идеального газа в политропном процессе. При постоянных cv, k и п теплоемкость сn = const, поэтому политропный процесс иногда определяют как процесс с постоянной теплоемкостью.
Изменение энтропии
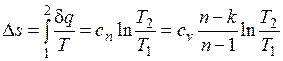 .
.
Политропный процесс имеет обобщающее значение, ибо охватывает всю совокупность основных термодинамических процессов. Ниже приведены характеристики термодинамических процессов.
| Процесс
| п
| 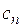
|
| Изохорный
| 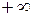
| 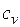
|
| Изобарный
| 0
| 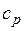
|
| Изотермический
| 1
| 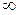
|
| Адиабатный
| k
| 0
|
На рисунке показано взаимное расположение на р, V- и Т, s-диаграммах политропных процессов с разными значениями показателя политропы. Все процессы начинаются в одной точке («в центре»).
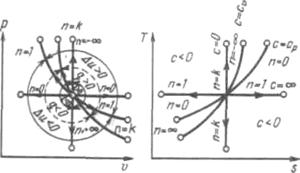
Рисунок 5.5 - Изображение основных термодинамических процессов идеального газа в р, v- и Т, s-координатах
Изохора (п= ±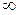 ) делит поле диаграммы на две области: процессы, находящиеся правее изохоры, характеризуются положительной работой, так как сопровождаются расширением рабочего тела; для процессов, расположенных левее изохоры, характерна отрицательная работа.
) делит поле диаграммы на две области: процессы, находящиеся правее изохоры, характеризуются положительной работой, так как сопровождаются расширением рабочего тела; для процессов, расположенных левее изохоры, характерна отрицательная работа.
Процессы, расположенные правее и выше адиабаты, идут с подводом теплоты к рабочему телу; процессы, лежащие левее и ниже адиабаты, протекают с отводом теплоты.
Для процессов, расположенных над изотермой ( = 1), характерно увеличение внутренней энергии газа; процессы, расположенные под изотермой, сопровождаются уменьшением внутренней энергии.
Процессы, расположенные между адиабатой и изотермой, имеют отрицательную теплоемкость, так как 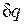 и du (а следовательно, и dT), имеют в этой области противоположные знаки. В таких процессах
и du (а следовательно, и dT), имеют в этой области противоположные знаки. В таких процессах 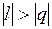 , поэтому на производство работы при расширении тратится не только подводимая теплота, но и часть внутренней энергии рабочего тела.
, поэтому на производство работы при расширении тратится не только подводимая теплота, но и часть внутренней энергии рабочего тела.
Все темы данного раздела:
ЛЕКЦИЯ 1
Предмет и метод термодинамики
Термодинамика изучает законы превращ
Термодинамическая система
Термодинамическая система представляет собой совокупность материальных тел, находящихся в механическом и тепловом взаимодействиях друг с другом и с окружающими систему внешними телами («вн
Термодинамические параметры состояния
Свойства каждой системы характеризуются рядом величин, которые принято называть термодинамическими параметрами. Рассмотрим некоторые из них, используя при этом известные из курса физики молекул
Термодинамический процесс
Изменение состояния термодинамической системы во времени называется термодинамическим процессом. Так, при перемещении поршня в цилиндре объём, а с ним давление и температура находящегося вн
Теплоемкость газов
Отношение количества теплоты , полученного телом при бесконечно малом изменении его состояния, к связан
Смеси идеальных газов
Все зависимости, полученные выше для идеальных газов, справедливы и для их смесей, если в них подставлять газовую постоянную, молекулярную массу и теплоемкость смеси.
Закон Дальто
Работа расширения
Работа в термодинамике, так же как и в механике, определяется произведением действующей на рабочее тело силы на путь ее действия.
Рассмотрим газ массой М и объемом V, заключ
Теплота
Помимо макрофизической формы передачи энергии — работы существует также и микрофизическая, т. е. осуществляемая на молекулярном уровне форма обмена энергией между системой и окружающей средой. В
Энтропия
Как уже указывалось, величина не является полным дифференциалом. Действительно, для того чтобы проинт
Общая формулировка второго закона термодинамики
Из первого закона термодинамики следует, что взаимное превращение тепловой и механической энергии в двигателе должно осуществляться в строго эквивалентных количествах. Двигатель, который позволя
Обратный цикл Карно
Осуществим цикл Карно в обратном направлении. Рабочее тело с начальными параметрами точки а расширяется адиабатно, совершая работу расширения за счет внутренней энергии, и охлаждается от
Изменение энтропии в неравновесных процессах
Рассмотрим принципиальные отличия неравновесных процессов от равновесных на примере расширения газа в цилиндре под поршнем, получающего теплоту
Эксергия
Основываясь на втором начале термодинамики, установим количественное соотношение между работой, которая могла бы быть совершена системой при данных внешних условиях в случае протекания в ней равн
Термодинамические процессы реальных газов
В качестве реального газа рассмотрим водяной пар, который широко используется во многих отраслях техники, и прежде всего в теплоэнергетике, где он является основным рабочим телом. Поэтому исслед
Истечение из суживающегося сопла
Рассмотрим процесс равновесного (без трения) адиабатного истечения газа через сопло из резервуара, в котором газ имеет параметры Т1 , p1, v1. Скорость газа на
Основные закономерности течения газа в соплах и диффузорах
В соответствии с уравнением неразрывности потока в стационарном режиме
. (7.12)
Секу
Расчет процесса истечения с помощью h,s-диаграммы
Истечение без трения.Так как водяной пар не является идеальным газом, расчет его истечения лучше выполнять не по аналитическим формулам, а с помощью h, s-диаграммы.
Дросселирование газов и паров
Из опыта известно, что если на пути движения газа или пара в канале встречается препятствие (местное сопротивление), частично загромождающее поперечное сечение потока, то давление за препятстви
Термодинамическая эффективность циклов теплосиловых установок
Наибольший термический КПД в заданном диапазоне температур имеет цикл Карно. При его осуществлении предполагается использование горячего источника с постоянной температурой, т. е. фактически с бес
Циклы поршневых двигателей внутреннего сгорания
Чтобы исключить эксергетические потери за счет неравновесного теплообмена с горячим источником теплоты, целесообразно использовать в качестве рабочего тела газы, получающиеся при сгорании топли
Циклы газотурбинных установок
В циклах ДВС рабочее тело выбрасывается из цилиндра с температурой и давлением
Циклы Карно и Ренкина насыщенного пара. Регенерация теплоты.
Цикл Карно насыщенного пара можно было бы осуществить следующим образом. Теплота от горячего источника подводится при постоянной температуре
Цикл Ренкина на перегретом паре
Изображения идеального цикла перегретого пара в p-, v-, T-, s-, и h, s-диаграммах приведены на рис. 6.9 и 6.10. Этот цикл отличается от цикла Ренкина на насыщенном паре (см. рис. 6.
Термический КПД цикла
Если не учитывать ничтожного повышения температуры при адиабатном сжатии воды в насосе, то
Общая характеристика холодильных установок
Выработка искусственного холода и трансформация теплоты с более низкого температурного уровня на более высокий широко применяются в различных отраслях промышленности. Тепловые машины, предназначенн
Цикл паровой компрессионной холодильной установки
Паровые компрессионные установки позволяют в области насыщенного пара приблизить холодильный цикл к обратному циклу Карно. Насыщенный пар низкокипящей жидкости (хладагента) всасывается компрессором
Основы теории теплообмена
Теплопередача - это процесс переноса теплоты от одного теплоносителя к другому через разделяющую стенку. Теплопередача связана с весьма сложными процессами и при ее изучении необходимо знать
Закон Фурье
Теория теплопроводности рассматривает тело как непрерывную среду. Согласно основному закону теплопроводности - закону Фурье - вектор плотности теплового потока, передаваемого теплопроводност
Многослойная плоская стенка
l1 l2 l3
Однородная цилиндрическая стенка
Задача о распространении тепла в цилиндрической стенке также одномерная, если ее рассматривать в цилиндрических координатах. температура изменяется только вдоль радиуса r, а по длине и по ее периме
Многослойная цилиндрическая стенка
Аналогично многослойной плоской стенке, полное термическое сопротивление многослойной цилиндрической стенки можно записать:
Плоская стенка
Рассмотрим теплопередачу между двумя жидкостями через разделяющую из многослойную плоскую стенку. Здесь передача теплоты делится на три процесса:
1) В начале теплота передается от горячего
Цилиндрическая стенка
Рассмотрим теплопередачу между двумя жидкостями через разделяющую их многослойную цилиндрическую стенку.
аналогично теплопередаче через плоскую стенку, линейную плотность теплового потока
Интенсификация теплопередачи
Согласно уравнению теплопередачи:
,
для интенсификации теплопередачи нужно либо увел
Тепловая изоляция
Для уменьшения потерь теплоты многие сооружения приходится теплоизолировать, покрывая их стенки слоем материала с малой теплопроводностью (l<0,2 Вт/(м×К)). Такие материалы называются тепло
Задачи по теплопередаче
1. Вычислить потери теплоты через единицу поверхности кирпичной обмуровки парового котла в зоне размещения водяного экономайзера, если толщина стенки d=250мм, температура газов tж1=700°С
Основной закон конвективного теплообмена
Обычно жидкие и газообразные теплоносители нагреваются или охлаждаются при соприкосновении с поверхностями твердых тел. Например, дымовые газы в печах отдают теплоту нагреваемым заготовкам, а в пар
Пограничный слой
Рассмотрим процесс теплоотдачи от потока теплоносителя к продольно омываемой им пластине. Скорость и температура набегающего потока постоянна и равны wж и tж.
Как уже
Числа подобия
Основная трудность, возникающая при экспериментальном исследовании конвективного теплообмена, заключается в том, что коэффициент теплоотдачи зависит от многих параметром. Чтобы уменьшить число их с
Массообмен
Большинство веществ, используемых в технике, представляет собой многокомпонентные системы. Нефтепродукты и нефть – это смесь различных углеводородов. Поэтому многие процессы теплообмена сопровождаю
Числа подобия конвективного массообмена
Диффузионное число подобия Нуссельта В научной литературе его часто обозначают как число Шервуда
Поперечное обтекание одиночной трубы и пучка труб
Экспериментальные данные по теплоотдаче при поперечном обтекании одиночной круглой трубы спокойным, нетурбулизированным потоком обобщается формулой:
Описание процесса излучения. Основные определения
Тепловое излучение есть результат превращения внутренней энергии тел в энергию электромагнитных колебаний.
Тепловое излучение как процесс распространения электромагнитных волн характеризуе
Теплообмен излучением системы тел в прозрачной среде
Рассмотрим теплообмен между двумя единичными поверхностями, обращенными друг к другу с небольшим зазором, причем Т1>Т2. В этой системе Е1 – энергия собственного
Перенос лучистой энергии в поглощающей и излучающей среде
Продукты сгорания топлив представляют собой смесь нескольких газов. Различные газы обладают различной способностью излучать и поглощать энергию. Одно- и двухатомные газы (кислород, азот и др.) прак
Типы теплообменных аппаратов
Теплообменный аппарат ( теплообменник ) - это устройство, предназначенное для нагревания, охлаждения или изменения агрегатного состояния теплоносителя.
Чаще всего в теплообменных ап
Термодинамический анализ топливосжигающих устройств
Промышленная печь - термотехнологическое устройство, предназначенное для осуществления физико-химических превращений исходных материалов путем тепловой обработки их при оптимальных температурах.
Полезная тепловая нагрузка печи
Полезно использованное тепло или полезная тепловая нагрузка печи складывается из количеств тепле, которые передаются продукту в печи для его нагрева и частичного испарения.
Если в печи по
Расчет процесса горения топлива в печи
Низшая теплота сгорания топлива рассчитывается по формулам:
для жидкого топлива, кДж/кг топл.,
Тепловой баланс печи. Коэффициент полезного действия. Расход топлива
Уравнение теплового баланса печи составляется для 1 кг жидкого или 1 м3 газообразного топлива, при этом составляющие уравнения измерены в кДж/кг или кДж/ м3 соответственно.
Устройство парового котла
Одна из схем котла с естественной циркуляцией приведена на рисунке. Барабанный паровой котел состоит из топочной камеры и газоходов, барабана, поверхностей нагрева, находящихся под давлением рабо
Коэффициент полезного действия
Тепловой баланс котла, как и любого теплотехнического агрегата, характеризуется равенством между количествами подведенной (располагаемой) и расходуемой теплоты:
Состав и основные характеристики жидкого топлива
Практически все жидкие топлива пока получают путем переработки нефти. Сырую нефть нагревают до 300—370 °С, после чего полученные пары разгоняют на фракции, конденсирующиеся при различной температ
Состав и основные характеристики газообразного топлива
К газообразным топливам относится, прежде всего, природный газ, огромными запасами которого располагает СССР. Основным его компонентом является метан СН4, кроме того, в газе разных мес
Теплота сгорания топлива
Под теплотой сгорания понимается количество теплоты, выделяющейся при полном сгорании единицы топлива. Теплоту сгорания твердого и жидкого топлива обычно относят к 1 кг, а газообразного — к
Теплота “сгорания” воздуха
Каким бы сложным ни был состав углеводородного топлива, при его полном сгорании углерод окисляется до СO2, водород — до Н2O, сера — до SO2. Формально полное окисле
Объемы и состав продуктов сгорания
При проектировании теплотехнических агрегатов нужно знать количество образующихся газов, чтобы правильно рассчитать газоходы, дымовую трубу, выбрать устройство (дымосос) для удаления этих газов и
Методы использования тепловых ВЭР
Использование тепловых ВЭР возможно по трем направлениям:
внутреннее регенеративное теплоиспользование, которое характеризуется возвратом теплоты отходящих потоков (их части) для проведен
Установки для внутреннего теплоиспользования
Регенеративное теплоиспользование позволяет не просто утилизировать теплоту отходящих потоков (например, газов, рис.1), но снижает расход топлива и, кроме того, улучшает работу основной технологи
Котлы-утилизаторы
Для использования теплоты отходящих газов различных технологических установок, в том числе и печей, применяются котлы-утилизаторы, вырабатывающие, как правило, пар. При высоких температурах газов
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
1. Латыпов Р.Ш., Шарафиев Р.Г. Техническая термодинамика и энерготехнология химических производств.-М.:Энергоатомиздат, 1998.-344 с.
2. Баскаков А.П. Теплотехника.-М.:Энерг
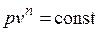 .
.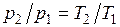 .
.
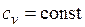 , определяется как:
, определяется как: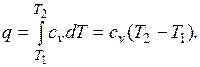
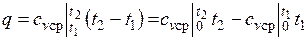 , где
, где 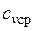 — средняя массовая изохорная теплоемкость в интервале температур от t1 до t2.
— средняя массовая изохорная теплоемкость в интервале температур от t1 до t2.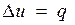 и
и

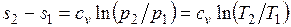 ,
,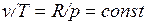 , или
, или 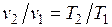 , т. е. в изобарном процессе объем газа пропорционален его абсолютной температуре (закон Гей-Люссака, 1802 г.). На рисунке изображен график процесса.
, т. е. в изобарном процессе объем газа пропорционален его абсолютной температуре (закон Гей-Люссака, 1802 г.). На рисунке изображен график процесса.
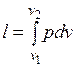 следует, что
следует, что 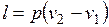 .
.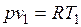 и
и 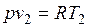 , то одновременно
, то одновременно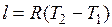
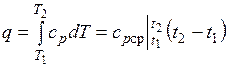 ,
,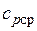 — средняя массовая изобарная теплоемкость в интервале температур от t1 до t2 при
— средняя массовая изобарная теплоемкость в интервале температур от t1 до t2 при 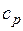 = const
= const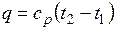 .
.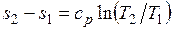 ,
,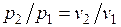 ,
,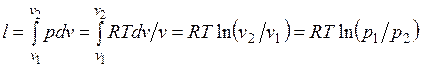 .
.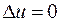 ) и вся подводимая к газу теплота полностью превращается в работу расширения:
) и вся подводимая к газу теплота полностью превращается в работу расширения:

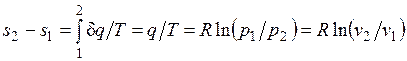 .
. . Для того чтобы осуществить такой процесс, следует либо теплоизолировать газ, т. е. поместить его в адиабатную оболочку, либо провести процесс настолько быстро, чтобы изменение температуры газа, обусловленное его теплообменом с окружающей средой, было пренебрежимо мало по сравнению с изменением температуры, вызванным расширением или сжатием газа. Как правило, это возможно, ибо теплообмен происходит значительно медленнее, чем сжатие или расширение газа.
. Для того чтобы осуществить такой процесс, следует либо теплоизолировать газ, т. е. поместить его в адиабатную оболочку, либо провести процесс настолько быстро, чтобы изменение температуры газа, обусловленное его теплообменом с окружающей средой, было пренебрежимо мало по сравнению с изменением температуры, вызванным расширением или сжатием газа. Как правило, это возможно, ибо теплообмен происходит значительно медленнее, чем сжатие или расширение газа.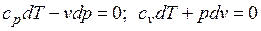 . Поделив первое уравнение на второе, получим
. Поделив первое уравнение на второе, получим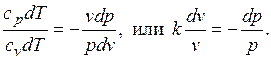
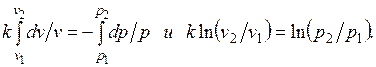
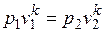 . *
. *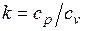

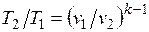 ;
;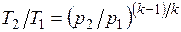 .
.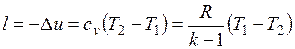 .
.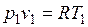 и
и 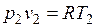 , то
, то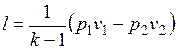 .
. показывает, что теплоемкость адиабатного процесса равна нулю.
показывает, что теплоемкость адиабатного процесса равна нулю.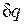 = 0, энтропия рабочего тела не изменяется (ds=0 и s=const). Следовательно, на Т,s-диаграмме адиабатный процесс изображается вертикалью.
= 0, энтропия рабочего тела не изменяется (ds=0 и s=const). Следовательно, на Т,s-диаграмме адиабатный процесс изображается вертикалью.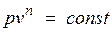 ,
,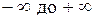 , но для данного процесса он является величиной постоянной.
, но для данного процесса он является величиной постоянной.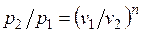 ;
; 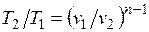 ;
; 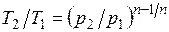 . (5.1)
. (5.1)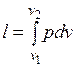 .
.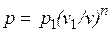 ,
,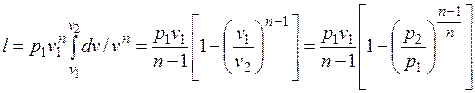 (5.2)
(5.2)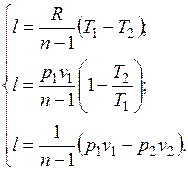
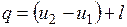 .
.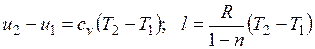 , то
, то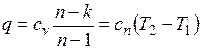 ,
,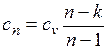
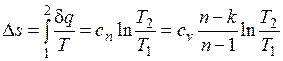 .
.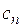
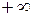
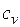
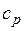
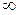

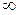 ) делит поле диаграммы на две области: процессы, находящиеся правее изохоры, характеризуются положительной работой, так как сопровождаются расширением рабочего тела; для процессов, расположенных левее изохоры, характерна отрицательная работа.
) делит поле диаграммы на две области: процессы, находящиеся правее изохоры, характеризуются положительной работой, так как сопровождаются расширением рабочего тела; для процессов, расположенных левее изохоры, характерна отрицательная работа.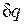 и du (а следовательно, и dT), имеют в этой области противоположные знаки. В таких процессах
и du (а следовательно, и dT), имеют в этой области противоположные знаки. В таких процессах 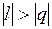 , поэтому на производство работы при расширении тратится не только подводимая теплота, но и часть внутренней энергии рабочего тела.
, поэтому на производство работы при расширении тратится не только подводимая теплота, но и часть внутренней энергии рабочего тела.






Новости и инфо для студентов