рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Физика
- /
- Квантові числа
Реферат Курсовая Конспект
Квантові числа
Квантові числа - раздел Физика, БУДОВА АТОМА І ПЕРІОДИЧНИЙ ЗАКОН Головне Квантове Число Визначає Повний Запас Енергії Електрона (Рівен...
Головне квантове число визначає повний запас енергії електрона (рівень енергії електронного шару), тобто ступінь віддалення його від ядра або розмір електронної хмари (орбіталі) і приймає значення 1, 2, 3, 4, 5, 6, 7 ..., які збігаються з нумерацією періодів у періодичній системі елементів Д. І. Менделєєва. Стан електрона, що характеризується певним значенням головного квантового числа, називають енергетичним рівнем електрона в атомі. Для енергетичних рівнів електрона в атомі, що відповідають різним значенням n прийняті позначення великими латинськими буквами.
Головне квантове число - 1, 2, 3, 4, 5, 6, 7...
Енергетичні рівні – K, L, M, N, O, P, Q...
Максимальна кількість енергетичних рівнів, яку може мати атом в основному стані, відповідає номеру періоду, в якому розміщений певний хімічний елемент.
Орбітальне квантове число l описує форму АО і уточнює енергетичну характеристику стану електрона – його підрівень, що позначається арабськими цифрами 0, 1, 2, 3,... або латинськими буквами s, p, d, f. Орбітальне квантове число може приймати значення від 0 до n-1. Для s-підрівня l=0, для p-підрівня l=1,для d-підрівня l=2, для f-підрівня l=3.
Можлива кількість підрівнів для кожного енергетичного рівня дорівнює номеру цього рівня, тобто головному квантовому числу. Так, на першому енергетичному рівні (n=1) може бути лише один підрівень з орбітальним квантом числом l=0. На другому енергетичному рівні (n=2) можуть бути два підрівні, яким відповідають орбітальні квантові числа l=0; 1. Третій енергетичний рівень (n=3) має три підрівні з відповідними орбітальними квантовими числами: l=0; 1; 2. На четвертому енергетичному рівні (n=4) можуть бути чотири підрівні, кожен з яких має своє значення орбітального квантового числа: l=0; 1; 2; 3.
Відповідно до квантово-механічних розрахунків s-орбіталі мають форму кулі (сферичну симетрію), р-орбіталі – форму гантелі, d – і f-орбіталі – складні форми.
Форми атомних орбіталей (АО), що відповідають різним значенням l наведено на рис. 1.1-1.3. Отже, енергетичний підрівень визначає стан електрона в атомі, що характеризується певним набором квантових чисел n і l, наприклад підрівень 4p: n=4, l=1; підрівень 5d: n=5, l=2 тощо.

ns-AO, nsl і ns2; n = 1,2,3,4, 5, 6,7; l = 0, тl = 0. Куля (кульова симетрія), всенапрямленність у просторі атома; позначається у графічних формулах як
| ; | ↑ | ; | ↑↓ |
Рис. 1.1.Електронна s-орбіталь і s-електрони

пр-АО, пр1 -пр6, п = 2, 3, 4, 5, 6, 7; l = 1, тl = -1, 0, +1. Гантелеподібні об'ємні фігури, напрямлені за осями координат, позначаються у графічних формулах як
| ↑ | ↑ | ↑ | ↑ | ↑ | ↑↓ | ↑↓ | ↑↓ |
тощо
Рис. 1.2. Електронні p-орбіталі і p-електрони
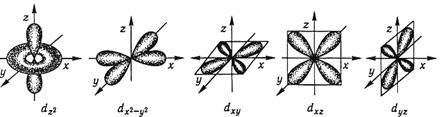
(n-l) d -AO; (n-1)dl - (n-1)d10, n = 4, 5, 6, 7; l = 2; ml = -2, -1, 0, +1, +2. Одна АО — фігура типу труби, замкненої в кільце (тор) з об'ємною гантеллю на осі z. Чотири АО — чотирилопатеві об'ємні фігури, лопаті яких лежать: однієї — на осях x і у (х2-y2), трьох інших — у квадрантах трьох координатних площин (ху, xz, yz) та ще одна фігура на осі z – dz2 . Позначаються у графічних формулах як
| ↑ | ↑ | ↑ | ↑ | ↑ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ |
тощо.
Рис.1.3. Електронні d-орбіталі і d -електрони.
Магнітне квантове число ml, визначає орієнтацію АО в просторі і змінюється від -l до +l, включаючи нульове значення. Магнітне квантове число визначає кількість АО на кожному підрівні: так s-підрівень характеризується однією кулястою атомною орбіталлю (l=0, ml=0); р-підрівень має три АО (l=1, ml=-1, 0, +1); d-підрівень має п’ять АО (l=2, ml=-2, -1, 0, +1, +2); f-підрівень має сім АО (l=3, ml=-3, -2, -1, 0, +1, +2, +3).
Слід зазначити, що кожну атомну орбіталь спрощено зображають як енергетичну комірку (квантову комірку) у вигляді □. Для s-електронів може бути лише одна енергетична комірка □; для р-електронів – три □□□ ; для d-електронів – п’ять □□□□□ ; для f-електронів – сім □□□□□□□ . Число енергетичних комірок визначається значенням магнітного квантового числа.
Спінове квантове число ms, характеризує власний момент кількості руху електрона і приймає значення +1/2 або -1/2. Спрощено спін (від англійського spin – крутіння, обертання) можна уявити як рух електрона навколо своєї осі. Спін зображають протилежно напрямленими стрілками: ↑;↓. Спіни електронів, напрямлені в один бік, називаються паралельними, у протилежні – антипаралельними.
– Конец работы –
Эта тема принадлежит разделу:
БУДОВА АТОМА І ПЕРІОДИЧНИЙ ЗАКОН
КРИВОРІЗЬКИЙ ТЕХНІЧНИЙ УНІВЕРСИТЕТ... КАФЕДРА ХІМІЇ... МЕТОДИЧНІ ВКАЗІВКИ БУДОВА АТОМА І ПЕРІОДИЧНИЙ ЗАКОН...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Квантові числа
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов