рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Физика
- /
- S 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d.
Реферат Курсовая Конспект
S 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d.
S 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d. - раздел Физика, БУДОВА АТОМА І ПЕРІОДИЧНИЙ ЗАКОН ...
|
Згідно з принципом Паулі в атомі не може бути двох електронів з однаковими значеннями всіх чотирьох квантових чисел.
Із цього виходить, що на кожній орбіталі, що характеризується певним значенням головного n, орбітального l і магнітного me квантових чисел, може знаходитися не більш двох електронів з протилежними спінами.
На основі принципу Паулі можна визначити максимально можливе число електронів на кожному енергетичному рівні і підрівні. Так, максимальне число електронів на s-підрівні є 2; р-підрівні – 6; d-підрівні – 10; f-підрівні – 14.
Максимальна кількість електронів на енергетичних рівнях визначається формулою:
N=2·n2, де n - головне квантове число.
N дорівнює: на першому рівні – 2; на другому – 8; на третьому – 18; на четвертому – 32.
З урахуванням кількості електронів на кожному підрівні ряд послідовності заповнення АО виглядає так:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10
У цьому запису арабська цифра перед символом підрівня показує енергетичний рівень, а “показник ступеня” при символі підрівня – число електронів на цьому підрівні.
Розподіл електронів на енергетичних рівнях і орбіталях для атомів елементів називається електронною конфігурацією, яку можна подати двома способами:
· у вигляді електронних формул, які є послідовним переліком позначень рівнів і підрівнів як тих, що повністю заповнені електронами, так і незавершених, наприклад, для Фосфору
15Р - 1s2 2s2 2p6 3s2 3p3.
· у вигляді електронно-графічних формул, які є графічним зображенням квантових комірок підрівнів відповідно до зростання їхньої енергії знизу вгору і розміщених на них стрілочок, напрям яких вказує орієнтацію спінів електронів. Наприклад, для Нітрогену 7N
| 2p3 | ||||
| 2s2 | ↑ | ↑ | ↑ | |
| 1s2 | ↑↓ | |||
| ↑↓ |
Згідно з правилом Гунда в межах енергетичного підрівня електрони в атомі розподіляються таким чином, щоб їх сумарний спін був максимальним. Наприклад, із трьох можливих варіантів розподілу трьох електронів на р-підрівні тільки третій відповідає цій умові:
| 1) | ↑↓ | ↑ | 2) | ↑ | ↑↓ | 3) | ↑ | ↑ | ↑ |
1)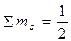 ;2)
;2)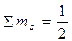 ; 3)
; 3)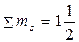 .
.
Правило Гунда показує послідовність заповнення орбіталей на кожному підрівні. Наприклад, р-підрівень заповнюється електронами в такій послідовності:
1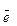
| ↑ | 2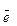
| ↑ | ↑ | 3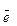
| ↑ | ↑ | ↑ | 4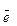
| ↑↓ | ↑ | ↑ | ||||
5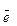
| ↑↓ | ↑↓ | ↑ | 6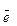
| ↑↓ | ↑↓ | ↑↓ | |||||||||
Із правила Гунда випливає, що стійким станам відповідають орбіталі і підрівні, які наполовину або повністю заповнені електронами.
Цим і пояснюються переходи (“провали”) електронів з вищих енергетичних рівнів на d-підрівень у атомів: Cr, Mo, Cu, Aq, Au та інші. Наприклад, для хрому (Z=24) електронна формула має вигляд
1s22s22p63s23p64s13d5 замість 1s22s22p63s23p64s23d4
“Провали” електронів характерні тільки для d-підрівнів і лише в тому випадку, коли для заповнення d-підрівнів наполовину або повністю не вистачає лише одного електрона.
На підставі аналізу електронних формул слід навчитися визначати період (за найбільшим головним квантовим числом), групу (за кількістю валентних електронів), підгрупу (за типом заповнення підрівня); s , р – головна підгрупа, d, f - побічна, а також металічність (неметалічність) елемента (у металів заповнюються s-, p- i d-підрівні, у неметалів – р-підрівень), вищу валентність (за кількістю валентних електронів), формулу оксиду і його характер. Розглянемо, наприклад, як охарактеризувати елемент з порядковим номером 23, електронна формула якого має вигляд:
23Е, 1s22s22p63s23p64s23d3
Електрони розташовані на чотирьох енергетичних рівнях. Таким чином, елемент знаходиться в четвертому періоді. У нього заповнюються d-орбіталі, тому елемент належить до d-елементів і входить до складу побічної підгрупи. Валентні електрони знаходяться на останньому і d-орбіталях передостаннього рівня. Всього валентних електронів п’ять, тому цей елемент належить до п’ятої групи. Мала кількість електронів на останньому рівні визначає природу елемента – він має металічний характер. Вища валентність дорівнює п’яти, таким чином, склад оксиду Е2О5. Оксиди металів з валентністю металу (V-VII) мають кислотний характер.
– Конец работы –
Эта тема принадлежит разделу:
БУДОВА АТОМА І ПЕРІОДИЧНИЙ ЗАКОН
КРИВОРІЗЬКИЙ ТЕХНІЧНИЙ УНІВЕРСИТЕТ... КАФЕДРА ХІМІЇ... МЕТОДИЧНІ ВКАЗІВКИ БУДОВА АТОМА І ПЕРІОДИЧНИЙ ЗАКОН...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: S 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d.
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов