рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Механика
- /
- Вид работы: Конспекты Лекций
- /
- Уравнение неразрывности для химически реагирующей смеси газов
Реферат Курсовая Конспект
Уравнение неразрывности для химически реагирующей смеси газов
Уравнение неразрывности для химически реагирующей смеси газов - Конспект Лекций, раздел Механика, Термодинамика. Конспект лекций ...

Рис. 1
Рассмотрим закономерности, которыми управляется плотность каждого компонента смеси идеальных газов, когда между ними идут химические реакции. По-прежнему рассматриваем стационарное и локально термодинамически равновесное течение смеси. Тогда (рис. 1):
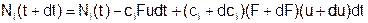
Здесь Ni – количество вещества i-й компоненты в рассматриваемом физическом теле - выделенном объеме активной среды, занимающем в момент времени «t» участок канала между сечениями «x» и «x+dx», а в момент «t+dt» - участок между «x+udt» и «x+dx+(u+du)dt». Раскрывая скобки и пренебрегая членами с порядком выше первого, получаем:
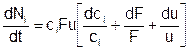
Уравнение такого вида имеет место для каждого из компонентов смеси, поэтому i=1,…,NC. Когда нет химических превращений, количество вещества в любом выделенном физическом теле сохраняется, и тогда получается обычное уравнение неразрывности:
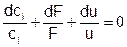
Количество вещества – это произведение мольной плотности на объем тела. Поэтому:
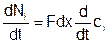
Подставляем:

Здесь временная производная от мольной плотности i-го компонента смеси – это субстанциональная производная, которая при отсутствии реакций равна нулю, а при их наличии определяется законом действующих масс.
Выпишем в общем виде произвольную систему реакций:

Здесь Ak – обозначение химического символа k-го компонента смеси, NC – количество компонент смеси, NR – количество реакций,  - левый стехиометрический коэффициент при k-м компоненте в j-й реакции,
- левый стехиометрический коэффициент при k-м компоненте в j-й реакции, 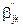 - аналогичный правый стехиометрический коэффициент, kj – константа скорости j-й реакции. В соответствии с законом действующих масс скорость j-й реакции, то есть количество молей i-го компонента, вырабатываемого в каждой реакции в единице объема в единицу времени, пропорционально произведению концентраций реагентов и константе скорости реакции. Поэтому [1]:
- аналогичный правый стехиометрический коэффициент, kj – константа скорости j-й реакции. В соответствии с законом действующих масс скорость j-й реакции, то есть количество молей i-го компонента, вырабатываемого в каждой реакции в единице объема в единицу времени, пропорционально произведению концентраций реагентов и константе скорости реакции. Поэтому [1]:
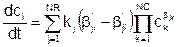
Подставляя, получаем:
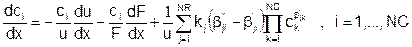
Это – искомое уравнение неразрывности для одномерного стационарного потока химически реагирующей смеси газов, которое выражает изменение мольной плотности i-го компонента как за счет движения смеси в канале (первые два члена в правой части), так и за счет химических превращений (третий член).
– Конец работы –
Эта тема принадлежит разделу:
Термодинамика. Конспект лекций
Термодинамика активных сред химических лазеров. Конспект лекций. Составитель: Д.т.н., профессор А.В. Савин...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Уравнение неразрывности для химически реагирующей смеси газов
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов