рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Механика
- /
- Вид работы: Конспекты Лекций
- /
- Термодинамика диссоциации йода
Реферат Курсовая Конспект
Термодинамика диссоциации йода
Термодинамика диссоциации йода - Конспект Лекций, раздел Механика, Термодинамика. Конспект лекций ...
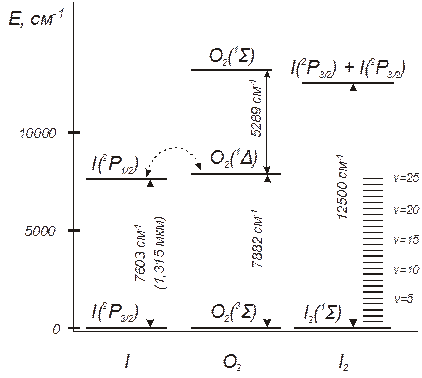
Рис 1. Диаграмма энергетических состояний атома йода и молекулы синглетного кислорода
Медленная стадия
Быстрая стадия
Стадия насыщения
Диссоциация молекулярного йода в соответствии с общепринятой моделью идет по двухстадийной схеме. На первой («медленной») стадии происходит прямая диссоциация молекулярного йода:
O2(1D)+O2(1D)®O2(1S)+O2(3S); k1=2.5∙10-17 см3/с
I2+O2(1S)®2I+O2(3S); k11=4.0∙10-12 см3/с
При этом возникает небольшое количество атомарного йода, необходимое для инициации цепного процесса (вторая, «быстрая» стадия):
I+O2(1D)↔I*+O2(3S); k19=7.8∙10-11 см3/с, Ke=0.75exp(402/T)
I2+I*®I+I2*; k14=3.5∙10-11 см3/с
I2+O2(1D)®I2*+O2(3S); k13=7.0∙10-15 см3/с.
Брутто-реакция диссоциации йода записывается в виде:
 , ,
|
где n - число молекул синглетного кислорода, необходимых для диссоциации одной молекулы йода. Очевидно, что n>1, т. к. удельная энергия диссоциации молекулярного йода - 35 ккал/моль - больше энергии возбуждения СК - 22.5 ккал/моль [41]. В зависимости от концентрации частиц-тушителей и способа организации рабочего процесса n~5¸10.
По современным представлениям, промежуточным звеном в цепочке реакций диссоциации являются молекулы йода в основном электронном, но высоковозбужденном колебательном состоянии I2* (20<v<40) – см. рис. 1. Разрабатываются и более сложные схемы диссоциации молекулярного йода, включающие реакции с участием колебательно-возбужденного кислорода. Однако в настоящее для условий СБ ХКИЛ апробирован и хорошо себя зарекомендовал именно изложенный выше механизм.
Кроме того, в активной среде ХКЙЛ имеет место тушение возбужденных частиц на различных примесях: парах H2O и H2O2, Cl2, молекулах буферных газов и продуктов интергалогенных реакций, а также на стенках (см. таблицу 1.1). Наиболее сильным тушителем являются молекулы воды.
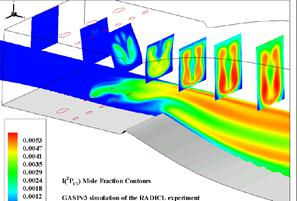
Рис. 2. Структура течения в сопловом аппарате ХКИЛ пр использовании гелия в качестве буферного газа.
В сопловых блоках ХКИЛ все перечисленные реакции идут в процессе смешения йодного и кислородного потоков, на фоне неравномерного распределения концентраций компонент (рис. 1.6), причем характерные времена выравнивания концентраций имеют тот же порядок величин, что и времена протекания реакций. Поэтому механизм смешения имеет большое значение для эффективной работы лазера.
Выделение тепла происходит в основном за счет взаимодействия синглетного кислорода, атомарного йода и основного «тушителя» - воды [41] по схеме:
I+O2(1D)→I*+O2(3S);
I*+H2O→I+H2O
Один из важных лимитирующих факторов, определяющих эффективность ХКЙЛ - потери синглетного кислорода при диссоциации молекулярного йода. Кинетический механизм диссоциации йода до сих пор изучен не до конца и вызывает оживленные дискуссии, продолжаются исследования, как в нашей стране, так и за рубежом. Однако для целей газодинамического моделирования существует определенная общепринятая кинетическая модель. Согласно этой модели, на первой стадии основную роль играет прямая диссоциация молекулы йода: I2+O2(1S)→2I+O2(1D). Эта стадия протекает достаточно медленно, поскольку концентрация сигма-кислорода O2(1S) мала и константа скорости реакции также невелика. После того, как концентрация атомов йода станет заметной, начинается вторая, быстрая стадия диссоциации, на которой атомы йода играют роль транспортного канала при передаче энергии молекулярному йоду:
| I+O2(1D)→I*+O2(3S) I*+I2→I+I2* I2*+O2(1D)→2I+O2(3S) |
Cчитается, что в процессе диссоциации молекулярного йода на каждую молекулу йода расходуется 5-6 молекул синглетного кислорода, хотя на быстрой стадии, исходя из приведенной схемы, теоретически достаточно двух молекул. Остальные потери происходят по двум причинам.
Во-первых, пока йодный и кислородный потоки не до конца перемешаны, существуют зоны с высокой локальной концентрацией молекулярного йода, в которых синглетный кислород полностью тушится, например, по схеме:
| O2(1D)+I→O2(3S)+I*, k=7.8*10-11 I*+I2®I2*+I, k=3.5*10-11 I2*+N2→I2+N2, k=9*10-12 |
Во-вторых, пары воды, всегда присутствующие в активной среде лазера с химическим генератором синглетного кислорода, являются тушителем возбужденных атомов йода, и до тех пор, пока в потоке есть синглетный кислород, работает соответствующий канал тушения.
Поэтому чем быстрее происходит перемешивание йодного и кислородного потоков, тем меньше потери синглетного кислорода и, в итоге, выше эффективность ХКЙЛ. С другой стороны, для создания достаточного «затравочного» количества атомов йода –для эффективного запуска быстрой стадии диссоциации - необходимо обеспечить определенное время первоначального контакта высококонцентрированных потоков йода и синглетного кислорода. Отсюда понятно то внимание, которое уделяется вопросам смешения при приготовлении активной среды. Газодинамическое расширение, необходимое для получения высокого усиления и подавления тушения по каналу (1.2), с другой стороны, затрудняет смешение и тем самым увеличивает потери по каналу (1.4). Таким образом, существует тесная взаимная связь газодинамического процесса – перемешивания кислородного и йодного потоков с сопловом аппарате ХКИЛ – и физико-химического процесса получения атомарного йода.
Модель кинетики диссоциации йода
Таким образом, диссоциация молекулярного йода при его смешении с синглетным кислородом происходит в три стадии. На первой, медленной стадии преобладает прямая диссоциация. На второй стадии работает цепной, автокаталитический механизм. На третьей стадии происходит замедление процесса из-за выработки молекулярного йода.
1. Медленная стадия
| № | Реакция | Скорость реакции, см3/с |
| 1 | O2(1D)+O2(1D)®O2(1S)+O2(3S) | 2.5∙10-17 или 9.5×10-28×T3.8´exp(700/T) |
| 2 | O2(1D)+O2(1D)®O2(3S)+O2(3S) | 1.8∙10-17 |
| 3 | O2(1S)+O2(3S)®O2(1D)+O2(3S) | 3.9∙10-17 |
| 4 | O2(1S)+H2O®O2(1D)+H2O | 6.7∙10-12 |
Для оценки скорости диссоциации на медленной стадии определяется концентрацией кислорода в состоянии O2(S). Она, в свою очередь, определяется равновесием между процессами пулинга:
1. O2(D)+O2(D)®O2(S)+O2(3S)
и тушения:
4. O2(S)+H2O®O2(D)+H2O
Запишем уравнение закона действующих масс, и, решив его, найдем установившееся значение концентрации O2(S) и характерное время его установления:

Будем считать, что все концентрации, кроме [O2(S)] – и [O2(D)], и [H2O] – постоянны:

Подставляем:

Установившаяся (квази-равновесная) концентрация O2(S), достигающаяся, когда d/dt=0:
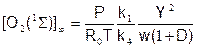
Время релаксации этого процесса, или характерное время, за которое устанавливается квази-равновесная концентрация O2(S), равно обратному значению коэффициента при [O2(S)] в полученном дифференциальном уравнении:

Пользуясь значением константы скорости k4 из приведенной выше таблицы и введенными ранее правилами пересчета, можно вычислить, что для характерных условий диссоциации молекулярного йода в COIL (P~10 Торр, T~250К, w~0,05, D~3) значение времени релаксации концентрации O2(S), равно около 30 мкс. Время очень маленькое – за это время поток, движущийся со скоростью 100 м/с, проходит 3 мм. В реальном сопловом канале, характерные продольные размеры которого составляют десятки миллиметров, можно считать, что концентрация O2(S) в каждой точке равна своему локальному равновесному значению.
Имея концентрацию O2(S), можно вычислить скорость реакции прямой диссоциации йода:
11. I2+O2(1S)®2I+O2(3S); k11=4.0∙10-12 см3/с
А именно:

Подставляем выражения для концентраций:

Здесь i – степень диссоциации йода, то есть доля молекул йода, распавшихся на атомы. Имея в виду, что на начальной стадии диссоциации i<<1, что позволяет пренебречь величиной I в правой части, а также сокращая все что можно, получаем:

Это означает, что на медленной стадии степень диссоциации и концентрация атомарного йода растут линейно во времени.
2. Быстрая стадия
| № | Реакция | Скорость реакции, см3/с |
| 19 | I+O2(1D)®I*+O2(3S) | 7.8∙10-11 |
| 20 | I*+O2(3S)®I+O2(1D) | 1.0277´10-10´exp(-401.4/T) |
| 14 | I2+I*®I+I2* | 3.5∙10-11 или 3.89×10-11´exp(835/T) |
| 15 | I2*+O2(D)®2I+O2(3S) | 3.0∙10-10 |
Быстрая стадия так называется не потому, что там скорость диссоциации всегда быстрее, а потому, что она ускоряет сама себя. Действительно, скорость возбуждения молекул йода пропорциональна концентрации атомарного йода.
– Конец работы –
Эта тема принадлежит разделу:
Термодинамика. Конспект лекций
Термодинамика активных сред химических лазеров. Конспект лекций. Составитель: Д.т.н., профессор А.В. Савин...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Термодинамика диссоциации йода
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов