рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Механика
- /
- Вид работы: Конспекты Лекций
- /
- Термодинамика. Конспект лекций
Реферат Курсовая Конспект
Термодинамика. Конспект лекций
Термодинамика. Конспект лекций - Конспект Лекций, раздел Механика, Бгту «Военмех» Кафедра И1 Термодинамика...
БГТУ «Военмех»
Кафедра И1
Термодинамика
активных сред химических лазеров
Конспект лекций
Составитель:
Д.т.н., профессор А.В. Савин
Санкт-Петербург
2013 г.
Содержание
Введение. 3
1. Уравнения, описывающие одномерное стационарное движение термодинамически идеального газа 8
1.1. Понятие о термодинамически идеальном (совершенном) газе. Смесь газов. 8
1.2. Уравнение неразрывности. 11
1.3. Уравнение движения. 12
1.4. Уравнение энергии. 13
1.5. Система уравнений стационарного одномерного адиабатического потока совершенного газа 15
2. Состав активной среды кислородно-йодного лазера (COIL) 17
3. Кинетика активной среды кислородно-йодного лазера. 18
4. Динамика активации йода. 20
5. Взаимодействие электромагнитного поля с активной средой химического лазера. 23
5.1. Коэффициент усиления слабого сигнала. 23
5.2. Динамика релаксации коэффициента усиления, время релаксации, равновесный коэффициент усиления. 25
5.3. Баланс энергии электромагнитного поля в простейшем плоскопараллельном резонаторе 29
5.4. Стационарный режим генерации малой интенсивности. 33
5.5. Стационарный режим генерации конечной интенсивности. 34
6. Функциональная схема COIL.. 36
7. Динамика выработки синглетного кислорода в процессе излучения. Понятие о широкоапертурном резонаторе. 37
8. Уравнение энергии для стационарного одномерного адиабатического движения химически реагирующей термодинамически равновесной смеси идеальных газов. 38
Вариант 1. 38
Вариант 2. 43
9. Уравнение неразрывности для химически реагирующей смеси газов. 46
10. Замкнутая система уравнений, описывающая одномерное стационарное движение химически реагирующей смеси совершенных газов. 48
11. Термодинамика диссоциации йода. 49
Термины: 54
Приложение 1. Контрольные вопросы.. 55
Приложение 2. Физматминимум.. 57
Приложение 3. Физико-химический рабочий процесс формирования активной среды ХКИЛ – газофазные химические реакции. 59
Приложение 4. План расширенного курса газотермодинамики мощных химических лазеров 60
Литература: 62
Введение
1. Введение
Разработка мощных лазеров уже более 30 лет, начиная с самого момента изобретения лазера в 1960 г., находятся на переднем крае научно-технического прогресса в оборонных технологиях. Главная причина этого в фундаментальном преимуществе лазеров – принципиальной возможности практически мгновенной доставки большой энергии на расстояния глобального масштаба.
Однако обратной стороной этих преимуществ являются столь же фундаментальные ограничения. Действительно, доставка энергии на большие расстояния и концентрация ее на достаточно малом пространстве требует малой длины волны. Только в последние несколько лет, с появлением зрелых технологий мощных коротковолновых химических лазеров, а именно – кислородно-йодных лазеров (COIL) - эта задача стала действительно реальной.
В 70-е и 80-е годы теоретические, экспериментальные и опытно-конструкторские работы были сосредоточены вокруг газодинамического СО2-лазера, создающего излучение 10-микронного диапазона. Для таких систем энергетическая эффективность, измеряемая как степень преобразования химической энергии топлива в энергию излучения, невелика – 2¸3%. Скорость потока соответствует числу Маха 4¸5, что при температуре торможения 1500¸1700К означает более 1000 м/с. Давление в резонаторной полости – несколько десятков мм. рт. ст. (Торр). В таких условиях газодинамические процессы не испытывают практически никакого влияния со стороны электромагнитного поля резонаторной моды. Напротив, оптическое качество излучения в значительной степени определяется неоднородностями показателя преломления активной среды. Экспериментальные и опытно-конструкторские работы привели к созданию лабораторных СО2-лазеров мегаваттного класса [1] и к успешной демонстрации возможности интеграции лазерного комплекса воздушного базирования [2].
В 80-е и 90-е годы, с развитием технологий более коротковолновых химических HF/DF лазеров, работы по мощным лазерам были ориентированы как на HF-лазеры космического базирования и задачи стратегической обороны, так и на DF-лазеры наземного базирования и задачи ПВО. Это привело к созданию демонстрационных лазерных комплексов мегаваттного класса – NACL [3], THEL [4] – и ряду успешных демонстрационных экспериментов по перехвату воздушных целей [2].
Для таких лазеров тепловая энергия, выделяющаяся в процессе химических реакций, приводит к торможению сверхзвукового потока активной среды. Для HF-лазеров низкого давления этот процесс контролируется в основном кинетикой реакции горения вторичного горючего H2+F®HF(v)+H. Для DF-лазеров с более высоким давлением активной среды интенсивность выделения тепла определяется смешением потоков окислителя и вторичного горючего. При проектировании газодинамического тракта и системы восстановления давления процессы, приводящие к выделению тепла, играют важную роль [5]. Из-за достаточно большой длины волны – 3.8 мкм - неоднородности активной среды не приводят к катастрофической потере оптического качества [6]. С другой стороны, большая длина волны не позволяет сфокусировать излучение в пятно малого размера на больших дистанциях. Поэтому по современным представлениям оптимальной областью применения DF-лазеров являются приземные слои атмосферы с сильной турбулентностью (высоты трасс до100-200 м над уровнем моря) при дальностях до 10-15 км.
Излучение COIL генерируется в результате электронных переходов атома йода, и это отличает его от всех других типов непрерывных химических газовых лазеров, в которых используются колебательно-вращательные переходы. Поэтому длина волны излучения COIL – 1.315 мкм – меньше, чем у любого другого мощного непрерывного лазера, и это определяет его главное преимущество. В 2000-е годы работы по COIL подошли к такому уровню зрелости, что появилась возможность создания мобильных демонстрационных лазерных комплексов. В 2001 г. в России был построен COIL 10-киловаттного класса, использующий азот в качестве буферного газа [7]. Впоследствии на этой установке были получены рекордные значения химической эффективности [8].
Фундаментальные преимущества COIL связаны не только с малой длиной волны, но и с высокой оптической однородностью активной среды, а также с высокой энергетической эффективностью. Это позволяет получать мощное коротковолновое излучение высокого оптического качества.
Теоретический анализ, а также результаты опубликованных в открытой литературе экспериментов показывают, что целый ряд специальных задач могут решаться с помощью кислородно-йодных лазеров более эффективно, чем с помощью других видов оружия [9]. В том числе ставятся задачи стратегической противоракетной обороны [10].
Появление COIL создало новые возможности, однако для их правильного использования необходимо учитывать все особенности этого типа лазеров. Поэтому одной из задач настоящего пособия является изложение и обобщение системы моделей, необходимых для обоснования возможностей применения кислородно-йодного лазера в качестве элемента различных прикладных лазерных систем.
Химические газовые лазеры являются одним из наиболее сложных технических объектов, созданных в период бума высоких технологий. Это вызвано уникальной комплексностью физических процессов, определяющих функционирование химического газового лазера. Процессы физической оптики активной среды, оптики атмосферы, химической кинетики, теплофизики, механики твердого тела, и, наконец, газовой динамики связаны в единый и неразрывный комплексный процесс.
Однако газовая динамика активных сред занимает все же особое место. Она остается наименее изученной областью, несмотря на усилия большого количества исследователей. Подобная ситуация сложилась во многом по объективным причинам. Действительно, процессы физической оптики активных сред и лазерных резонаторов адекватно описываются в рамках, например, скалярной теории дифракции. Химическая кинетика активных сред удовлетворительно описывается локально-равновесными или квази-равновесными теориями, и аррениусовская форма для констант скоростей реакций прекрасно работает. Существуют, конечно, неисследованные вопросы кинетических механизмов реакций, но они не мешают в известных пределах использовать апробированные кинетические схемы. Что касается теплофизики и механики твердого тела, то, несмотря на большие инженерные сложности, в принципиальном плане эти процессы абсолютно ясны. Классическая теория упругости, сопряженные постановки задач для уравнения теплопроводности и соответствующие вычислительные алгоритмы являются ныне обычным инструментом, находящимся на рабочем столе каждого конструктора-механика.
В то же время в газовой динамике отсутствуют столь же апробированные и надежные модели, описывающие переходные и турбулентные течения многокомпонентных и многофазных реагирующих сред. Несмотря на существование доступных мультифизичных коммерческих CFD-пакетов и большого опыта разработки исследовательских программных продуктов, моделирование процессов газовой динамики лазерных активных сред остается в значительной степени искусством.
В свете сказанного представляется вполне закономерным, что в истории развития химических лазеров, и особенно COIL, наступил такой момент, когда проблемы газовой динамики стали критическим звеном.
Особенности этих проблем заключаются в следующем:
Во-первых, физико-газодинамические явления, связанные с течением пространственно-неоднородных химически реагирующих сред и сопровождающие приготовление активной среды COIL, определяют как энергетическую эффективность лазера, так и оптическое качество излучения. Низкий коэффициент усиления, вызванный малой плотностью активной среды, является основным препятствием для получения одномодового излучения с малой угловой расходимостью. Путь увеличения коэффициента усиления – управление процессом смешения компонент активной среды, когда требуется одновременно увеличить две взаимоисключающие характеристики: степень диссоциации йода и концентрацию синглетного кислорода. Для этого необходимо обеспечить оптимальное время перемешивания и высокую однородность смеси. С другой стороны, двухстадийный характер кинетики диссоциации йода в присутствии синглетного кислорода требует соответствующей двухстадийной организации смешения. Решение этой проблемы требует глубокого понимания пространственно-временной структуры турбулентного течения, формирующегося в процессе приготовления активной среды COIL.
Во-вторых, необычные физико-химические свойства отработанной активной среды COIL, прежде всего большая остаточная энергия синглетного кислорода, делают очень сложной задачу ее утилизации. Турбулентное течение активной среды в сверхзвуковом диффузоре, сопровождающееся образованием скачков уплотнения, вязко-невязким взаимодействием и релаксацией остаточной энергии электронно-возбужденных состояний, принципиально отличается от течений в диффузорах лазеров других типов. При этом эффективность диффузора во многом определяет внешний облик, массогабаритные и технико-экономические параметры всей лазерной установки [11, 12].
Рассмотрим основные факторы, определяющие характер газодинамических процессов в химической лазерной установке со сверхзвуковым потоком активной среды. Таких факторов два: характерная скорость релаксации инверсии и температурный фактор.
По скорости релаксации все возможные случаи делятся на два класса.
1. Для систем с быстрой кинетикой (например, непрерывный химический DF-лазер с высоким давлением активной среды) характерное время релаксации tr значительно меньше, чем газодинамическое транспортное время tg=L/U (L – длина резонаторной полости вдоль потока, U – скорость активной среды). Соответствующий безразмерный критерий – число Дамкеллера Da=tr/tg=trU/L<<1. В этом случае формирование активной среды управляется смешением компонент. Поэтому, в частности, активная среда в принципе не может быть оптически однородной.
2.В системах со сравнительно медленной кинетикой (Da³1) ситуация обратная. Например, для активной среды COIL основные процессы – это диссоциация йода I2+O2(1D)®I2*+O2(3S); I2*+O2(1D)®2I+O2(3S) и накачка: I+O2(1D)®I*+O2(3S). Характерные времена этих процессов определяются концентрациями компонент и скоростями реакций. В типичных условиях активной среды кислородно-йодного лазера эти времена имеют тот же порядок, что и газодинамическое время. Для этого случая оптимальным представляется полное перемешивание компонент активной среды до того, как среда поступит в полость оптического резонатора. Поэтому среда COIL при условии правильной организации смешения является оптически однородной, как в смысле рефракции, так и в смысле плотности инверсии.
Температурный фактор определим как отношение энергии лазерного перехода к полному теплосодержанию среды:
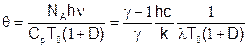
где h, c, k, NA – постоянная Планка, скорость света, постоянная Больцмана и число Авогадро, Cp – мольная теплоемкость среды, l, T0 – длина волны и температура торможения, D – степень разбавления активной среды буферным газом. Рассматривая различные химические проточные лазерные системы, по величине температурного фактора можно выделить два полярных случая.
1. В случае СО2-ГДЛ или HF/DF-НХЛ среда имеет большую температуру торможения, в то время как энергия лазерного перехода невелика, поэтому q<<1. Эффективность лазерной генерации, и даже ее наличие или полное отсутствие, не оказывает заметного влияния на газодинамические процессы.
2. Для COIL ситуация качественно иная. При температуре торможения около 300К и длине волны, соответствующей ближнему инфракрасному диапазону, температурный фактор значительно больше единицы. При наличии лазерной генерации энергия, запасенная в электронно-возбужденном состоянии кислорода, изымается из среды электромагнитным полем. В противном случае эта энергия полностью преобразуется в тепло, что приводит к существенному росту температуры торможения, статического давления и уменьшению коэффициента усиления. При газодинамическом моделировании такого течения в уравнении энергии необходимо учитывать источники тепла, интенсивность которых определяется кинетикой протекающих химических реакций и взаимодействием среды с излучением.
Физически эти явления приводят к тому, что газодинамический режим течения среды в полости резонатора и в сверхзвуковом диффузоре качественно изменяется при изменении эффективности генерации. В свою очередь, и эффективность генерации излучения зависит от режима течения активной среды. Это означает, что в системе существует сильная положительная обратная связь между оптическими и газодинамическими процессами.
Таким образом, течение активной среды COIL характеризуется следующими особенностями, отличающими его от других типов химических проточных газовых лазеров:
- Сравнительно медленная кинетика активной среды, что создает принципиальную возможность получения высокой оптической однородности. Однако для этого необходимо разработать эффективные газодинамические схемы смешения, позволяющие перемешать компоненты среды COIL до поступления в полость оптического резонатора, обеспечить высокую степень диссоциации йода и малые потери синглетного кислорода.
- Сильная взаимосвязь газодинамических, химических и оптических процессов в активной среде, являющаяся платой за высокую энергетическую эффективность. Эта взаимосвязь означает сильную зависимость газодинамического режима течения активной среды от эффективности лазерной генерации. Наличие такой зависимости определяет возникновение мощных положительных обратных связей, неустойчивостей и многозначности газодинамического режима.
Одной из основных задач настоящего учебного пособия является последовательное описание физико-химических и газодинамических процессов в активной среде кислородно-йодного лазера на единой методической основе, построение и обоснование их математических моделей.
Таким образом, задачами настоящего учебного пособия и соответствующего учебного курса являются:
- Построение и обоснование системы моделей, необходимых для понимания рабочих процессов кислородно-йодного лазера, а также для обоснования возможностей применения кислородно-йодного лазера в качестве элемента лазерных систем прикладного назначения;
- Последовательное описание физико-химических и газодинамических процессов в активной среде кислородно-йодного лазера на единой методической основе, построение и обоснование их математических моделей.
Уравнения, описывающие одномерное стационарное движение термодинамически идеального газа
В качестве отправной точки для моделирования процессов в газовых химических лазерах удобно использовать одну из простейших газодинамических моделей – одномерное стационарное движение термодинамически равновесной смеси идеальных газов.
Поясним подробно, в чем заключается смысл этой модели.
Понятие о термодинамически идеальном (совершенном) газе. Смесь газов.
Газ движется по каналу с произвольной формой поперечного сечения. Все параметры (скорость, давление, температура, плотность) равномерно распределены… Стационарное движение: Систему координат, связанную со стенками канала, будем называть «лабораторной». Если движение стационарно, то в каждой…
Уравнение неразрывности
Рис. 1. В начальный момент времени t выделим массу газа, находящуюся между сечениями канала «x» и «x+dx». Эта масса…
Уравнение движения
Снова рассмотрим элемент канала с бесконечно малой длиной dx (рис. 1). В начальный момент времени t выделим массу газа, находящуюся между сечениями… На левой границе выделенного объема параметры равны {u, r, P, T}. На правой границу – {u+du, r+dr, P+dP, T+dT}, причем…
Уравнение энергии
где dQ – количество тепла, переданное телу от внешнего мира, dA – работа,… Мы рассматриваем адиабатическое движение газа по каналу, то есть такое движение, в процессе которого газ не…
Система уравнений стационарного одномерного адиабатического потока совершенного газа
Зависимость площади сечения канала от продольной координаты F(x) – известная… Самостоятельно: привести к каноническому виду
Состав активной среды кислородно-йодного лазера (COIL)
Выражения для концентраций молекул кислорода:
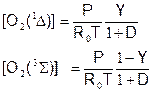
выражения для концентраций атомов йода:
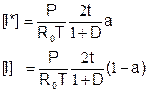
Кинетика активной среды кислородно-йодного лазера
Константа скорости реакции Сечение реакции Пусть в смеси газов идет реакция, в результате которой одни компоненты смеси преобразуются в другие. Это может быть…
Динамика активации йода
Динамика активации йода Равновесная активация Время релаксации активации
Взаимодействие электромагнитного поля с активной средой химического лазера
Коэффициент усиления слабого сигнала
Рис. 1. Найдем выражение для коэффициента усиления через параметры состава среды.…
Динамика релаксации коэффициента усиления, время релаксации, равновесный коэффициент усиления
Рассмотрим самые существенные из них: Первая реакция – это процесс накачки, в котором молекула синглетного кислорода передает энергию…
Баланс энергии электромагнитного поля в простейшем плоскопараллельном резонаторе
Пусть одно из зеркал (левое на рис. 1) – «глухое», т.е. имеет нулевой коэффициент пропускания t=0. Другое зеркало – «выходное» - имеет коэффициент… Рис. 1.
Стационарный режим генерации малой интенсивности
Тогда в выражение последнее из предыдущего параграфа можно подставить выражение для степени активации, полученное исходя из рассмотрения динамики… Это справедливо, когда интенсивность поля в резонаторе близка к нулю, и при этом имеет место равновесие между малой…
Стационарный режим генерации конечной интенсивности
То же самое можно проделать и в режиме поля конечной интенсивности, не делая никакого предположения относительно того, влияет или не влияет… Закон действующих масс позволяет выписать уравнение для стационарной концентрации возбужденных атомов йода:
Функциональная схема COIL
Оптический резонатор
Газодинамический тракт
Генератор синглетного кислорода
СПРТ
Система наведения
Динамика выработки синглетного кислорода в процессе излучения. Понятие о широкоапертурном резонаторе
Уравнение энергии для стационарного одномерного адиабатического движения химически реагирующей термодинамически равновесной смеси идеальных газов
Вариант 1
Модель термодинамически равновесной смеси идеальных газов можно использовать, когда характерные времена изменения макроскопического состояния среды много больше времени установления равновесного статистического распределения. Тогда все компоненты смеси, каждый из которых представляет собой совершенный газ, имеют одну и ту же температуру.
Уравнение состояния такой смеси можно записать в виде:

где c [моль/м3] – мольная «плотность» смеси, являющаяся суммой мольных плотностей компонент:
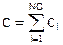
где NC – количество компонент смеси.
Когда идут химические реакции, то, поскольку меняется состав смеси, вообще говоря, меняются молекулярный вес смеси, теплоемкость и показатель адиабаты, в то время как молекулярные веса, теплоемкости и показатели адиабаты компонент смеси - постоянны. Рассмотрим, каким образом параметры смеси связаны с параметрами отдельных компонент.
Поскольку массовая и мольная плотности связаны через молекулярную массу: r=mc; ri=mici; а плотность смеси есть сумма плотностей компонент, то:
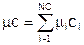
Тогда молекулярная масса смеси:

Объемная теплоемкость смеси (Cpc [Дж/м3К]) есть сумма объемных теплоемкостей компонент:
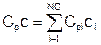
Тогда мольная теплоемкость смеси:

Аналогичное соотношение имеет место и для теплоемкости при постоянном давлении. В этом параграфе обозначение Cp, Cv используется для мольных теплоемкостей, Cpm, Cvm – для массовых.
Основа уравнения энергии – первый закон термодинамики, который для адиабатического процесса можно выразить следующим образом:

где dU – изменение внутренней энергии тела, dK – изменение кинетической энергии макроскопического движения тела, dA – работа внешних сил, совершаемая над телом. В качестве рабочего тела рассмотрим элемент среды, который в момент времени «t» занимает участок канала в промежутке между «x» и «x+dx»:

Рис. 1
Работа внешних сил: dA=PFudt-(P+dP)(F+dF)(u+du)dt, или, с точностью до членов второго порядка малости,
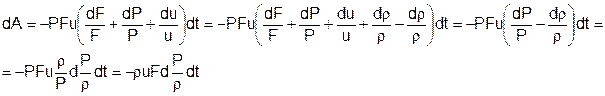
Здесь использован закон сохранения массы:
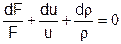
Внутренняя энергия выделенного тела – это в данном случае сумма энергии хаотического теплового движения молекул (тепловой энергии) и энтальпии образования h0 (иначе говоря, энергии, затраченной на создание молекул данного вещества из простых веществ, энтальпия образования которых считается равной нулю). Поскольку мы рассматриваем движение среды в сочетании с химическими преобразованиями, то энтальпия образования должна быть учтена в составе внутренней энергии. Когда рассматривается движение среды без химических преобразований, энтальпия образования не высвобождается, поэтому соответствующая часть внутренней энергии может не учитываться. Итак:

Здесь CvmT+h0m – внутренняя энергия единицы массы смеси, Cvm – массовая теплоемкость смеси при постоянном объеме, h0m – энтальпия образования единицы массы смеси. С точностью до членов второго порядка малости:
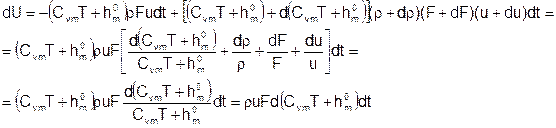
Изменение кинетической энергии выделенного тела:

Подставляем:
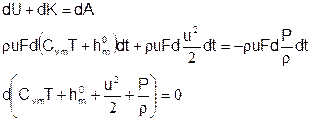
Из уравнения состояния смеси: P=rRT (R=R0/m - индивидуальная газовая постоянная, m - молекулярная масса смеси): P/r=RT=(Cpm-Cvm)T. Подставляем:
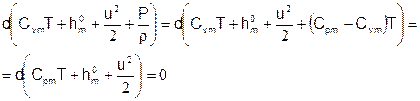
Необходимо обратить внимание на разницу между пространственными и временными производными. Поскольку рассматривается стационарное одномерное течение, то имеется всего одна независимая переменная – пространственная координата «x», отсчитываемая по направлению движения среды. Когда встречается запись типа d(*) – это означает дифференциал какой-либо величины, соответствующий бесконечно малому изменению этой независимой переменной – «dx».
В то же время выделенное физическое тело движется, и его параметры меняются во времени. Соответствующая временная производная является субстанциональной, то есть берется в системе координат, связанной с движущейся средой, и, вообще говоря, не равна нулю в стационарном потоке. В отличие от нее частная производная по времени, которая берется при постоянном значении пространственной координаты «x», везде равна нулю в силу предположения о стационарности потока.
Когда отсутствуют химические превращения, состав смеси не меняется в процессе движения, и энтальпия образования единицы массы смеси постоянна. Поэтому последнее уравнение упрощается:
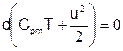
В этом случае и теплоемкость также постоянна, поэтому:

Получаем уравнение энергии нереагирующего совершенного газа в адиабатическом движении, выражающее факт сохранения полной энтальпии Hm=CpmT+u2/2.
В случае, когда имеют место химические превращения, понятие полной энтальпии необходимо обобщить, включив в нее энтальпию образования: Hm=CpmT+h0m+u2/2. Сам принцип сохранения полной энтальпии остается неизменным.
Теперь вернемся к обобщенному закону сохранения полной энтальпии и разберемся, как связаны параметры смеси: массовая теплоемкость Cpm и энтальпия образования h0m с изменяющимся составом смеси. Это необходимо сделать, поскольку неизвестные, относительно которых желательно записать окончательные уравнения – это P, T, u, а также параметры, характеризующие состав смеси. Состав смеси удобно описывать мольными плотностями компонент {ci}. Это так, поскольку изменение состава смеси в процессе химических превращений, которое необходимо будет также каким-то образом включить в окончательные уравнения, удобнее всего описывается в терминах именно мольных плотностей. Итак, необходимо выразить Cpm и h0m через мольные плотности {ci} и параметры компонент смеси – молекулярные веса и теплоемкости. Итак, во-первых, выразим производную от массовой теплоемкости через производные от мольных плотностей компонент смеси:
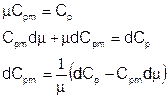
Мольная теплоемкость смеси:
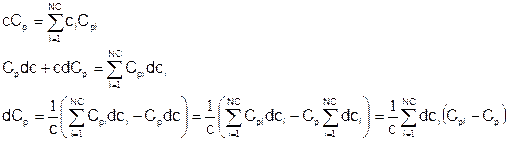
Аналогично, молекулярная масса смеси:

Подставляя, получаем выражение для производной от массовой теплоемкости:
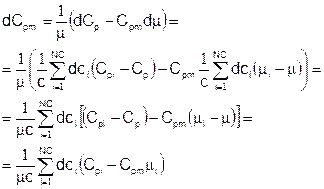
Теперь проделаем то же самое с энтальпией образования:

Мольная энтальпия образования смеси:
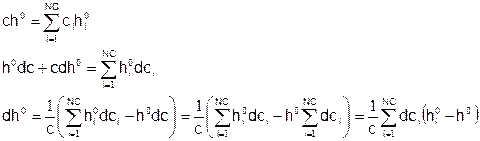
Подставляя это выражение в предыдущее, и, кроме того, используя ранее выведенное выражение для дифференциала молекулярной массы смеси, получаем:
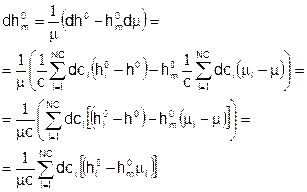
Теперь напомним уравнение энергии для стационарного потока химически реагирующей смеси:
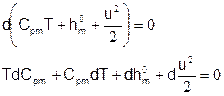
Подставим в это уравнение выражения, полученные для dCpm и dh0m. Получится:
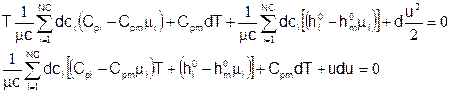
Это и есть искомое уравнение энергии для химически реагирующей смеси идеальных газов. Оно связывает пространственные производные от следующих неизвестных: мольные плотности {ci}, температура T и скорость u.
Вариант 2

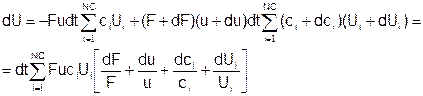
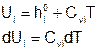


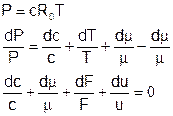
Подставляем:
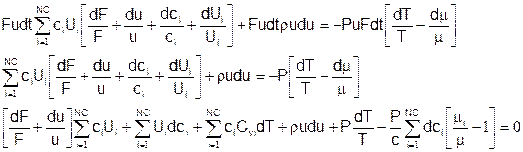
Поскольку:

Члены при dT:
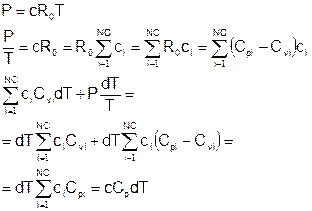
Члены при dci:


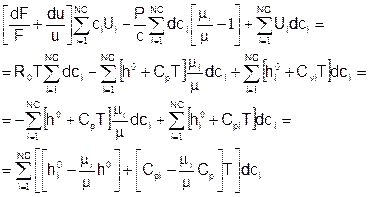
Подставляем:

Учитывая, что массовая плотность r=mc, Cp/m=Cpm – массовая теплоемкость, h0/m=h0m – массовая энтальпия образования, полученное уравнение энергии совпадает с конечным уравнением из варианта 1.
Уравнение неразрывности для химически реагирующей смеси газов
Рис. 1
Замкнутая система уравнений, описывающая одномерное стационарное движение химически реагирующей смеси совершенных газов
1. Уравнение неразрывности для каждой из компонент смеси: здесь система реакций записывается в виде:
Термодинамика диссоциации йода
Рис 1. Диаграмма энергетических состояний атома йода и молекулы синглетного…Приложение 1: Термины
Термодинамически идеальный газ, идеальный газ, совершенный газ
Индивидуальная газовая постоянная
Стационарное течение
Одномерное течение
Резонаторная полость
Глухое зеркало
Выходное зеркало
Коэффициент потерь на зеркалах
Коэффициент пропускания выходного зеркала
Резонаторная мода
Закон действующих масс
Константа скорости реакции
Лазерная активная среда
Коэффициент усиления
Интенсивность насыщения
Приложение 2: Контрольные вопросы
1. Понятие о термодинамически идеальном (совершенном) газе. Термодинамически равновесная смесь газов. Вывод выражений для параметров смеси газов (m, Cp, Cv, g, R).
2. Вывод уравнения неразрывности для одномерного стационарного движения термодинамически равновесной смеси идеальных газов.
3. Вывод уравнения движения для одномерного стационарного движения термодинамически равновесной смеси идеальных газов.
4. Вывод уравнения энергии для одномерного стационарного движения термодинамически равновесной смеси идеальных газов.
5. Вывод системы уравнений одномерного стационарного движения термодинамически равновесной смеси идеальных газов в каноническом виде.
6. Закон действующих масс. Кинетическое уравнение для реакции второго порядка и для реакции произвольного порядка.
7. Вывод уравнения неразрывности для одномерного стационарного движения химически реагирующей смеси идеальных газов.
8. Вывод уравнения энергии для одномерного стационарного движения химически реагирующей смеси идеальных газов.
9. Состав активной среды кислородно-йодного лазера: основные компоненты смеси, безразмерные параметры, характеризующие состав.
10. Энергетическая диаграмма активной среды COIL: главные компоненты активной среды, энергетические уровни, главные процессы обмена энергией.
11. Описание механизма накачки активной среды COIL. Определение константы равновесия накачки. Механизм влияния температуры среды на равновесие процесса накачки.
12. Описание механизма тушения активной среды COIL. Кинетическое уравнение тушения.
13. Механизм пулинга. Кинетическое уравнение пулинга.
14. Описание механизма вынужденной генерации COIL. Взаимодействие процессов накачки и вынужденной генерации. Кинетическое уравнение для атомарного йода.
15. Коэффициент усиления слабого сигнала: общее определение, вывод выражения для к.у. через параметры активной среды, связь к.у. с константой равновесия накачки.
16. Динамика релаксации коэффициента усиления, время релаксации, равновесный коэффициент усиления. Вывод дифференциального уравнения, описывающего процесс установления коэффициента усиления.
17. Баланс энергии электромагнитного поля в простейшем плоскопараллельном резонаторе.
18. Стационарный режим генерации малой интенсивности. Понятие о пороге генерации. Вывод соотношения для порогового коэффициента пропускания выходного зеркала.
19. Стационарный режим генерации конечной интенсивности. Понятие о кривой Ригрода. Вывод уравнения, связывающего интенсивность выходного излучения с коэффициентом пропускания выходного зеркала.
Приложение 3: Физматминимум
Математический минимум:
1. Ряд Тейлора: назначение, общий вид
2. Первые три члена ряда Тейлора для exp(ax), x0=0
3. Первые два члена ряда Тейлора для (1+x)a, x0=0
4. Первые два члена ряда Тейлора для ln(ax), x0=1
5. Выражение для корней квадратного уравнения
6. Определитель матрицы
7. Система N линейных уравнений с N неизвестными: условие единственности решения
8. Система линейных уравнений 3х3: метод Гаусса
9. Производная d[exp(ax)]/dx
10. Производная d[sin(x)]/dx
11. Производная d[tg(x)]/dx
12. Производная d[f(g(x))]/dx
13. Производная d[ln(ax)]/dx
14. Интеграл Int [exp(ax)dx]
15. Интеграл Int [xadx]
16. Интеграл Int [dx/(ax)]
17. Интеграл Int [sin(x)dx]
18. Интеграл Int [tg(x)dx]
19. Интегрирование по частям: Интеграл Int [fdw]=fw - Int [wdf]. Пример
20. sin(2a)
21. cos(2a)
22. sin2a
23. cos2a
24. sin(a+b)
25. sina+sinb
26. Решение дифференциального уравнения df/dx=f
27. Решение дифференциального уравнения df/dx=af+b
28. Решение дифференциального уравнения f’’+bf’+gf=0
29. Решение дифференциального уравнения f’’+bf’+gf=A·exp(jwt)
30. Решение дифференциального уравнения df/dx=af2
31. Фурье-преобразование комплексной функции комплексного аргумента
32. Комплексный фурье-образ sin(wt)
33. Формула Эйлера для exp(ja)
34. Коэффициент корреляции - определение
35. Корреляционная функция - определение
36. Энергетический спектр - определение
37. Дисперсия суммы нормально распределенных случайных величин
Физико-химический минимум:
38. Законы сохранения в механике
39. Дифференциальное уравнение вынужденных колебаний груза на пружине с трением
40. Дифференциальные уравнения динамики движения материальной точки в однородном поле силы тяжести; решения
41. Уставившаяся скорость тела, свободно падающего в атмосфере
42. Закон всемирного тяготения; гравитационная постоянная; ускорение силы тяжести; первая космическая скорость; вторая космическая скорость
43. Вычислить первую космическую скорость для Земли (R0=6400 км; g0=9.81 м/с2)
44. Вычислить высоту геостационарной орбиты для Земли (R0=6400 км; g0=9.81 м/с2)
45. Вычислить период обращения искусственного спутника Земли с высотой орбиты 250 км (R0=6400 км; g0=9.81 м/с2)
46. Вычислить расстояние от Земли до Луны (T=28 суток, R0=6400 км; g0=9.81 м/с2)
47. Вычислить массу Земли (R0=6400 км; g0=9.81 м/с2; g=___)
48. Вычислить массу Солнца (T=1 год, R=8.5 световых минут, g=___)
49. Первый закон термодинамики – закон сохранения энергии
50. Выражение для изменения энтропии тела; второй закон термодинамики
51. Уравнение состояния термодинамически совершенного газа – уравнение Менделеева-Клапейрона; газовая постоянная
52. Связь газовой постоянной с постоянной Больцмана и числом Авогадро
53. Состояние теплоизолированного совершенного газа; уравнение адиабаты Пуассона; показатель адиабаты
54. Равновесное распределение молекул по скоростям в совершенном газе
55. Вязкость газа, теплопроводность, коэффициент диффузии
56. Закон Стефана-Больцмана; степень черноты
57. Плотность фотонов в плоской электромагнитной волне c заданной длиной волны и интенсивностью
58. Размер действительного изображения, формируемого тонкой линзой с заданным фокусным расстоянием
59. Условие существования действительного изображения, формируемого тонкой линзой с положительным фокусным расстоянием
60. Связь между расстояниями от тонкой линзы до предмета и до его изображения (уравнение тонкой линзы)
61. Главный фокус, побочные фокусы, фокальная плоскость тонкой линзы
62. Показатель преломления; связь угла преломления с показателем преломления
63. Коэффициент увеличения объектива, настроенного «на бесконечность» (афокального объектива)
64. Тепловой поток, передаваемый через плоскую однородную стенку
65. Одномерное уравнение теплопроводности
66. Константа равновесия обратимой химической реакции
67. Изобарно-изотермический потенциал (свободная энергия); направление химической реакции
68. Тройная точка на T-P диаграмме, критическое состояние
69. Гидравлическое сопротивление при движении жидкости по трубопроводу
70. Режимы обтекания тел
71. Скачок уплотнения
Приложение 4: Физико-химический рабочий процесс формирования активной среды ХКИЛ – газофазные химические реакции.
| I | Реакция | Скорость реакции ki, см3/с | DEi, см-1 |
| 1 | O2(1D)+O2(1D)®O2(1S)+O2(3S) | 2.5∙10-17 или 9.5×10-28×T3.8´exp(700/T) | 2643 |
| 2 | O2(1D)+O2(1D)®O2(3S)+O2(3S) | 1.8∙10-17 | |
| 3 | O2(1S)+O2(3S)®O2(1D)+O2(3S) | 3.9∙10-17 | |
| 4 | O2(1S)+H2O®O2(1D)+H2O | 6.7∙10-12 | 13121 |
| 5 | O2(1S)+Cl2®O2(1D)+Cl2 | 2.0∙10-15 | |
| 6 | O2(1S)+He®O2(1D)+He O2(1S)+N2®O2(1D)+N2 | 1.0∙10-17 2.2∙10-15 | |
| 7 | O2(1D)+O2(3S)®O2(3S)+O2(3S) | 1.6∙10-18 | |
| 8 | O2(1D)+H2O®O2(3S)+H2O | 4.0∙10-18 | 7882 |
| 9 | O2(1D)+Cl2®O2(3S)+Cl2 | 6.0∙10-18 | |
| 10 | O2(1D)+He®O2(3S)+He O2(1D)+N2®O2(3S)+N2 | 8.0∙10-21 1.4∙10-19 | |
| 11 | I2+O2(1S)®2I+O2(3S) | 4.0∙10-12 или 1.44×10-13´exp(980/T) | 681 |
| 12 | I2+O2(1S)®I2+O2(3S) | 1.6∙10-11 или 3.4×10-23´exp(7940/T) | |
| 13 | I2+O2(1D)®I2*+O2(3S) | 7.0∙10-15 | 0 |
| 14 | I2+I*®I+I2* | 3.5∙10-11 или 3.89×10-11´exp(835/T) | 0 |
| 15 | I2*+O2(1D)®2I+O2(3S) | 3.0∙10-10 | 3045 |
| 16 | I2*+O2(3S)®I2+O2(3S) | 5.0∙10-11 | 7603 |
| 17 | I2*+H2O®I2+H2O | 3.0∙10-10 | 7603 |
| 18 | I2*+He®I2+He I2*+N2®I2+N2 | 4.0∙10-12 9.2∙10-12 | 7603 |
| 19 | I+O2(1D)®I*+O2(3S) | 7.8∙10-11 | 279 |
| 20 | I*+O2(3S)®I+O2(1D) | 1.0277´10-10´exp(-401.4/T) | -279 |
| 21 | I+O2(1D)®I+O2(3S) | 1.0∙10-15 | |
| 22 | I*+O2(3S)®I+O2(3S) | 3.5∙10-16 | 7603 |
| 23 | I*+O2(1D)®I+O2(1S) | 1.0∙10-13 или k1×5.5×103 | 2364 |
| 24 | I*+O2(1D)®I+O2(1D) | 1.1∙10-13 | |
| 25 | I+I*®I+I | 1.6∙10-14 | |
| 26 | I*+H2O®I+H2O | 2.1∙10-12 | 7603 |
| 27 | I*+He®I+He I*+N2®I+N2 | 5.0∙10-18 1.5∙10-16 | |
| 28 | I*+Cl2®Cl+ICl | 5.5∙10-15 | 603 |
| 29 | I*+Cl2®I+Cl2 | 8.0∙10-15 | 4953 |
| 30 | I*+ICl®I2+Cl | 1.5∙10-11 | 2693 |
| 31 | I2+Cl®I+ICl | 2.0∙10-10 | 4910 |
| 32 | Cl+ICl®I+Cl2 | 8.0∙10-12 | 2650 |
| 33 | I2+2I®I2+I2 | 3.6∙10-30 см6/с | 12406 |
| 34 | O2(3S)+2I®I2+O2(3S) | 5.0∙10-32 см6/с | 12406 |
| O2(1D)+Wall®O2(3S)+Wall | 10с-1 до инжекции I2; >50 с-1 после инжекции I2 | 0 | |
| O2(1S)+Wall®O2(3S)+Wall | 20 с-1 | 0 | |
| I*+Wall®I+Wall | 1 с-1 | 0 | |
| 2I*+Wall®I2+Wall | 1 с-1 | 0 |
Приложение 5: План расширенного курса газотермодинамики мощных химических лазеров
1. Введение
2. Уравнения одномерного стационарного движения термодинамически идеального газа
Понятие о термодинамически идеальном (совершенном) газе. Смесь газов.
Уравнение неразрывности
Уравнение импульсов
Уравнение энергии
Самостоятельно: привести к каноническому виду
ДЗ: Рассчитать движение в канале
3. Состав активной среды COIL
4. Кинетика активной среды кислородно-йодного лазера
Константа скорости реакции
Сечение реакции
Процессы накачки, тушения и вынужденного излучения
Самостоятельно: выписать уравнение для Y
5. Динамика активации йода
Время релаксации активации
Эффективная константа равновесия накачки
Равновесная активация
6. Нульмерная газодинамическая модель
7. Взаимодействие слабого электромагнитного поля с активной средой химического лазера. Коэффициент усиления слабого сигнала
Плоскопараллельный резонатор
Параметры резонаторных зеркал
Коэффициент усиления слабого сигнала
Динамика релаксации коэффициента усиления, время релаксации, равновесный коэффициент усиления
Стационарный режим генерации малой интенсивности
8. Функциональная схема COIL
Оптический резонатор
Газодинамический тракт
Генератор синглетного кислорода
СПРТ
Система наведения
9. Взаимодействие электромагнитного поля конечной интенсивности с активной средой COIL. Насыщение усиления.
10. Стационарный режим генерации конечной интенсивности. Оптимальные параметры лазерного резонатора. Кривая Ригрода.
11. Динамика синглетного кислорода. Понятие о широкоапертурном резонаторе
12. Газодинамика активной среды COIL
Уравнение неразрывности для химически реагирующей смеси совершенных газов
Уравнение энергии
13. Газодинамические аспекты взаимодействия активной среды COIL с электромагнитный полем конечной интенсивности
Дополнительные члены в уравнении энергии, обусловленные тепловыми эффектами излучения
Механизмы энергообмена в активной среде через электромагнитное поле
14. Кинетика, газодинамика и термодинамика диссоциации йода
15. Кинетика химического генератора синглетного кислорода
Литература:
1. КЭ-Ораевский – отечественные мегаваттные лазеры
2. Bullet of Light
3. NACL
4. THEL
5. СВД НХЛ
6. Борейшо, Мошков. SPIE; Борейшо, AIAA Paper 93-…
7. КЭ-1
8. КЭ-2
9. ATL
10. ABL
11. Проблемы и решения газовой динамики COIL
12. СВД COIL
– Конец работы –
Используемые теги: термодинамика, Конспект, лекций0.06
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Термодинамика. Конспект лекций
Что будем делать с полученным материалом:
Если этот материал оказался полезным для Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов