рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Опис схеми установки
Реферат Курсовая Конспект
Опис схеми установки
Опис схеми установки - раздел Химия, ЗАГАЛЬНА ХІМІЧНА ТЕХНОЛОГІЯ ...

1 – кварцова трубка; 2 – трубчаста піч; 3 – манометр; 4 – газометр;
5 – напірна склянка; 6 – кран, 7 – човник
Рисунок 8.1 – Схема лабораторної установки для випалювання вапняку.
Кварцову трубку (поз. 1) з човником (поз. 7) для вапняку встановлюють у трубчасту піч (поз. 2) і за допомогою газовідвідної трубки з’єднують з манометром (поз. 3). Для збору оксиду карбону використовують газометр (поз. 4) та напірну склянку (поз. 5), які заповнені насиченим розчином NaCl, в якому не розчиняється СО2.
8.2.2 Випалювання вапняку (крейди), визначення об’єму СО2 та його вмісту
Для випалювання відбирають подрібнений вапняк (крейду) висушений до постійної маси при температурі 378÷380 К розміром часток не більше 1 мм. Зважують на технічних терезах у порцеляновому човнику 2÷3 г вапняку (крейди) та розташовують човник (поз. 7) в кварцову трубку (поз. 1), що розміщена в муфельній печі. Трубку щільно закривають пробкою з газовідвідною трубкою. Газометр (поз. 4) заповнюють розчином NaCl до пробки, піднімаючи напірну склянку (поз. 5). Далі перевіряють установку на герметичність. Для цього встановлюють напірну склянку (поз. 5) нижче газометра (поз. 4) та відкривають кран (поз. 6) на газометрі (поз. 4), дозволяючи запірній рідині витікати з нього до напірної склянки (поз. 5). Якщо установка герметична, то рівень рідини в газометрі (поз. 4) трохи знизившись, залишиться незмінним. У протилежному випадку відшукують місце нещільного з’єднання і добиваються повної герметичності.
Вмикають муфельну піч. Кран на газометрі (поз. 6) повинен бути закритим. Під час досліду різницю рівнів рідини в манометрі (поз. 3) підтримують в межах 15÷20 мм вод. ст. Фіксують початок процесу дисоціації  . Кінцева температура випалювання (у межах 1073÷1223 К) задається викладачем.
. Кінцева температура випалювання (у межах 1073÷1223 К) задається викладачем.
Після закінчення процесу утворення  припиняють нагрів електропечі, дають печі охолодитися і обережно відкривають пробку на кварцовій трубці. Визначають об’єм
припиняють нагрів електропечі, дають печі охолодитися і обережно відкривають пробку на кварцовій трубці. Визначають об’єм  в газометрі (поз. 4), який виділився за час випалювання вапна або крейди. Потім за допомогою металевого гачка (Обережно! Висока температура!) достають гарячий човник з вапном й охолоджують в ексикаторі у присутності вологопоглинальної речовини хлориду кальцію, а потім зважують. Визначають вихід негашеного вапна.
в газометрі (поз. 4), який виділився за час випалювання вапна або крейди. Потім за допомогою металевого гачка (Обережно! Висока температура!) достають гарячий човник з вапном й охолоджують в ексикаторі у присутності вологопоглинальної речовини хлориду кальцію, а потім зважують. Визначають вихід негашеного вапна.
Вміст  за втратою маси наважки розраховують за формулою, %мас.:
за втратою маси наважки розраховують за формулою, %мас.:
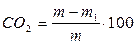 , (8.8)
, (8.8)
де m – маса наважки вапняку (крейди), г; m1 – маса вапна після випалювання вапняку (крейди), г.
Розраховують швидкість переміщення зони розкладання при температурі випалювання за формулою Фернеса (за формулою 8.5) та час витримки випалювання дисоціації частинок  розміром 1 мм за рівнянням (за формулою 8.6).
розміром 1 мм за рівнянням (за формулою 8.6).
8.2.3 Визначення активного СаО у вапні
Зважують на аналітичних терезах отримане вапно масою 1 г та вносять наважку в конічну колбу ємкістю 250 см3, наливають 150 см3 дистильованої води, додають 3÷5 скляних бус або паличок завдовжки 5÷7 мм, закривають скляним холодильником або годинниковим склом та підігрівають до кипіння і витримують 5÷7 хв. Розчин охолоджують до кімнатної температури, додають 2÷3 краплі 1%-вого розчину фенолфталеїну та титрують 1 М розчином хлоридної (соляної) кислоти до знебарвлення розчину. Титрування вважають закінченим, якщо протягом 8 хвилин розчин залишається безбарвним.
Вміст активного оксиду кальцію у негашеному вапні розраховують за формулою, %мас.:

 , (8.9)
, (8.9)
де V – об’єм розчину 1 М хлоридної кислоти, який витрачений на титрування, см3; m – маса наважки вапна, г; 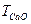 – титр 1 М розчину хлоридної кислоти, г
– титр 1 М розчину хлоридної кислоти, г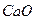 /см3.
/см3.
Титр 1 М розчину хлоридної кислоти встановлюють по натрію карбонату. Для цього наважку безводного натрію карбонату в 1 г (зважують на аналітичних терезах) переносять до конічної колби ємкістю 250 см3 і розчиняють у 80÷100 см3 дистильованої води, далі титрують 1 М розчином хлоридної кислоти в присутності метилового оранжевого індикатору до переходу жовтого забарвлення в оранжево-рожеве.
Титр 1 М розчину хлоридної кислоти 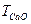 знаходять за формулою:
знаходять за формулою:
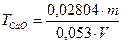 , (8.10)
, (8.10)
де 0,02804 – кількість 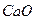 , що відповідає 1 см3 точно 1 М розчину хлоридної кислоти, г; 0,053 – кількість натрію карбонату, що відповідає 1 см3 точно 1 М розчину хлоридної кислоти, г; m – маса наважки натрію карбонату, г; V – об’єм 1М розчину хлоридної кислоти, що витрачена на титрування, см3.
, що відповідає 1 см3 точно 1 М розчину хлоридної кислоти, г; 0,053 – кількість натрію карбонату, що відповідає 1 см3 точно 1 М розчину хлоридної кислоти, г; m – маса наважки натрію карбонату, г; V – об’єм 1М розчину хлоридної кислоти, що витрачена на титрування, см3.
8.2.4 Визначення температури та часу гасіння вапна
Для визначення температури і часу гасіння вапна використовують термоізольовану склянку (рисунок 8.2). Масу наважки вапна у грамах визначають за формулою:
 , (8.11)
, (8.11)
де А – вміст активного оксиду кальцію у вапні, % мас.

1 – термос; 2 – склянка; 3 – коркова пробка; 4 – термометр.
Рисунок 8.2 – Термоізольована склянка для визначення температури та часу гасіння вапна.
Наважку вапна висипають у термоізольовану склянку, наливають 25 см3 дистильованої води з температурою 293 К і швидко перемішують пластмасовою паличкою. Склянку закривають корковою пробкою із щільно вставленим термометром на 100 з поділками на 1
з поділками на 1 , ртутна кулька термометра повинна бути повністю занурена у суміш, що реагує. Вимір температури суміші проводять кожні 30 секунд, починаючи з моменту додавання води. Визначення вважають закінченим, коли протягом 4 хвилин температура підвищується не більше ніж на 1
, ртутна кулька термометра повинна бути повністю занурена у суміш, що реагує. Вимір температури суміші проводять кожні 30 секунд, починаючи з моменту додавання води. Визначення вважають закінченим, коли протягом 4 хвилин температура підвищується не більше ніж на 1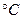 . За час гасіння приймають час з моменту додавання води до початку періоду, коли збільшення температури не перевищує 0,25
. За час гасіння приймають час з моменту додавання води до початку періоду, коли збільшення температури не перевищує 0,25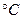 за хвилину, при цьому фіксують максимальне значення температури.
за хвилину, при цьому фіксують максимальне значення температури.
Отримані дані процесу гасіння вапна оформлюють у виді графіка T=f(t).
Отримані дані за п.п. 8.2.1 - 8.2.4 заносять у таблицю 8.1.
Техніка безпеки
1. Вмикання електричної печі здійснюється тільки після перевірки навчально-допоміжним персоналом правильності з’єднання елементів установки.
2. Для запобігання термічних опіків при витягуванні гарячого човника із трубки печі користуйтесь металічним захватом. Човник для охолодження встановлюйте на керамічну плитку.
3. При титруванні дотримуватись загальних правил поведінки в лабораторії.
4. Дотримуватися правил роботи з хімічними речовинами, електричними приладами.
8.4 Контрольні запитання
- Допуск до роботи:
1. Мета роботи. Фізико-хімічні основи одержання вапна.
2. Опис схеми лабораторної установки та правила роботи на ній. Правила техніки безпеки.
3. Методики визначення активного кальцію оксиду. Послідовність операцій при гасінні вапна.
Таблиця 8.1 – Експериментальні дані для матеріалу____________
(назва)
| Параметр | Значення |
| Температура випалювання, К | |
| Маса вапняку для випалювання, г | |
| Час випалювання, год | |
| Об’єм одержаного СО2, см3 | |
| Маса СО2, г (розраховується із об’єму СО2, що виділився) | |
| Маса одержаного вапна, г | |
| Вихід вапна, %мас. | |
| Маса СО2, г (розраховується по втраті маси наважки) | |
| Вміст СО2, %мас. (за формулою 8.8) | |
| Вміст активного СаО у вапні, %мас. (за формулою 8.9) | |
| Швидкість розкладання, мм/год (за формулою 8.5) | |
| Необхідний час для випалювання, год (за формулою 8.6) | |
| Тривалість гасіння вапна, хв | |
| Максимальне значення температури гасіння, К |
- Захист роботи:
1. Які типи печей використовують для випалу вапняку? Поясніть принципову різницю між ними.
2. Від яких параметрів залежить швидкість випалу карбонатної сировини? Обґрунтування температури випалу вапняку.
3. Від яких параметрів залежить швидкість гасіння вапна?
4. Які особливості одержання гашеного вапна: пушонки, тіста, молока?
5. З якою метою використовується вапняк у содовому виробництві?
Література
1. Яворський В.Т., Перекупко Т.В., Знак З.О., Савчук Л.В. Загальна хімічна технологія.- Львів: НУ «Львівська політехніка», 2005.-552 с.
2. Мухленов И,П., Горштейн А.Е., Тумаркина Е.С. Основы химической технологии. - М.: Высш.шк., 1991. - 463 с.
3. Кутепов А.М., Бондарева Т.И., Беренгартен М.Г. Общая химическая технология. - М.: Высш.шк., 1990. - 520 с.
4. Амелин А.Г. Общая химическая технология.- М.: Химия, 1977.- 400 с.
5. Загальна хімічна технологія. Методичні рекомендації до виконання лабораторних робіт для студентів інженерно-хімічного факультету. /А.Л. Концевой, Н.М. Толстопалова, А.В. Лапінський, С.А. Концевой, І.М. Духно. Київ: НТУУ «КПІ», 2008. - 86 с.
6. Методические указания к выполнению лабораторного практикума по курсу «Общая химическая технология и основы промышленной экологии» для студентов химико-технологического факультета и факультета химического машиностроения /И.М. Астрелин, В.О. Кириченко, Ю.В. Князев и др. – К.: КПИ, 1993. – 96 с.
– Конец работы –
Эта тема принадлежит разделу:
ЗАГАЛЬНА ХІМІЧНА ТЕХНОЛОГІЯ
Національний технічний університет України... Київський політехнічний інститут... ЕЛЕКТРОННЕ НАВЧАЛЬНЕ ВИДАННЯ...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Опис схеми установки
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов