рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Порядок виконання роботи
Реферат Курсовая Конспект
Порядок виконання роботи
Порядок виконання роботи - раздел Химия, ЗАГАЛЬНА ХІМІЧНА ТЕХНОЛОГІЯ Експериментальна Частина Лабораторної Роботи Передбачає Основні Послідовні Оп...
Експериментальна частина лабораторної роботи передбачає основні послідовні операції:
- приготування газової суміші (SO2 + повітря), аналітичне визначення об’ємної концентрації SO2 у газовій суміші до контактного апарату;
- проведення контактного окиснення SO2; аналітичне визначення об’ємної концентрації SO2 у газовій суміші після контактного апарату.
| |
| |
1. Ввімкнути обігрів контактного апарату і встановити під контролем персоналу регулятором (поз. 12) задану температуру у реакторі (зазвичай це 723 К (450 °С)).
2. Встановити положення триходового крана (поз. 9) в положення «під тягу». Увімкнути компресор (поз. 1). Регулювання витрати повітря здійснюється: приблизно голчастим вентилем на компресорі і точно - за допомогою вентиля редуктора (поз. 5). В разі необхідності для точного регулювання потоку через ротаметр (поз. 7) можна використовувати гвинт (поз. 7а). Встановлену витрату повітря упродовж усього експерименту доцільно підтримувати незмінною. Надлишковий тиск повітря контролюють манометром (поз. 6).
3. Для визначення концентрації оксиду сульфуру (IV) у вихідній газовій суміші кількісно (піпеткою) переносять: у склянку Дрекселя (поз. 16) - 50 см3 розчину йоду [С(1/2I2) = 0,1 моль/дм3); у склянку Дрекселя (поз. 17) - 10 см3 розчину йоду [С(1/2I2) = 0,1 моль/дм3]. Обидва розчини розбавляють дистильованою водою приблизно до 2/3 об’єму склянки.
4. Подачу оксиду сульфуру (IV) із балона (поз. 2) починають в момент, коли вимикається індикаторна лампа на регуляторі температури (поз. 12). Для цього, без зміни попереднього положення крана (поз. 9), обережно в присутності персоналу відкривати послідовно вентилі балона і редуктора (поз. 2а), слідкуючи за інтенсивністю проходження бульбашок газу крізь барботер - абсорбер (поз. 3) і орієнтуючись на вибраний рівень манометричної рідини у реометрі (поз. 4) (згідно калібрувального графіку).
5. Після встановлення постійних витрат повітря і оксиду сульфуру визначити аналітичним йодометричним методом концентрацію оксиду сульфуру (IV) у вихідній газовій суміші (див. п. 5.2.3). Для цього перевести кран (поз. 9) в положення «на аналіз», що направить газову суміш на поглиначі (поз. 16, 17) і газовий лічильник (поз. 18). Одночасно почати відлік об’єму і часу 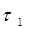 проходження газової суміші за показанням газового лічильника (поз. 18) і секундоміра для точного визначення об’ємної витрати газової суміші.
проходження газової суміші за показанням газового лічильника (поз. 18) і секундоміра для точного визначення об’ємної витрати газової суміші.
6. Для визначення концентрації оксиду сульфуру (IV) у газовій суміші після контактування аналітичним методом (див. п. 5.2.4) перенести до склянки Дрекселя (поз. 19) кількісно (мірною піпеткою) 10 см3 розчину йоду [С(1/2 I2) = 0,1 моль/дм3]. Розчин розвести дистильованою водою приблизно до 2/3 об’єму склянки.
7. При досягненні заданих умов контактування (температура, склад і витрата газової суміші) витримати даний режим упродовж 5 ÷ 10 хв. У цьому відрізку часу необхідно зафіксувати і записати усі робочі характеристики і параметри процесу.
Увімкнути випрямляч високої напруги (поз. 15) і електрофільтр (поз. 14). Перевести триходовий кран (поз. 9) в положення «у реактор» і спрямувати газовий потік у реактор (поз. 10), абсорбер-поглинач (поз. 13), електрофільтр (поз. 14) і склянку (поз. 19).
З цього моменту вести відлік часу експерименту  (тривалість - за вказівкою викладача). Із закінченням досліду перевести триходовий кран (поз. 9) у положення «під тягу», перекрити балон (поз. 2) з SO2.
(тривалість - за вказівкою викладача). Із закінченням досліду перевести триходовий кран (поз. 9) у положення «під тягу», перекрити балон (поз. 2) з SO2.
8. Визначити йодометричним методом концентрацію оксиду сульфуру (IV) у газовій суміші після реактору (див. п. 5.2.4).
9. Відключити від електричного струму прилади (поз. 12) та (поз. 15), повітряний компресор (поз. 1) і обігрів реактора. Спостереження і результати хімічного аналізу представити у таблиці.
5.2.3 Визначення концентрації SO2 у вихідній газовій суміші
Визначення вмісту SO2 у газовій суміші йодометричним методом ґрунтується на взаємодії SO2 з певною кількістю титрованого розчину йоду:
 . (5.5)
. (5.5)
Для визначення концентрації SO2 у газовій суміші до контактного апарата треба приєднати до газового тракту склянки Дрекселя (поз. 16, 17) і газовий лічильник (поз. 18), перемкнути триходовий кран (поз. 9) у положення «на аналіз».
Таблиця 5.1 - Експериментальні дані
| Величина, що вимірюється | Позна-чення | Розмір-ність | Значен-ня |
| Температура навколишнього середовища | 
| К | |
| Тиск газової суміші в системі згідно манометра (поз. 6) | 
| Па | |
| Об’єм непоглиненого газу (повітря) за газовим лічильником (поз. 18) | 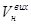
| дм3 | |
| Витрата повітря за ротаметром (поз. 7) | 
| см3/хв | |
| Витрата SO2 за реометром (поз. 4) | Goc | см3/хв | |
| Час прокачування газової суміші через поглинальні склянки (поз. 16, 17) до знебарвлення розчину йоду у склянці (поз. 16) | 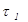
| хв | |
| Час контактування газової суміші на каталізаторі | 
| хв | |
Загальний об’єм розчину йоду у двох поглинальних склянках (поз. 16, 17) для аналізу вихідної суміші на вміст 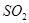
| 
| см3 | |
Об’єм розчину йоду в поглинальній склянці (поз. 19) для аналізу газової суміші після реактору на залишковий вміст 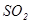
| 
| см3 | |
Об’єм тіосульфату натрію, що витрачається на титрування розчину йоду при аналізі на 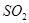 у вихідній газовій суміші у вихідній газовій суміші
| 
| см3 | |
Об’єм тіосульфату натрію, що витрачається на титрування розчину йоду при аналізі газової суміші після реактору на залишковий вміст 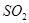
| 
| см3 |
Газову суміш SO2 і повітря слід пропускати крізь розчини до встановлення солом’яно-жовтого кольору розчину йоду у першій за ходом газу склянці (поз. 16). Потім перемкнути триходовий кран (поз. 9) у положення «у реактор» і записати час за секундоміром і об’єм пропущеного газу через лічильник (поз. 18). Після цього кількісно перенести вміст обох склянок (поз. 16, 17) до конічної колби місткістю 500 см3, додати 5÷10 крапель 1% розчину крохмалю і титрувати надлишок йоду, що не прореагував з SO2, розчином тіосульфату натрію Na2S2O3 концентрацією С(1/2 Na2S2O3)= 0,1 моль/дм3 до знебарвлення вихідного розчину:
 . (5.6)
. (5.6)
Маса оксиду сульфуру (IV) 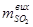 , поглиненого у склянках, г:
, поглиненого у склянках, г:
 , (5.7)
, (5.7)
де K - коефіцієнт поправки до концентрації розчину йоду (К » 1); 32 – молярна маса еквіваленту SO2, г/моль;  - сумарний об’єм йоду в обох поглиначах (60 см3);
- сумарний об’єм йоду в обох поглиначах (60 см3);  - об’єм розчину тіосульфату натрію, що витрачено на титрування надлишку йоду, см3.
- об’єм розчину тіосульфату натрію, що витрачено на титрування надлишку йоду, см3.
За значенням густини SO2 за нормальних умов (Т0 = 273 К;
Р0 = 101325 Па) - r = 2,926 г/дм3, обчислюють об’єм поглиненого (що прореагував) оксиду сульфуру (IV), 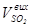 , дм3:
, дм3:
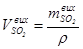 . (5.8)
. (5.8)
Об’єм повітря 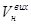 (дм3), що пройшов крізь поглинальні склянки (поз. 16, 17) і зафіксований газовим лічильником (поз. 18), слід привести до нормальних умов:
(дм3), що пройшов крізь поглинальні склянки (поз. 16, 17) і зафіксований газовим лічильником (поз. 18), слід привести до нормальних умов:
 , (5.9)
, (5.9)
де Т - температура у лабораторії, К; Р - тиск газової суміші у системі, Па (визначають за показниками манометра (поз. 6) з урахуванням барометричного тиску -див. формулу на манометрі).
Тоді об’ємна частка SO2 у газовій суміші до контактування 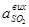
дорівнює:
 . (5.10)
. (5.10)
Перевірте значення 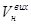 за рівнянням, дм3:
за рівнянням, дм3:
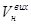 =
= 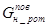 .
. /1000. (5.11)
/1000. (5.11)
Перевірте також концентрацію SO2 у газовій суміші до контактування 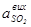 за формулою, частки:
за формулою, частки:
 . (5.12)
. (5.12)
Точність розрахунку концентрації SO2 за останньою формулою визначається точністю калібрування реометру (поз. 4) і ротаметру (поз. 7).
5.2.4 Визначення концентрації SO2 у газовій суміші після реактору
Визначення вмісту SO2 у газовій суміші після контактного апарата здійснюють таким самим чином, як і до контактування (див. п. 5.2.3). Кількість SO2 обчислюють за тими самими формулами, але з урахуванням того, що до склянки Дрекселя (поз. 19) залито 10 см3 розчину йоду, тобто 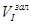 = 10 см3 .
= 10 см3 .
Розчин із склянки (поз. 19) злити до конічної колби і титрувати так, як це описано вище. Розрахувати за результатами титрування масу SO2, що не прореагував ( ), г:
), г:
 . (5.13)
. (5.13)
Об’єм SO2, що не прореагував ( ), складає, дм3:
), складає, дм3:
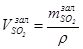 . (5.14)
. (5.14)
Об’ємна частка залишкового SO2 в газовій суміші  після контактування складає:
після контактування складає:
 , (5.15)
, (5.15)
де  =
=  +
+ 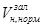 . При цьому
. При цьому 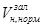 розрахувати за формулою (5.9) з урахуванням
розрахувати за формулою (5.9) з урахуванням 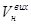 =
=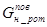 .
. /1000 . Остання формула є приблизною: не враховується об’єм кисню, що прореагував з SO2.
/1000 . Остання формула є приблизною: не враховується об’єм кисню, що прореагував з SO2.
5.3 Обробка і представлення результатів
Ступінь перетворення SO2 в SO3, нехтуючи зменшенням об’єму суміші у ході реакції, розраховується за формулою:
 . (5.16)
. (5.16)
Інтенсивність I гетерогенного каталітичного процесу характеризується його об’ємною швидкістю, тобто об’ємом газової суміші Vгвих , дм3, що проходить через одиницю об’єму каталізатора Vкат, дм3, за одиницю часу t, год (розмірність об’ємної швидкості «год-1»):
I = Vгвих / ( Vкат ×t ), (5.17)
де Vгвих =  ; t =t2 /60 , Vкaт = 0,03 дм3 .
; t =t2 /60 , Vкaт = 0,03 дм3 .
Як оцінку активності каталізатора використовують питому продуктивність каталізатора G, що визначається кількістю продукту каталітичної реакції (маса SO3, г), що одержують з 1 дм3 каталізатора за 1 годину:
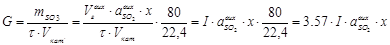 . (5.18)
. (5.18)
Величина G також характеризує інтенсивність процесу.
5.4 Техніка безпеки
1. Слідкувати за герметичністю установки. В разі виявлення викидів SO2 (різкий та неприємний запах) повідомити про це викладача або навчально – допоміжний персонал і припинити подачу SO2 на установку.
2. Для запобігання перекиду рідини у реометрі, розриву з’єднувальних шлангів обережно відкривати вентилі на балоні з SO2 (тільки під контролем персоналу лабораторії!).
3. При потраплянні сульфатної (сірчаної) кислоти на шкіру видалити кислоту спочатку тампоном (рушником, носовичком), потім змити сильним струменем води, ретельно промити вражені місця слабким розчином соди, потім ще раз водою і обробити маззю проти опіку. Звернутися до лікаря для надання подальшої допомоги.
5.5 Контрольні запитання
- Допуск до роботи:
1. Мета роботи. Назвіть стадії виробництва сульфатної кислоти контактним методом.
2. Схема лабораторної установки, порядок і правила безпечної роботи на ній.
3. Методика йодометричного визначення складу газової суміші на вміст SO2.
- Захист роботи:
1. Вимоги до промислових каталізаторів. Температура запалювання каталізатора. Об’ємна швидкість як міра інтенсивності процесу.
2. Принцип Ле-Шательє. Графічна залежність рівноважного ступеня перетворення від температури і тиску для реакції, що розглядається.
3. Конструкції реакторів для контактного окиснення SO2 до SO3. Організація теплообміну. Лінія оптимальних температур (ЛОТ). Графіки Х = ¦ (T).
6 Каталітичне окиснення аміаку
Мета роботи: ознайомитись з основними закономірностями процесу окиснення аміаку, засвоїти методику хімічного аналізу і визначити вплив технологічного режиму (температура, концентрація аміаку) на ступінь перетворення аміаку в оксид азоту (ІI).
6.1 Стислі теоретичні відомості
Окиснення аміаку є першою стадією виробництва нітратної (азотної) кислоти і може здійснюватися до різного ступеня окиснення азоту:
 ; (6.1)
; (6.1)
 ; (6.2)
; (6.2)
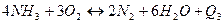 (6.3)
(6.3)
Значення констант рівноваги при 1073÷1173 К (800 ÷ 900 °С) свідчать про те, що реакції (6.1 ÷ 6.3) практично незворотні, при цьому найповнішим може бути перетворення аміаку до елементарного азоту.
Склад кінцевих продуктів визначається співвідношенням швидкостей реакцій (6.1 ÷ 6.3). У газовому об’ємі без каталізатора швидкість реакції окиснення аміаку до оксиду азоту (ІІ) є найменшою. Тому для проведення цільової реакції (6.1) необхідне використання каталізатора селективної дії. Як каталізатор для цього процесу використовують переважно сплав платини з родієм або з родієм і паладієм у вигляді пласких сіток, розташованих одна над одною. На платино-родієвому каталізаторі за температури 1173 К (900 °С) вихід оксиду азоту (П) досягає 95 ÷ 98%. Оптимальний час контакту на платиновому каталізаторі знаходиться у межах 0,00006 ÷ 0,0001 с. Процес окиснення відбувається в області зовнішньої дифузії і його швидкість лімітується дифузією аміаку до поверхні каталізатора. Рівняння швидкості процесу W (кмоль/год) в області зовнішньої дифузії для системи газ - тверде:
 , (6.4)
, (6.4)
де b - коефіцієнт масовіддачі, м/год; DС - рушійна сила процесу - різниця концентрацій аміаку у потоці і на поверхні каталізатора, кмоль/м3; F - поверхня контакту - поверхня платинових сіток, м2.
Враховуючи практичну незворотність реакції (6.1), із збільшенням температури вихід оксиду азоту (ІІ) збільшується. Оптимальна температура для платинового каталізатора перебуває у межах 1073 ÷1173 К (800 ÷ 900°С). За більш високих температур виникає термічна дисоціація аміаку:
 , (6.5)
, (6.5)
що зменшує вихід оксиду азоту (II), до того ж збільшуються втрати платини.
Для повного окиснення 1 моль (або 1 м3) NH3 до NO за стехіометрією реакції (6.1) необхідно 1,25 моль (або 1,25 м3) O2. З врахуванням об’ємної частки кисню (21%) у повітрі загальний об’єм аміачно-повітряної суміші (АПС): 1 м3 (NH3)+  м3 (повітря)=6,95 м3:
м3 (повітря)=6,95 м3:
Таким чином, об’ємна частка аміаку в аміачно-повітряній суміші, %:
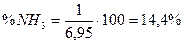 .
.
Зона вибуховості аміаку в аміачно-повітряній суміші (АПС) знаходиться в межах 14 ÷ 27%. Тому практично використовують об’ємну частку аміаку в АПС 9 ÷ 11%, що відповідає співвідношенню  .
.
Таким чином, каталітичне окиснення аміаку є прикладом швидкого, практично незворотного складного гетерогенного каталітичного процесу, реалізація якого залежить від селективних властивостей каталізатора, температури, співвідношення компонентів у вихідній суміші.
– Конец работы –
Эта тема принадлежит разделу:
ЗАГАЛЬНА ХІМІЧНА ТЕХНОЛОГІЯ
Національний технічний університет України... Київський політехнічний інститут... ЕЛЕКТРОННЕ НАВЧАЛЬНЕ ВИДАННЯ...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Порядок виконання роботи
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов