рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Експериментальна частина
Реферат Курсовая Конспект
Експериментальна частина
Експериментальна частина - раздел Химия, ЗАГАЛЬНА ХІМІЧНА ТЕХНОЛОГІЯ 3.2.1 Визначення Загальної Твердості Заданої Проби Води ...
3.2.1 Визначення загальної твердості заданої проби води
Кожний аналіз виконується 2÷3 рази (паралельні досліди). Результати фіксують у таблиці 3.1. Третє визначення не виконується, якщо різниця у значеннях в попередніх двох аналізах не перевищує 0,1 см3. У формулах використовується середнє значення паралельних дослідів.
Визначення загальної твердості води проводять комплексонометричним методом.
У конічну колбу місткістю 250 см3 переносять 100 (50) см3 досліджуваної проби води, відміряної піпеткою, приливають 5 (2,5) см3 буферного розчину, додають кілька крапель індикатора хромового темно-синього. Розчин повільно титрують, старанно перемішуючи, розчином трилону Б концентрацією 0,05 М до переходу забарвлення розчину з фіолетово-малинового у синій колір.
Загальну твердість води обчислюють за формулою:
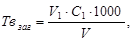 ммоль/дм3, (3.15)
ммоль/дм3, (3.15)
де V1 – об’єм трилону Б, який пішов на титрування, см3; С1 - концентрація розчину трилону Б (0,05 М), моль/дм3; V – об’єм досліджуваної води, см3 (V = 100 або 50 см3 ).
3.2.2 Визначення карбонатної твердості води
Для визначення карбонатної твердості досліджуваної води відбирають піпеткою 100 (50) см3 води в конічну колбу місткістю 250 см3 і додають 2÷3 краплі фенолфталеїну. Якщо вода набуває блідо-рожевого забарвлення, її титрують 0,1 М розчином хлоридної (соляної) кислоти до знебарвлення. Потім у цю саму колбу додають 2÷3 краплі метилового оранжевого та продовжують титрувати соляною кислотою тієї ж концентрації до переходу забарвлення на рожеве.
Карбонатну твердість Твк обчислюють за формулою:
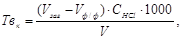 ммоль/дм3, (3.16)
ммоль/дм3, (3.16)
де Vзаг – загальний об’єм розчину хлоридної (соляної) кислоти, витраченого на титрування, см3; Vф/ф - об’єм розчину хлоридної (соляної) кислоти, витраченого на титрування за індикатором фенолфталеїном, см3 ;CHCl - концентрація соляної кислоти, 0,1 моль/дм3; V – об’єм проби води, см3.
Некарбонатну твердість знаходять як різницю між загальною та карбонатною твердістю:
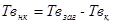 , ммоль/дм3. (3.17)
, ммоль/дм3. (3.17)
3.2.3 Пом’якшення води іонообмінним способом
Через вертикальну циліндричну скляну колонку, заповнену іонообмінною смолою - катіоніт у Na- або Н-формі (типу КУ-2-8), пропускають воду з невеликою швидкістю (1 крапля за секунду), регулюючи затискачем витрати води на виході з колонки. Номери проби води на штативах над іонообмінними колонками відповідають номерам проб води з відомою (визначеною за п. 3.2.1) загальною твердістю. Коли в колбі-приймачі накопичиться ~ 150 см3 води, яка пройшла крізь шар іоніту, пропускання води припиняють. В пом’якшеній воді згідно п. 3.2.5 визначають залишкову загальну Твзагзал .
3.2.4 Пом’якшення води реагентним способом
У розрахунках кількості реагентів для пом’якшення води припускаємо, що вода не має магнієвої твердості. В такому випадку об’єм вапняного молока обчислюють, враховуючи карбонатну твердість води:
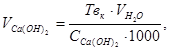 (3.18)
(3.18)
де 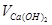 - об’єм вапняного молока, см3; Твк - карбонатна твердість досліджуваної води, ммоль/см3;
- об’єм вапняного молока, см3; Твк - карбонатна твердість досліджуваної води, ммоль/см3; 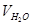 - об’єм води, що треба пом’якшити, см3;
- об’єм води, що треба пом’якшити, см3; 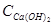 - концентрація Са(ОН)2 у вапняному молоці, моль/дм3.
- концентрація Са(ОН)2 у вапняному молоці, моль/дм3.
Кількість розчину соди для пом’якшення води обчислюють, враховуючи некарбонатну твердість:
 (3.19)
(3.19)
де 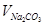 - об’єм розчину соди, см3; Твнк – некарбонатна твердість досліджуваної води, ммоль/дм3;
- об’єм розчину соди, см3; Твнк – некарбонатна твердість досліджуваної води, ммоль/дм3;  - концентрація розчину соди, моль/ дм3 .
- концентрація розчину соди, моль/ дм3 .
Пом’якшення води
До колби об’ємом до 500 см3 (колба має бути виготовлена з термостійкого скла) переносять мірним циліндром певний об’єм зразка води (250 см3), додають розраховані кількості вапняного молока та розчину соди. Важливо дотримуватись певної послідовності додавання вказаних реагентів: спочатку треба ретельно змішати вапно з водою та додавати соду через 2÷3 хвилини після цього. Кип’ятять пробу 10÷15 хвилин (від початку кипіння). Потім колбу знімають з триноги (обов’язково надіти на пальці гумові трубки) і спочатку залишають на 5 хвилин на лабораторному столі (для попередження значних температурних перепадів, на які термостійкій посуд не розрахований), а вже потім ставлять під воду у мийці для бистрого охолодження до кімнатної температури (холодна вода не повинна потрапляти у колбу). Охолоджену воду (колба з водою не повинна бути теплою на дотик) фільтрують крізь паперовий фільтр на лійці у допоміжну ємність. З цієї ємності відбирають піпеткою необхідний об’єм фільтрату й визначають залишкову твердість води після пом’якшення згідно пп. 3.2.1.
3.2.5 Визначення залишкової твердості
Аналіз здійснюють аналогічно визначенню загальної (пп. 3.2.1). При титруванні проби після катіонування використовують розчин трилону Б з концентрацією 0,01 моль/дм3 (додавати у пробу по краплям) для підвищення точності визначення та можливого використання об’єму проби пом’якшеної води до 25 см3 (для забезпечення хоча б двох паралельних дослідів загальної та карбонатної твердості).
Величину залишкової твердості обчислюють за формулами (3.15), (3.16) та (3.17). Отримані значення заносять у таблицю.
Таблиця 3.1 – Результати аналізу проб води
| Проба | Об’єм проби, см3 | Твердість води | Об’єм реагенту на титрування, см3 | Середнє значення, см3 | Твердість, ммоль/дм3 | ||
| паралельні досліди | |||||||
| вихідна | загальна | ||||||
| карбонатна | |||||||
| після катіонування | загальна | ||||||
| після вапнування | загальна |
3.3 Обробка і представлення результатів
За рівнянням (3.17) розрахувати некарбонатну твердість обробленої води.
Ступінь пом’якшення води для кожного з двох виконаних методів обробки води обчислюють за формулою, %:
 (3.20)
(3.20)
де Твзаг - загальна твердість досліджуваної проби води, ммоль/дм3;
Твзагзал - залишкова твердість води після пом’якшення, ммоль/дм3.
Зробити висновок щодо ефективності пом’якшення води іонообмінним і реагентним способами за отриманими значеннями Х.
3.4 Техніка безпеки
1. При виконанні роботи необхідно дотримуватися загальних положень та правил безпечної роботи з хімічними реагентами, скляним посудом та газовими горілками.
2. Виконувати роботу треба згідно вказаної у даному тексті послідовності, за наявності сумнівів щодо виконання будь-якої процедури звертатись до викладача.
3.5 Контрольні запитання
- Допуск до роботи:
1. Мета роботи. Техніка безпеки.
2. Що таке твердість води? Назвати види твердості. Методика хімічного аналізу води на твердість.
3. Необхідність пом’якшення води.
- Захист роботи:
1. Навести рівняння іонообмінного та реагентного способів обробки води.
2. Дати порівняльну характеристику методів пом’якшення води.
3. Назвати стадії та процеси промислової підготовки води.
4 Отримання гідрокарбонату натрію
Мета роботи: отримати гідрокарбонат натрію, виконати аналізи сировини і продукту, розрахувати технологічні показники.
4.1 Стислі теоретичні відомості
Виробництво кальцинованої соди Na2CO3 за аміачним способом є гетерогенним некаталітичним багатостадійним процесом у системі Р-Г-Т (рідина – газ – тверде) і передбачає ряд стадій. Головною є стадія отримання гідрокарбонату натрію NaHCO3, що має назву "карбонізація" - гетерогенний хемосорбційний екзотермічний процес, який відбувається в дифузійній області. Вихідна сировина цього процесу:
- сіль NaCl;
- вапняк або крейда (CаС03 - для отримання СО2);
- аміак NH3.
Карбонізація амонізованого розчину солі - це процес, у якому послідовно відбувається дифузія СО2 у газовій фазі, абсорбція СО2 аміачною водою, хімічна реакція, дифузія у розчині, кристалізація продукту.
Сумарна реакція процесу карбонізації:
 . (4.1)
. (4.1)
Вище зазначено, що реакція (4.1) має кілька стадій, котрі спрощено можна подати такими реакціями. Спочатку більша частина оксиду вуглецю (IV) зв’язується у карбонат амонію:
 , (4.2)
, (4.2)
який у подальшому перетворюється на гідрокарбонат амонію:
 . (4.3)
. (4.3)
Гідрокарбонат натрію утворюється в результаті обмінної реакції між хлоридом натрію і гідрокарбонатом амонію:
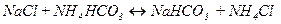 . (4.4)
. (4.4)
Амонізація розсолу необхідна для введення до нього оксиду вуглецю (IV), нерозчинного у насиченому розчині NaCl.
Ступінь перетворення NaCl (XNa+) визначається співвідношенням кількості NaCl, що перетворився на NaHCO3 - 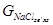 , до вихідної кількості NaCl, що надійшла на карбонізацію -
, до вихідної кількості NaCl, що надійшла на карбонізацію - 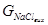 :
:

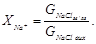 (4.5)
(4.5)
Ступінь перетворення аміаку  визначається співвідношенням NH3, що зв’язався у NH4Cl -
визначається співвідношенням NH3, що зв’язався у NH4Cl -  , до вихідної кількості аміаку, що надійшла з розсолом на карбонізацію -
, до вихідної кількості аміаку, що надійшла з розсолом на карбонізацію -  :
:
 (4.6)
(4.6)
У промисловості процес карбонізації відбувається в осаджувальній карбонізаційній колоні. У зв’язку зі складністю процесів в осаджувальній колоні немає єдиного узагальненого кінетичного рівняння для їх опису, яке дозволило б розрахувати час перебування реагентів у апараті та геометричні розміри колони. Тому швидкість процесу карбонізації умовно розглядають як складову швидкостей двох стадій: абсорбції СО2 і кристалізації гідрокарбонату натрію.
Рівняння швидкості абсорбції CO2 (Wа, кмоль/год) має вигляд:
 (4.7)
(4.7)
де Ка - константа швидкості абсорбції, кмоль/(Пa·м2·год); DР - рушійна сила процесу карбонізації, Па, яка дорівнює різниці парціального тиску CO2 у газовій фазі і пружності пари СО2 над розчином  , Па; F - поверхня контакту фаз Г - Р, м2.
, Па; F - поверхня контакту фаз Г - Р, м2.
Швидкість абсорбції СО2 залежить від швидкості дифузії NH3 до поверхні розподілу фаз Г-Р , тому з підвищенням температури Ка, а отже, і Wa збільшуються. Однак із підвищенням температури збільшується рівноважний тиск (пружність) СО2 над рідкою фазою, що веде до зменшення DР і, відтак, до зниження швидкості абсорбції. Таким чином, позитивний вплив підвищення температури на Ка обмежується переважним зростанням рівноважного тиску СО2 над рідкою фазою. Отже, для підвищення швидкості карбонізації бажано знижувати температуру процесу абсорбції.
На повноту і швидкість карбонізації впливає секційне введення СО2: до середньої частини колони вводять «розбавлений» СО2, а до нижньої
частини колони - концентрований. Оскільки  у ході реакції збільшується із зростанням концентрації NaHCO3 і температури, то вказаний прийом введення СО2 підвищує
у ході реакції збільшується із зростанням концентрації NaHCO3 і температури, то вказаний прийом введення СО2 підвищує  , а отже, і рушійну силу процесу в нижній частині колони.
, а отже, і рушійну силу процесу в нижній частині колони.
Зростанню швидкості абсорбції сприяє розвиток поверхні контакту фаз Г - Р , що досягається завдяки будові карбонізаційної колони - наявністю барботажних тарілок у верхній частині колони.
Процес кристалізації NaHCO3 складається з двох послідовних стадій: утворення зародків кристалів та ріст кристалів. Утворення зародків відбувається у пересичених розчинах, коли пересичення сягає певної величини.
Швидкість процесу кристалізації, кмоль/год:
 (4.8)
(4.8)
де Kk - константа швидкості кристалізації, м/год; DС - рушійна сила процесу, що дорівнює різниці концентрацій NaHCO3 у пересиченому розчині і рівноважної концентрації, кмоль/м3:  ; F - поверхня кристалів, м2.
; F - поверхня кристалів, м2.
На швидкість процесу кристалізації впливає велика кількість чинників, з яких головними є: пересичення, температура, інтенсивність перемішування.
З підвищенням температури збільшуються як швидкість утворення зародків, так і швидкість зростання кристалів, тобто зростає величина Kk , але із зниженням температури збільшується пересичення розчину за NaHCO3, через те, що зменшується розчинність NaHCO3, тобто збільшується рушійна сила процесу DС.
Тому у колоні підтримують такий температурний режим: у зоні утворення зародків – 333÷338 К (60÷65 °C), у нижній частині колони, де відбувається масова кристалізація 308 ÷ 313 К (35÷40 °C).
Збільшення F у рівнянні (4.8) можливе за рахунок зменшення розміру кристалів при збільшенні температури, але для збільшення швидкості фільтрування необхідні досить великі кристали NaHCO3.
На стадії росту кристалів перемішування впливає на швидкість процесу у тому разі, якщо лімітуючою стадією є підведення речовин до поверхні кристалу, тобто якщо процес відбувається у дифузійній області. Тоді із зростанням інтенсивності перемішування зростає швидкість конвективної дифузії, що призводить до збільшення швидкості росту кристалів.
– Конец работы –
Эта тема принадлежит разделу:
ЗАГАЛЬНА ХІМІЧНА ТЕХНОЛОГІЯ
Національний технічний університет України... Київський політехнічний інститут... ЕЛЕКТРОННЕ НАВЧАЛЬНЕ ВИДАННЯ...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Експериментальна частина
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов