рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Опис схеми установки
Реферат Курсовая Конспект
Опис схеми установки
Опис схеми установки - раздел Химия, ЗАГАЛЬНА ХІМІЧНА ТЕХНОЛОГІЯ Процес Карбонізації Амонізованого Розсолу Відбувається На Установці (Рисунок ...
Процес карбонізації амонізованого розсолу відбувається на установці (рисунок 4.1), що включає карбонізаційну колонку (поз.4), яка працює у барботажному режимі, котрий забезпечується рівномірною подачею оксиду вуглецю (IV) із балона (поз. 1) через барботер (поз. 5). Витрату газу регулюють вентилем (поз. 2) на редукторі (поз. 3).
Бризки розсолу, що відносяться потоком газу, ловлять уловлювачем (поз. 6), не поглинений розчином газ викидається до витяжної шафи.

1 - балон; 2 - вентиль; 3 - редуктор; 4 - карбонізаційна колонка;
5 - барботер; 6 – уловлювач
Рисунок 4.1 - Схема лабораторної установки.
4.2.2 Аналіз проби технічного хлориду натрію (метод Мора)
Розрахувати наважку проби NaCl для приготування 250 см3 розчину з молярною концентрацією С(NaCl) = 0,05 моль/дм3:
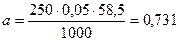 г,
г,
де 250 – об’єм колби, см3; 0,05 – концентрація NaCl, моль/дм3; 58,5 – молярна маса NaCl г/моль.
Зважену на аналітичних терезах наважку проби солі перенести в мірну колбу на 250 см3, ретельно перемішати, довести до позначки дистильованою водою, відібрати піпеткою аліквоту 5 см3 і титрувати за методом Мора розчином нітрату срібла з молярною концентрацією еквівалента С(AgNO3) = 0,05 моль/дм3 в присутності індикатора (розчину K2CrO4) до появи оранжевого забарвлення. Титрування протікає за схемою:
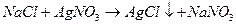 ; (4.9)
; (4.9)
 . (4.10)
. (4.10)
Вміст NaCl в пробі визначають за формулою:
 , (4.11)
, (4.11)
де  – об’єм нітрату срібла, що пішов на титрування, см3;
– об’єм нітрату срібла, що пішов на титрування, см3; 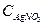 – молярна концентрація еквівалента нітрату срібла, моль/дм3; 58,5 – молярна маса NaCl, г/моль; 250 – об’єм колби, см3; 5 – об’єм аліквоти, см3;
– молярна концентрація еквівалента нітрату срібла, моль/дм3; 58,5 – молярна маса NaCl, г/моль; 250 – об’єм колби, см3; 5 – об’єм аліквоти, см3;  – маса наважки технічного хлориду натрію (увага! в даному розрахунку треба використовувати масу реальної наважки, а не розрахованої вище).
– маса наважки технічного хлориду натрію (увага! в даному розрахунку треба використовувати масу реальної наважки, а не розрахованої вище).
4.2.3 Аналіз аміачної води (водного розчину аміаку)
Отримати у викладача завдання, де вказується номер проби технічного NaCl і аміачної води.
Для аналізу аміачної води треба відібрати із вказаної проби 10 см3 (піпеткою) аміачної води - Vp. Пробу відбирати обов’язково у витяжній шафі і за допомогою пробовідбірника. В мірну колбу місткістю 250 см3 (Vк) перенести 100 см3 дистильованої води, 10 см3 досліджуваної проби аміачної води, довести вміст колби дистильованою водою до мітки, закрити пробкою, перемішати. Вміст аміаку визначають прямим титруванням розчином хлоридної (соляної) кислоти. Піпеткою відбирають 25 см3 приготованого розчину (аліквота Va), переносять до конічної колби
(V = 250 см3), додають 2÷3 краплі індикатора метилоранжу і титрують 1 М (моль/дм3) розчином хлоридної кислоти при безперервному перемішуванні до переходу забарвлення розчину із жовтого до рожевого. Вміст аміаку (CNH3) визначають із виразу, г/дм3:
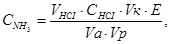 (4.12)
(4.12)
де VHCl - об’єм хлоридної кислоти, що знадобився на титрування (замірювання за бюреткою), см3; СHCl - концентрація HCl - 1 М (1 моль/дм3); Vк – об’єм мірної колби, см3; Е - молярна маса еквіваленту аміаку, г/моль, Е=17; Va – об’єм аліквоти, см3; Vp - об’єм проби (нерозбавленого розчину аміачної води), см3.
Приклад розрахунку. На титрування визначеної проби аміаку пішло 12,5 см3 (VHCl) 1 М соляної кислоти, тоді:
 г/дм3.
г/дм3.
4.2.4 Приготування амонізованого розсолу заданої концентрації
Завдання. Приготувати 100 см3 (V) амонізованого розсолу з вмістом NaCl у розчині CNaCl = 230 ÷ 260 г/дм3 (за завданням викладача). Проба NaCl № 1: вміст NaCl у даній технічній пробі солі становить 95% мас. Співвідношення NH3 : NaCl = (1,1 - 1,2):1.
А) Приклад розрахунку кількості технічної солі NaCl.
Для приготування V = 100 см3 розсолу з концентрацією CNaCl - 240 г/дм3 і з вмістом NaCl (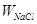 ) у пробі солі 95% мас. (0,95 мас. частки) необхідно:
) у пробі солі 95% мас. (0,95 мас. частки) необхідно:
 г.
г.
Б) Приклад розрахунку кількості аміачної води.
Приготування розсолу із співвідношенням NH3:NaCl = 1,2 : 1.
У 100 см3 розcолу міститься 100%-го NH3:
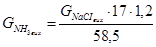 =
=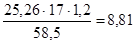 г;
г;
з урахуванням відомої концентрації аміаку в аміачній воді, об’єм аміачної води становитиме:
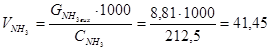 см3,
см3,
де 17 і 58,5 - молярні маси еквівалентів NH3 і NaCl, відповідно; 1,2 - надлишок NH3 від стехіометрії реакції (4.1).
В) Порядок приготування розсолу.
На технічних терезах зважують розраховану кількість проби технічної солі NaCl. У мірну колбу місткістю 100 см3 через суху лійку переносять невеликими порціями зважену сіль, слідкуючи за тим, щоб не забився носик лійки. Під витяжкою відміряють циліндром розраховану кількість вихідної проби аміачної води і повільно доливають у колбу, де знаходиться NaCl (працювати у витяжній шафі!). Потім вміст колби доводять дистильованою водою до мітки. Колбу закривають пробкою і ретельно і обережно перемішують. Розсолу дають відстоятися на протязі 5÷10 хв.
4.2.5 Визначення NаCl в амонізованому розсолі
5 см3 амонізованого розсолу (Vрозс) під витяжкою переносять в мірну колбу місткістю 250 см3 (Vкол) і розбавляють дистильованою водою до половини об’єму. Потім доводять до мітки (поза витяжкою).
Відбирають піпеткою 5 см3 приготованого розчину (Vал) в конічну колбу об’ємом до 100 см3. На титрувальному стенді підкислюють пробу нітратною (азотною) кислотою (5 см3, концентрація 2 моль/дм3 - 2 М), додають індикатор - 2÷3 см3 залізо-амонійного галуну [FeSO4·(NH4)2SO4]. Ретельно перемішуючи додають точно (із бюретки) 10 см3 розчину AgNO3 (VAgNO3) концентрацією 0,05 M, після чого титрують розчином роданіду амонію NH4CNS концентрацією 0,05 M до появи червоно-бурого забарвлення (VNH4CNS).
Маса NаClу приготованому розсолі (V = 100 см3), г:
 (4.13)
(4.13)
4.2.6 Карбонізація амонізованого розсолу
Після відстоювання із колби з розсолом (Увага! Не використовувати розчини, що готуються для аналізу згідно 4.2.2 і 4.2.3!) під витяжною шафою відміряють циліндром 80 см3 рідини (Vrid) і заливають у карбонізаційну колонку. Відкривають вентиль балону і через барботер рівномірно пропускають оксид вуглецю (IV). Карбонізацію продовжують до випадання осаду гідрокарбонату натрію у всьому об’ємі розчину.
4.2.7 Фільтрування суспензії гідрокарбонату натрію
Осад гідрокарбонату натрію відділяють від фільтрату на лійці Бюхнера. Колонку промивають фільтровою рідиною і промивають нею осад на фільтрі. Вологий осад гідрокарбонату натрію віджимають фільтрувальним папером, зважують на технічних терезах – G, г.
4.2.8 Визначення вмісту NaHCO3 в отриманому осаді
На технічних терезах зважують 2 ÷ 3 г вологого осаду NaHCO3 (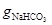 ), переносять до конічної колби для титрування (V = 250 см3), додають 80 ÷ 100 см3 дистильованої води та 1÷2 краплі індикатора метилоранжу і титрують 1 М (1 моль/дм3) розчином HCl при інтенсивному перемішуванні до переходу забарвлення розчину з жовтого до рожевого.
), переносять до конічної колби для титрування (V = 250 см3), додають 80 ÷ 100 см3 дистильованої води та 1÷2 краплі індикатора метилоранжу і титрують 1 М (1 моль/дм3) розчином HCl при інтенсивному перемішуванні до переходу забарвлення розчину з жовтого до рожевого.
Вміст NaHCO3 в отриманому осаді розраховують за формулою, %мас.:
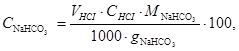 (4.14)
(4.14)
де 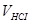 - об’єм розчину НCl з молярною концентрацією СHCl = 1 моль/дм3, що витрачено на титрування наважки осаду, cм3;
- об’єм розчину НCl з молярною концентрацією СHCl = 1 моль/дм3, що витрачено на титрування наважки осаду, cм3; 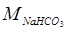 - молярна маса еквівалента NaHCO3, що дорівнює 84 г/моль;
- молярна маса еквівалента NaHCO3, що дорівнює 84 г/моль; 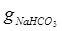 - маса осаду, який взято для титрування, г.
- маса осаду, який взято для титрування, г.
Наприклад, на титрування 2,2 г (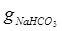 ) осаду гідрокарбонату натрію знадобилося 17,7 см3 розчину хлоридної кислоти з молярною концентрацією еквіваленту 1 моль/дм3, тоді:
) осаду гідрокарбонату натрію знадобилося 17,7 см3 розчину хлоридної кислоти з молярною концентрацією еквіваленту 1 моль/дм3, тоді:

загальна кількість NaHCO3 у осаді становитиме, г:
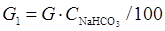 .
.
4.2.9 Результати хімічного аналізу
В процесі виконання роботи заповнити наступну таблицю.
Таблиця 4.1– Результати титрування
| № | пункт | Реагент | V реагенту, см3 | Показник, що визначається | Значення та розмірність | ||
| Середнє | |||||||
| 4.2.2 | |||||||
| 4.2.4 | |||||||
| 4.2.7 |
4.3 Обробка і представлення результатів
За рівнянням (4.12) обчислити ступінь перетворення за натрієм, %:
 (4.15)
(4.15)
де  - загальна маса NaHCO3 в отриманому осаді, г (п. 4.2.8);
- загальна маса NaHCO3 в отриманому осаді, г (п. 4.2.8); 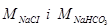 - молярні маси NaCl (58,5 г/моль) i NaHCO3 (84 г/моль);
- молярні маси NaCl (58,5 г/моль) i NaHCO3 (84 г/моль);  - розрахована наважка хлориду натрію, необхідна для приготування 100 см3 амонізованого розсолу, г (п. 4.2.4, А), Vrid = 80 – об’єм розсолу, що відібрано на карбонізацію, см3 (п. 4.2.6) – за вказівкою викладача.
- розрахована наважка хлориду натрію, необхідна для приготування 100 см3 амонізованого розсолу, г (п. 4.2.4, А), Vrid = 80 – об’єм розсолу, що відібрано на карбонізацію, см3 (п. 4.2.6) – за вказівкою викладача.
Ступінь перетворення аміаку розрахувати за рівнянням (4.6):
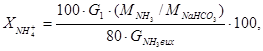 % (4.13)
% (4.13)
де  молярні маси NH3 (17 г/моль) і NaHCO3 (84 г/моль),
молярні маси NH3 (17 г/моль) і NaHCO3 (84 г/моль),  - розрахована кількість 100%-го NH3, потрібного для приготування 100 см3 амонізованого розсолу (п. 4.2.4, Б).
- розрахована кількість 100%-го NH3, потрібного для приготування 100 см3 амонізованого розсолу (п. 4.2.4, Б).
Зробити висновок щодо глибини використання вихідних
компонентів.
4.4 Техніка безпеки
1. Суворо дотримуватися правил роботи з кислотами, лугами, що викладені у загальній інструкції з техніки безпеки в хімічній лабораторії.
2. Усі роботи з концентрованою аміачною водою здійснювати тільки у витяжній шафі з використанням пробовідбірників.
3. При проведенні процесу карбонізації не залишати без догляду лабораторну установку.
4.5 Контрольні запитання
- Допуск до роботи.
1. Мета роботи. Техніка безпеки. Необхідність карбонізації аміачно-сольового розчину.
2. Схема лабораторної установки. Порядок виконання хімічних аналізів аміачної води, хлориду натрію і гідрокарбонату натрію.
- Захист роботи.
1. Послідовність перебігу хімічних реакцій процесу карбонізації аміачно-сольового розчину.
2. Рівняння швидкості абсорбції CO2. Шляхи підвищення рушійної сили абсорбції.
3. Від яких параметрів залежить швидкість кристалізації NaHCO3?
4. Що таке ступінь перетворення вихідної сировини (NaCl і NH3)?
5. Як впливає спосіб подачі реагентів (прямотечія або протитечія) на величину рушійної сили процесу абсорбції?
5 Каталітичне окиснення оксиду сульфуру (IV)
Мета роботи: провести процес каталітичного окиснення оксиду
сульфуру (IV), виконати аналізи вихідного і кінцевого газів, розрахувати ступінь перетворення оксиду сульфуру (IV) до оксиду сульфуру (VI), інтенсивність процесу та питому продуктивність каталізатора.
5.1 Стислі теоретичні відомості
Виробництво сульфатної (сірчаної) кислоти контактним способом із сірчаного колчедану або елементарної сірки складається з таких стадій:
- отримання оксиду сульфуру (IV):
 ; (5.1)
; (5.1)
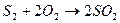 ; (5.2)
; (5.2)
- очищення оксиду сульфуру (IV) від пилу, контактних отруювачів;
- каталітичне (контактне) окиснення оксиду сульфуру (IV):
 ; (5.3)
; (5.3)
- абсорбція оксиду сульфуру (VI) 98,5%-вою кислотою з отримуванням олеуму (моногідрат, в якому розчинено S03 ):
 . (5.4)
. (5.4)
У промислових умовах на контактування (після очищення і сушки) надходить газова суміш, як правило, такого складу, об’ємні частки, %об.:
SO2 : 7,5 ÷ 12,0; О2 : 12,0 ÷ 6,75; SO3 : до 0,5; решта азот.
Рівноважний ступінь перетворення Хр за реакцією (5.3) за атмосферного тиску (101325 Па), для газової суміші складу, об’ємні частки, %, SO2 – 10; О2 – 11,5; N2 – решта, має наступні значення залежно від температури:
| t, °С | |||||
| Хр, % | 99,0 | 97,2 | 93,3 | 85,5 | 60,6 |
Таким чином, при температурах близько 673 К (400 °С) окиснення оксиду сульфуру (IV) може відбуватися практично повністю. При температурах більш як 873 К (600 °С) ступінь перетворення SO2 стає недопустимо низькою для виробництва. Тому, з погляду повноти перетворення оксиду сульфуру (IV) на оксид сульфуру (VI), треба було б вибирати якомога більш низьку температуру. Однак для остаточного вибору температури процесу необхідно також враховувати і швидкість реакції. При температурі 673 К (400 °С) окиснення оксиду сульфуру (IV) відбувається з достатньою для виробництва швидкістю лише на платиновому каталізаторі, який має найвищу активність порівняно з іншими каталізаторами. Але цей каталізатор є найдорожчим і дуже чутливим до контактної отрути.
Нині у промисловості використовують ванадієві каталізатори (марок СВД; ІК-1-4; ІК-1-6; СВС; МВС; КД; УК-38; RHV-59 та ін.), температура запалювання яких становить 643÷683 К (370 ÷ 410 °С), а верхня температурна межа –873÷973 К (600 ÷ 700 °C) (при більш високій температурі каталізатори спікаються і термічно дезактивуються). Активною складовою цих каталізаторів є оксид ванадію V2O5.
– Конец работы –
Эта тема принадлежит разделу:
ЗАГАЛЬНА ХІМІЧНА ТЕХНОЛОГІЯ
Національний технічний університет України... Київський політехнічний інститут... ЕЛЕКТРОННЕ НАВЧАЛЬНЕ ВИДАННЯ...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Опис схеми установки
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов