рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Приготування робочого розчину соди
Реферат Курсовая Конспект
Приготування робочого розчину соди
Приготування робочого розчину соди - раздел Химия, ЗАГАЛЬНА ХІМІЧНА ТЕХНОЛОГІЯ Для Приготування Робочого Розчину Соди Об’Ємом 100 (250) См3 І Кон...
Для приготування робочого розчину соди об’ємом 100 (250) см3 і концентрацією до 10 % (мас.) (за завданням викладача) необхідно розрахувати наважку заданої проби соди з урахуванням вмісту  та домішок.
та домішок.
Приклад розрахунку наважки заданої проби соди.
Приготувати 250 см3 розчину з масовою часткою соди 10%, густина якого ρ = 1,075 г/см3. Вміст 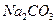 в технічній соді становить 92% (визначається згідно п.1.2.2).
в технічній соді становить 92% (визначається згідно п.1.2.2).
Визначаємо масу соди, необхідну для приготування розчину, г:
 .
.
Враховуючи  в даному зразку, отримуємо остаточну масу наважки технічної соди, г:
в даному зразку, отримуємо остаточну масу наважки технічної соди, г:
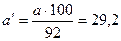 .
.
Отже, для приготування заданого розчину необхідно взяти 29,2 г
соди.
1.2.4 Розрахунок кількості вапна
Процес каустифікації відбувається за реакціями:
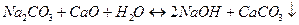 ; (1.21)
; (1.21)
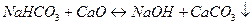 . (1.22)
. (1.22)
Розрахунок необхідної кількості вапна з заданим надлишком проводять на основі даних аналізу заданого зразка соди (п. 1.2.2) та маси наважки соди, розрахованої в п. 1.2.3.
Наприклад, необхідно розрахувати кількість вапна для проведення процесу каустифікації, якщо для процесу використовується 250 см3 розчину соди (див. розрахунок у п.1.2.3) і вапно з масовою часткою СаО 70%; надлишок вапна 10%; масова частка NaHCO3 у пробі соди становить 6%.
Для реакції (1.13) необхідно СаО, г:
 ,
,
де 26,9 - маса Na2CO3необхідна для приготування розчину, г; 56 та 106 - молярні маси СаО та Na2CO3, г/моль.
За реакцією (1.16) витрата СаО становить, г:
 ,
,
де 29,2 – маса наважки соди (з урахуванням вмісту  ), г; 6 – масова частка NaHCO3 у пробі соди, %; 56 та 84 – молярні маси СаО та NaHCO3, г/моль.
), г; 6 – масова частка NaHCO3 у пробі соди, %; 56 та 84 – молярні маси СаО та NaHCO3, г/моль.
Загальна маса 100%-го вапна становить, г:
 ;
;  .
.
Враховуючи масову частку СаО у пробі (70%) і заданий надлишок (10%), отримаємо кінцеву масу СаО, необхідну для проведення процесу каустифікації, г:
 .
.
1.2.5 Каустифікація содового розчину
Розраховані наважки соди (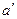 ) та вапна (
) та вапна (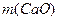 ) зважують на технічних терезах. Розчин соди готують безпосередньо у каустифікаторі (поз. 1): відміряють необхідну кількість дистильованої води для приготування розчину за допомогою циліндра, переносять її до каустифікатора і туди ж додають наважку соди. Вмикають мішалку (поз. 5) та нагрівач
) зважують на технічних терезах. Розчин соди готують безпосередньо у каустифікаторі (поз. 1): відміряють необхідну кількість дистильованої води для приготування розчину за допомогою циліндра, переносять її до каустифікатора і туди ж додають наважку соди. Вмикають мішалку (поз. 5) та нагрівач
(поз. 2).
Увага! Після досягнення температури розчину соди ~ 353 К (80°С) під час занурення у каустифікатор термометра та внесення вапна мішалку вимкнути! Захистити очі окулярами!
В три прийоми (інтервал ~1 хв) завантажують зважену кількість проби вапна. Каустифікацію проводять при перемішуванні протягом 30 хвилин, відлік часу починають з моменту внесення до каустифікатора останньої порції вапна. Потім зупиняють мішалку, вимикають нагрівання і
дають суспензії відстоятися та охолонути.
Після охолодження реакційної суміші відділяють осад CaCO3 на воронці Бюхнера; фільтрат збирають у мірну колбу на 250 (500) см3 Vк і доводять об’єм до позначки дистильованою водою.
1.2.6 Аналіз лужного розчину на вміст NaОН та Na2CO3
Для аналізу отриманого в результаті каустифікації фільтрату з мірної колби відбирають дві аліквоти розчину по 25 см3 кожна і переносять їх до конічних колб. Титрування проводять розчином HCl з молярною концентрацією еквівалента С(HCl) = 1 моль/дм3.
Першу аліквоту титрують в присутності фенолфталеїну, попередньо до колби з аліквотою додають 50 см3 дистильованої води і 20 ÷ 30 см3 розчину BaCl2 з масовою часткою 10% (додавання розчину хлориду барію здійснюють для виведення з розчину іонів СО32-, зв’язуючи їх у важкорозчинну сполуку ВаСО3) до знебарвлення, при цьому відбувається наступна реакція:
 . (1.23)
. (1.23)
Титрування повторюють 2 ÷ 3 рази, розраховують середні значення об’ємів (см3).
Згідно з законом еквівалентів:
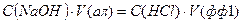 , (1.24)
, (1.24)
де 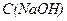 ,
, 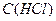 - молярна концентрація еквіваленту,
- молярна концентрація еквіваленту,
моль-екв/дм3,  - об’єм соляної кислоти, який пішов на титрування,см3;
- об’єм соляної кислоти, який пішов на титрування,см3; 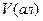 - об’єм аліквоти, 25 см3.
- об’єм аліквоти, 25 см3.
Тоді:
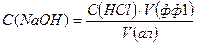 . (1.25)
. (1.25)
Кількість моль-екв  , що міститься в аліквоті 25 см3:
, що міститься в аліквоті 25 см3:
 . (1.26)
. (1.26)
Маса  , що міститься у фільтраті 250 (500)см3:
, що міститься у фільтраті 250 (500)см3:
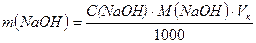 , (1.27)
, (1.27)
де - молярна маса еквіваленту – 40 г/моль,
- молярна маса еквіваленту – 40 г/моль,  - об’єм мірної колби з фільтратом.
- об’єм мірної колби з фільтратом.
Другу аліквоту титрують також в присутності фенолфталеїну, але без додавання BaCl2 до знебарвлення, при титруванні відбуваються наступні реакції:
 ; (1.28)
; (1.28)
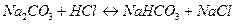 . (1.29)
. (1.29)
Титрування повторюють 2 ÷ 3 рази, розраховують середні значення об’ємів (см3).
Згідно з законом еквівалентів:
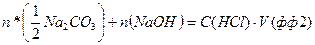 , (1.30)
, (1.30)
де 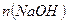 - кількість моль-екв
- кількість моль-екв  , що міститься в аліквоті;
, що міститься в аліквоті; 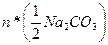 -кількість моль-екв
-кількість моль-екв 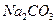 , що міститься в аліквоті, тоді:
, що міститься в аліквоті, тоді:
 . (1.31)
. (1.31)
Маса 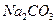 у фільтраті становить:
у фільтраті становить:
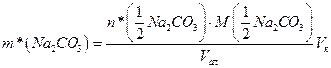 . (1.32)
. (1.32)
1.2.7 Матеріальний баланс процесу каустифікації за натрієм
При складанні матеріального балансу перерахунок інгредієнтів реакційної суміші на натрій здійснюється за формулами:
 ; (1.33)
; (1.33)
 ; (1.34)
; (1.34)
 , (1.35)
, (1.35)
де а – маса Na2CO3 у вихідній пробі соди (див. п. 1.2.3), г; а´ – маса вихідної наважки проби соди (див. п. 1.2.3), г; ω(NaHСО3) – масова частка NaHСО3 у вихідній пробі соди (див. п. 1.2.2), %; m(NaОН) – маса NaОН у лужному розчині (див. п. 1.2.6); 23, 40, 106, 84 – молярні маси відповідно Na, NaOH, Na2CO3, NaHСО3, г/моль.
Таблиця 1.1 – Матеріальний баланс процесу каустифікації (за натрієм)
| № п/п | Прихід Na | Маса, г | № п/п | Витрата Na | Маса, г |
Внесено Na з Na2СО3 (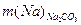 ) )
| Перейшло Na у NaОН (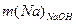 ) )
| ||||
Внесено Na з NaНСО3 ( ) )
| Втрати Na зі шламом і т. п. (визначається за різницею) | ||||
| Разом Na | Разом Na |
1.2.8 Розрахунок ступеня каустифікації та використання натрію
Ступінь каустифікації (ступінь перетворення вихідної сировини - технічної соди) визначається зі співвідношення, %:
 , (1.36)
, (1.36)
де  - маса наважки технічної соди, г;
- маса наважки технічної соди, г;  - маса
- маса 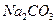 у фільтраті, г;
у фільтраті, г; 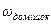 - масова частка домішок в технічній соді (п. 1.2.2).
- масова частка домішок в технічній соді (п. 1.2.2).
Вихід каустичної соди розраховуємо за формулою:
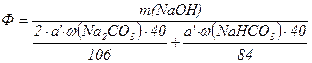 , (1.37)
, (1.37)
де 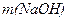 - маса
- маса  у фільтраті,г;
у фільтраті,г; 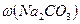 ,
, 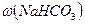 - масові частки
- масові частки  та
та в технічній соді, 40, 106, 84 – молярні маси відповідно NaOH, Na2CO3, NaHСО3, г/моль.
в технічній соді, 40, 106, 84 – молярні маси відповідно NaOH, Na2CO3, NaHСО3, г/моль.
1.3 Техніка безпеки
1. Внесення реагентів в реактор та замір температури розчину проводити при вимкненій мішалці і в захисних окулярах!
2. Суворо дотримуватись правил роботи з лугами та кислотами.
3. Виконувати правила роботи з нагрівальними приладами.
4. Не залишати установку в робочому стані без нагляду.
1.4 Контрольні запитання
- Допуск до роботи:
1. Мета роботи. Техніка безпеки. Фізико-хімічні основи процесу каустифікації.
2. Принцип аналізу технічної соди на вміст Na2CO3 та NaHCO3.
3. Принцип аналізу лужного розчину на вміст NaОН та Na2CO3.
- Захист роботи:
1. Технологічні схеми виробництва каустичної соди.
2. Область протікання процесу каустифікації та способи його інтенсифікації.
3. Обґрунтування технологічного режиму процесу каустифікації.
2 Флотаційне збагачення сульфурної руди
Мета роботи: вивчити процес флотації сульфурної руди на лабораторній флотаційній машині, виконати аналіз вихідної сировини і продуктів збагачення, визначити вихід концентрату, ступінь вилучення сульфуру (сірки) і коефіцієнт концентрування.
2.1 Стислі теоретичні відомості
Тверда сировина практично завжди є багатокомпонентною сумішшю різних мінералів. В хіміко-технологічних процесах використовується, як правило, лише один з таких компонентів, інші є домішками. Чим менша частка домішок у сировині, тим чистішими виходять цільові продукти (вище якість продукції), тим менша доля викидів, тим менші витрати на транспортування, зберігання, перевантаження сировини. Використання сировини з меншим вмістом домішок дає змогу заощаджувати реагенти, за допомогою яких сировина піддається перетворенню у цільові продукти.
Збагачення (концентрування) сировини – це технологічний процес підвищення в ній вмісту корисного компонента за допомогою механічних засобів, фізико-хімічних процесів або хімічних взаємодій.
В умовах знаходження в земній корі між різними твердими речовинами утворюються щільні механічні зв’язки. Тому при збагаченні будь-якої твердої сировини первинною процедурою завжди буде її подрібнення та розмелювання, внаслідок чого:
- суттєво зменшуються розміри і маса окремої частинки сировини;
- збільшується поверхня сировинного матеріалу, що сприяє прискоренню подальших фізичних, фізико-хімічних і хімічних процесів;
- збільшується щільність пакування матеріалу, що зручно для транспортування, зберігання і перевантаження;
- розриваються природні механічні зв’язки між різними компонентами сировини, що створює необхідні передумови для їх подальшого немеханічного відокремлення один від одного.
Отже, після розмелювання між компонентами сировини не існує щільного механічного зв’язку і вони легше піддаються роздіенню.
Флотаційне збагачення відноситься до фізико-хімічних методів, тобто до таких, в яких процеси перебігають на поверхні розподілу різних фаз під дією міжмолекулярних сил.
Термін «флотація» походить від англійського слова flotatiоn, що означає «спливання». Як метод збагачення твердої мінеральної сировини флотаційний метод є дуже поширеним. Флотацію використовують для розділення різноманітних сульфідних руд, відокремлення апатиту від нефеліну, збагачення кам’яного вугілля і багатьох інших мінералів.
Флотаційне збагачення стає можливим через різну здатність до змочування компонентів твердої сировини.
Існують різні способи примусити тверду речовину підійматися (спливати) на поверхню рідини. Найбільш поширеною є так звана пінна флотація. В хімічній технології та інженерії піна відноситься до гетерогенних (багатофазових) систем типу «газ-рідина». Для покращення спливання твердої частинки до пінного шару через розчин пропускають повітря. Очікуваний результат збагачення - концентрат, в даному випадку – флотоконцентрат. Відходи збагачення мають назву «хвости».
Якщо взаємодія між водою і твердою частинкою буде достатньо сильною, то частинка буде добре змочена рідиною. В цьому разі навколо твердої частинки виникає стійка водна оболонка, яка перешкоджатиме з’єднанню цієї частинки з бульбашкою повітря і частинка на поверхню рідини підніматися не буде. Такі тверді частинки, які добре змочуються водою, носять назву «гідрофільні».
В разі ж, якщо поверхнева взаємодія між водою і твердою частинкою слабка (частинка «відштовхує» воду) виникають сприятливі умови для з’єднання твердої частинки із бульбашкою повітря. Не змочувані тверді частинки носять назву «гідрофобні».
Здатність змочуватися (гідрофільність) або не змочуватися водою (гідрофобність) це не лише якісне, а і кількісне поняття. Кількісною характеристикою здатності до змочування мінералів є крайовий кут змочування 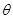 . Це уявний кут, що утворюється уздовж межі розділу фаз тверде тіло - рідина - повітря (рисунок 2.1). З незмочуваними частинками мінералу (1) рідина утворює тупий крайовий кут
. Це уявний кут, що утворюється уздовж межі розділу фаз тверде тіло - рідина - повітря (рисунок 2.1). З незмочуваними частинками мінералу (1) рідина утворює тупий крайовий кут 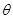 , а із змочуваними частинками (2) - гострий. Сили поверхневого натягу прагнуть вирівняти рівень рідини, внаслідок чого частинка, яка не змочується (гідрофобна), прилипає до бульбашок повітря і підіймається до поверхні, а частка, яка змочується (гідрофільна), залишається зануреною у рідину.
, а із змочуваними частинками (2) - гострий. Сили поверхневого натягу прагнуть вирівняти рівень рідини, внаслідок чого частинка, яка не змочується (гідрофобна), прилипає до бульбашок повітря і підіймається до поверхні, а частка, яка змочується (гідрофільна), залишається зануреною у рідину.

Рисунок 2.1 - Крайовий кут змочування для гідрофобних (1) і гідрофільних (2) мінералів
Більшість мінералів природних руд мало відрізняються за здатністю до змочування одне від одного. Для їх розділення необхідно створювати умови неоднакової здатності до змочування водою окремих компонентів породи, для чого використовують різноманітні хімічні сполуки - флотаційні реагенти, що вибірково підсилюють або послаблюють здатність до змочування, а також здатність прилипати до бульбашок повітря завислих мінеральних часток.
Внесені до пульпи флотаційні реагенти, що називаються збирачами (колекторами), адсорбуються поверхнею певного мінералу (мінералів), утворюючи гідрофобний адсорбційний шар. Після цього штучно гідрофобізовані частинки вже здатні приєднатися до бульбашок повітря і вони піднімаються до поверхні пульпи у піну і вилучаються разом із нею. Збирачами є поверхнево-активні органічні речовини, наприклад гас, жирні кислоти (олеїнова, нафтенові та ін.) та їх солі - мила.
Мінералізована піна (пінний продукт), яка містить флотаційний концентрат, мусить бути стійкою, щільною і рухомою. Така піна утворюється при внесенні до суспензії піноутворювачів, поверхнево-активних речовин, що утворюють адсорбційні плівки на поверхні бульбашок повітря. До найбільш ефективних піноутворювачів відносять соснове масло, спінювачі ОПСБ, Т-80 та ін. Витрати спінювачів становлять 25 ÷ 100 г/т.
Слід також мати на увазі той факт, що колектори і піноутворювачі доповнюють, але не замінюють повністю один одного. Якщо для проведення флотації додавати лише колектори, то процес буде неефективним через недостатні поверхнево-активні властивості і неміцну піну. Якщо ж додавати лише піноутворювачі, а колектори не додати, то флотація буде, по-перше, не вибірковою, а по-друге, мінеральні частинки, що сплили, одразу ж тонутимуть через те, що саме колектори ще й утворюють міцний поверхневий зв’язок між твердою частинкою і бульбашкою.
Для зміни флотованості мінералів використовують групу реагентів, що поєднуються під однією назвою модифікатори. До них належать: депресори, активатори і регулятори середовища. До депресорів, які підвищують здатність до змочування твердих часток, відносять: вапно, ціаніди, цинковий купорос, силікат натрію (рідке скло), сульфіт натрію та ін. Активатори (використовують для активації поверхні) - мідний купорос, сульфатна кислота, сульфід натрію та ін. До регуляторів середовища відносять: вапно, соду, сульфатну кислоту. Для прискорення осаджування пустої породи додають коагулянт - крохмаль.
Процес флотації здійснюють у флотаційних машинах, де пульпа перемішується і насичується повітрям, яке диспергується на дрібні бульбашки. За способом перемішування і аерації пульпи флотаційні машини поділяють на механічні, пневмомеханічні і пневматичні.
– Конец работы –
Эта тема принадлежит разделу:
ЗАГАЛЬНА ХІМІЧНА ТЕХНОЛОГІЯ
Національний технічний університет України... Київський політехнічний інститут... ЕЛЕКТРОННЕ НАВЧАЛЬНЕ ВИДАННЯ...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Приготування робочого розчину соди
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов