рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Социология
- /
- Определение точки эквивалентности при кислотно-основном титровании. Индикаторы.
Реферат Курсовая Конспект
Определение точки эквивалентности при кислотно-основном титровании. Индикаторы.
Определение точки эквивалентности при кислотно-основном титровании. Индикаторы. - раздел Социология, Методические рекомендации и социальному развитию Точка Эквивалентности В Методах Ацидометрии И Алкалиметрии Определяется По Из...
Точка эквивалентности в методах ацидометрии и алкалиметрии определяется по изменению кислотности среды (рН растворов).
Для экспериментального установления точки эквивалентности пользуются индикаторами – веществами, которые изменяют окраску в зависимости от рН раствора.
Момент титрования, когда индикатор изменяет окраску, называется точкой конца титрования. Очевидно, что необходимо выбирать индикатор и условия титрования так, чтобы точка конца титрования совпадала с точкой эквивалентности или была возможно ближе к последней.
Индикаторы — довольно сложные органические вещества, являющиеся слабыми кислотами или основаниями. Окраска молекулярной и ионизированной форм этих веществ различна.
Различают одноцветные, у которых одна из форм бесцветна, и двуцветные индикаторы. Например, фенолфталеин – одноцветный индикатор, он бесцветен в кислой и нейтральной средах и малиновый – в щелочной. Метиленовый оранжевый – двуцветный, он принимает розовую окраску в кислой среде и желтую – в нейтральной и щелочной средах.
Допустим, что индикатор является слабой кислотой, тогда равновесие его ионизации можно записать уравнением:
HInd ↔ Ind¯ + H+,
где Ind¯ – сложный органический анион.
По закону действующих масс константа равновесия:
Ка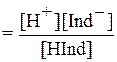
Обычно индикатор добавляется к раствору кислоты или основания, находящихся в значительном избытке по сравнению с концентрацией индикатора, поэтому равновесная концентрация ионов водорода определяется концентрацией сильного электролита:
Ka × [HInd]
[H+] = ——————
[Ind–]
После логарифмирования уравнение примет вид:
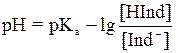
Если равновесные концентрации недиссоциированной и диссоциированной форм равны,то
рН = рКа
Это значение рН называется точкой перехода индикатора.
Однако при изменении рН раствора переход окраски происходит в некотором интервале значений рН. Практически установлено, что окраску одной формы индикатора можно различить на фоне другой, если ее концентрация составляет не менее 1/10 от концентрации другой формы.
Область значений рН, в которой наблюдается видимое для глаза изменение окраски индикатора, называется интервалом перемены окраски индикатора. Ее границы обычно ∆рН = рКа ± 1.
Для каждого индикатора можно определить значение рН, называемое показателем титрования (рТ), при котором происходит наиболее отчетливое изменение окраски.
Например, интервал перемены окраски метиленового оранжевого находится в пределах рН от 3.1 до 4.4. Внутри этого интервала окраска постепенно изменяется от розовой к желтой. Показатель титрования этого индикатора равен 4.0. Это значение находится внутри интервала перехода окраски данного индикатора, но не совпадает с рКа = 3.34.
Свойства некоторых индикаторов
| Индикатор | Интервал изменения окраски | рКа инд. | Окраска индикатора | |
| кислотная форма | основная форма | |||
| тимоловый синий | 1,2-2,8 | 1,7 | красная | желтая |
| метиловый оранж. | 3,1-4,4 | 4,0 | красная | желтая |
| метиловый красн. | 4,2-6,2 | 5,5 | красная | желтая |
| лакмус | 5,0-8,0 | 7,0 | красная | синяя |
| п-нитрофенол | 5,6-7,4 | 6,5 | бесцветная | желтая |
| бромтимоловый | 6,0-7,6 | 7,0 | желтая | синяя |
| нейтральный красн. | 6,8-8, 0 | 7,5 | красная | желтая |
| фенолфталеин | 8,2-9,8 | 9,0 | бесцветная | малиновая |
| тимолфталеин | 9,3-10,5 | 9,9 | бесцветная | синяя |
– Конец работы –
Эта тема принадлежит разделу:
Методические рекомендации и социальному развитию
Методические рекомендации... К лабораторно практическим занятиям по общей химии...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Определение точки эквивалентности при кислотно-основном титровании. Индикаторы.
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов