рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Социология
- /
- Кривые титрования
Реферат Курсовая Конспект
Кривые титрования
Кривые титрования - раздел Социология, Методические рекомендации и социальному развитию В Процессе Кислотно-Основного Титрования Происходит Изменение Концентрации И...
В процессе кислотно-основного титрования происходит изменение концентрации ионов водорода и соответственно рН раствора.
Графическое изображение зависимости рН от объёма добавляемого рабочего раствора (или от степени нейтрализации анализируемого раствора) называется кривой титрования.
1. Нейтрализация сильной кислоты сильным основанием
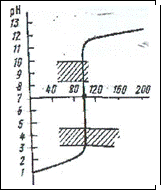
HCl + NaOH = NaCl + H2O
В начале титрования добавление небольшого количества щелочи не оказывает влияние на рН раствора. По мере приближения к точке эквивалентности увеличение рН идет более быстро. Добавление последней капли рабочего раствора приводит к резкому изменению рН титруемого раствора и изменению цвета индикатора.
Резкое изменение рН раствора вблизи точки эквивалентности называется скачком титрования. Середина скачка титрования соответствует точке эквивалентности.
В данном случае рН в точке эквивалентности будет нейтральной, т.к. образующаяся в результате реакции нейтрализации соль не подвергается гидролизу.
Следовательно, при титровании сильных кислот сильными основаниями (и наоборот) можно применять индикаторы, интервал перемены окраски которых от 4 до 10 (метиловый красный, метиловый оранжевый, фенолфталеин и др.). Наиболее подходящим будет тот, у которого рТ=7.
Однако необходимо учесть, что присутствие растворимого оксида углерода (IV) в растворе смещает рН точки эквивалентности в кислую среду, поэтому обычно применяют метиловый оранжевый (рТ=4). Довольно значительное отклонение рТ данного индикатора от рН в точке эквивалентности в данном случае не имеет значения, т.к. для изменения окраски индикатора необходимо прилить к раствору очень малый (менее 1 капли) избыток рабочего раствора.
2. Нейтрализация слабой кислоты сильным основанием (и наоборот)

СН3СООН + NaOH = CH3COONa + Н2O
В точке эквивалентности реакция среды будет щелочной вследствие гидролиза образующейся соли:
СН3СООˉ + Н2O = СН3СООН + ОНˉ
Скачок титрования находится в пределах рН от 7.8 до 10, а точка эквивалентности примерно при рН = 8.9, поэтому следует применять индикаторы, изменяющие окраску при рН > 7, например, фенолфталеин, у которого рТ = 9.
3. Нейтрализация слабого основания сильной кислотой (и наоборот)
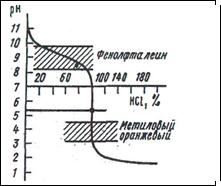
NH4OH + HCl = NH4Cl + Н2O
В точке эквивалентности реакция среды будет кислой, вследствие гидролиза образующейся соли:
NH4+ + Н2O = NH4OH + H+
Скачок титрования находится в пределах рН от 4.0 до 6.2, а точка эквивалентности при рН = 5.1. Поэтому следует применять индикаторы, изменяющие окраску при рН < 7, например, метиловые оранжевый или красный. Таким образом, при выборе индикатора в методе нейтрализации необходимо учитывать следующее:
· индикатор должен изменять свой цвет при значениях рН близких к точке эквивалентности;
· переход цвета индикатора должен быть удобен для зрительного восприятия (порядок титрования). Например, фенолфталеин удобно использовать при титровании кислоты щелочью, т.к. при этом бесцветная окраска индикатора сменяется на малиновую.
Лабораторная работа №1. Приготовление раствора H2SO4 с С(½H2SO4) = 0.1 моль/л
Исходный раствор H2SO4 имеет:
ρ (плотность) = _____г/мл (найдена с помощью ареометра);
ω(массовая доля) = _____% (см. приложение 1);
а) расчет массы навески безводной H2SO4, необходимой для приготовления раствора с С(½H2SО4) = 0,1моль/л объемом 0,2 л; M(H2S04)= 98 г/моль;
m(H2SО4) = С(½H2SО4) × V(H2SО4) × М(½H2SО4) = …(г),
где М(½H2SО4) = ½ × М(H2SО4).
б) расчет массы навески раствора H2SO4 c ω(%) = …
m(H2SО4) × 100
m´(р-раH2SО4) = ——————— = …_(г).
ω
в) расчет объема раствора H2SO4 с ρ = … г/мл.
m´(р-раH2SО4)
V(р-ра H2SО4) = ——————— =_… (мл).
ρ (р-раH2SО4)
Примечание: m и m' рассчитывают с точностью до сотых долей единицы; V(H2SO4) – c точностью до сотых долей, затем округляют до десятых.
Приготовление раствора. Рассчитанный объем раствора H2SO4 отмеряют при помощи мерного цилиндра (или бюретки), осторожно вливают в мерную колбу, затем доливают до метки дистиллированной водой и тщательно перемешивают.
Окончание работы. Раствор из колбы переливают в бутылочку, на этикетке пишут факультет, номер группы, фамилию. Бутылочку с раствором ставят в лабораторный стол, на котором указан номер группы и факультет.
Приложение №1. Плотность и концентрация раствора серной кислоты.
| ρ, г/см | 1,013 | 1,027 | 1,040 | 1,055 | 1,069 | 1,083 | 1,098 | 1,112 |
| ω, % |
Лабораторная работа 2. Установление концентрации рабочего раствора серной кислоты по стандартному раствору тетрабората натрия Nа2В4О7.
Концентрация рабочего раствора С(1/2 Na2B4O7) =
0.l моль/л. Индикатор-метиловый оранжевый (интервал перемены окраски 3.1–4.4).
Уравнение реакции:
Na2B4О7 + 7Н2О = 2NaOH + 4Н3ВО3
Методика титрования.
Стандартный раствор буры объемом 10 мл, отмеренный пипеткой Мора, титруют раствором серной кислоты в присутствии 1 капли индикатора до появления оранжево-розовой окраски.
Для повышения точности титрования можно использовать "свидетель", который готовят, отмерив в колбу 10 мл воды, 1 каплю кислоты и1 каплю индикатора. Пробу титруют до появления такой же окраски как в колбе-свидетеле. Розовая окраска в конце титрования означает, что в колбе избыток кислоты около 1 капли.
Обработка результатов эксперимента.
Титрование проводят с точностью до сотых долей миллилитра. Из совокупности отдельных результатов отбросьте промахи (сходимость результатов 0,1 мл) и найдите среднее значение из трёх сходящихся результатов.
Расчет молярной концентрации эквивалента серной кислоты по закону эквивалентов:
C(1/2H2SO4) = 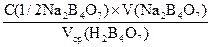 , моль/л
, моль/л
Концентрацию рассчитывают с точностью до трёх значащих цифр. Оформляют работу и сдают преподавателю.
Лабораторная работа 3. Определение концентрации и массы КОН или NaOH в растворе.
Концентрация рабочего раствора серной кислоты устанавливается в предыдущем опыте. Индикатор-метиловый оранжевый.
Уравнение реакции:
H2SO4 + 2NaOH = 2H2O + Na2SO4
Методика титрования.
Полученный в мерной колбе исследуемый раствор (задача) доводят дистиллированной водой до метки и тщательно перемешивают. Объём раствора, равный 10 мл, отмеренный пипеткой Мора, титруют раствором серной кислоты в присутствии 1 капли индикатора до появления оранжево-розового окрашивания. Возможно использование колбы–"свидетеля", приготовленного в предыдущей лабораторной работе.
Обработка результатов эксперимента.
Титрование проводят с точностью до сотых долей миллилитра. Из совокупности результатов выбирают три сходимых результата и рассчитывают средний объём щелочи, пошедший на титрование стандартного раствора.
Расчет концентрации и массы щелочи в исследуемом растворе:
а) по закону эквивалентов:
С (NaOH) = 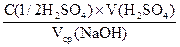 , моль/л
, моль/л
б) m(NaOH) = C(NaOH) × м(NaOH) × V¢(NaOH) × 1000, мг,
где M(NaOH) — молярная масса эквивалента NaOH
V¢ (NaOH) = 0.1 л — объем задачи.
Результаты сдаются преподавателю. Расчеты проводят с точностью до трёхзначащих цифр.
– Конец работы –
Эта тема принадлежит разделу:
Методические рекомендации и социальному развитию
Методические рекомендации... К лабораторно практическим занятиям по общей химии...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Кривые титрования
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов