рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Электроника
- /
- Вид работы: Лекции
- /
- Лекция 14
Реферат Курсовая Конспект
Лекция 14
Лекция 14 - Лекция, раздел Электроника, Тепловое излучение 9.3. Периодическая Система Элементов Д.и. Менделеева В 1869 Г. Менде...
9.3. Периодическая система элементов Д.И. Менделеева
В 1869 г. Менделеев открыл периодический закон изменения химических и физических свойств элементов в зависимости от их атомных масс. Химические элементы в таблице Менделеева расположены периодами. В одном вертикальном ряду, группе, у элементов обнаруживаются сходные физико-химические свойства. Менделеев ввел понятие порядкового номере элемента. Расположив элементы в порядке возрастания номеров, он получил полную периодичность изменения химических свойств элементов. Часть клеток периодической системы осталась свободной, т.к. соответствующие элементы не были еще известны, т.е. Менделееву на основании закона, открытого им, удалось предсказать целый ряд новых химических элементов. Позднее эти элементы были открыты.
Порядковый номер элемента z в периодической системе совпадает с числом положительных элементарных зарядов в ядре и возрастает на единицу при переходе от одного элемента периодической системы к следующему. Свойства элементов отличается поведением внешних валентных электронов их атомов. Поэтому периодичность свойств химических элементов связана с определенной периодичностью в расположении электронов в атомах различных элементов.
Теория периодической системы основывается на следующих компонентах:
1. порядковый номер химического элемента равен общему числу электронов в атоме данного элемента;
2. состояние электронов в атомах определяется набором их квантовых чисел n,  , т и тs. Распределение электронов в атоме по энергетическим состояниям удовлетворяет принципу минимума потенциальной энергии: с возрастанием числа электронов каждый следующий электрон должен занять возможное энергетическое состояние, соответствующее наименьшей энергии;
, т и тs. Распределение электронов в атоме по энергетическим состояниям удовлетворяет принципу минимума потенциальной энергии: с возрастанием числа электронов каждый следующий электрон должен занять возможное энергетическое состояние, соответствующее наименьшей энергии;
3. заполнение электронами энергетических состояний в атоме происходит по принципу Паули.
Электроны в атоме, занимающие совокупность состояний с одинаковым значением главного квантового числа п, образуют электронную оболочку или электронный слой. В зависимости от значений п различают ряд оболочек:
| n | Символ оболочки | Мах число электронов |
| К | ||
| L | ||
| М | ||
| N | ||
| О |
В каждой из оболочек электроны распределяются по подгруппам (подоболочкам), каждая из которых соответствует определенному значению  .
.
Электронное состояние в атоме принято обозначать символом n , который указывает значение двух квантовых чисел. Электроны, которые находятся в состояниях с одинаковым n
, который указывает значение двух квантовых чисел. Электроны, которые находятся в состояниях с одинаковым n , называют эквивалентными. Число эквивалентных электронов определяется произведением z: п
, называют эквивалентными. Число эквивалентных электронов определяется произведением z: п Z. Если электроны находятся в некоторых состояниях с определенными значениями п и
Z. Если электроны находятся в некоторых состояниях с определенными значениями п и  , то говорят, что задана электронная конфигурация. Например, атом кислорода: 1s2; 2s2 ; 2p4 - два электрона в состояниях п =1,
, то говорят, что задана электронная конфигурация. Например, атом кислорода: 1s2; 2s2 ; 2p4 - два электрона в состояниях п =1,  = 0, два электрона в состояниях п = 2,
= 0, два электрона в состояниях п = 2,  = 0 и четыре электрона в состояниях п = 2,
= 0 и четыре электрона в состояниях п = 2,  = 1.
= 1.
Для полного описания состояния атома сведений, которые дает таблица Менделеева, недостаточно. Порядок заполнения электронных состояний в оболочках атомов и в подоболочках (подгруппах) должен соответствовать последовательности расположения энергетических уровней с данными п и  . Сначала заполняются состояния с наименьшей возможной энергией, а затем состояния с более высокой энергией и т.д. Для легких атомов сначала заполняются оболочки с меньшим п. В пределах одной оболочки сначала заполняются состояния с
. Сначала заполняются состояния с наименьшей возможной энергией, а затем состояния с более высокой энергией и т.д. Для легких атомов сначала заполняются оболочки с меньшим п. В пределах одной оболочки сначала заполняются состояния с  = 0, затем
= 0, затем  = 1 и т.д. до
= 1 и т.д. до  = п — 1.
= п — 1.
Атом каждого последующего элемента в таблице Менделеева можно представить как атом предыдущего элемента с добавлением одного протона к ядру, и один электрон, находящийся на периферии атома. Таким образом, распределение электронов по состояниям, имеющееся в данном атоме, должно соблюдаться и в атоме следующего элемента. Но это условие выполняется не всегда, т.к. существует взаимодействие между электронами. В результате этого взаимодействия для достаточно больших главных квантовых чисел п состояния с большим п и малым  могут иметь меньшую энергию, т.е. быть энергетически более выгодными, чем состояния с меньшим п, но большим
могут иметь меньшую энергию, т.е. быть энергетически более выгодными, чем состояния с меньшим п, но большим  .
.
Рассмотрим последовательность заполнения электронами состояний в атомах элементов, находящихся в основном состоянии. В атоме водорода один электрон, 1s, п = 1,  = 0, т = 0. Проекция его спина на направление внешнего поля характеризуется квантовыми числами ms = ±
= 0, т = 0. Проекция его спина на направление внешнего поля характеризуется квантовыми числами ms = ± 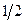 .
.
Не - два электрона, второй электрон может находиться в состоянии 1s, т.е., п = 1,  = 0, т = 0, но спин его ориентирован противоположно спину первого. (ms = 1/2; ms = - 1/2). Группа состояний п=1,
= 0, т = 0, но спин его ориентирован противоположно спину первого. (ms = 1/2; ms = - 1/2). Группа состояний п=1,  = 0, т = 0, ms = ± 1/2 образуют заполненную К-оболочку атома (1-й период системы Менделеева).
= 0, т = 0, ms = ± 1/2 образуют заполненную К-оболочку атома (1-й период системы Менделеева).
Li содержит три электрона. Согласно принципу Паули, третий электрон не может разместиться в К-оболочке и занимает состояние с наименьшей энергией (из оставшихся свободных состояний). Это состояние п = 2 (L-оболочка). Тогда для Li электронная конфигурация 1s2 ; 2s1 –он открывает L-оболочку.
Be – 4 электрона: 1s2; 2s2.
В – 5 электронов, z = 5: 1s2; 2s2; 2p1, в состоянии 2р n = 2,  = 1...
= 1...
Ne 1s2; 2s2; 2p6 – L - оболочка полностью заполнена и завершает 2-й период системы Менделеева.
Na размещается в М-оболочке, z = 11, электронная конфигурация 1s2 ; 2s2; 2p6; 3s1. Далее заполнение энергетических состояний происходит аналогично до калия К (z = 19). Девятнадцатый валентный электрон атома К находится в s -состоянии. Но это состояние находится в N-оболочке (n = 4), в то время как 3d подгруппа М- оболочки осталась незаполненной. Т.е. вследствие взаимодействия электронов энергия электрона в состоянии 4s меньше, чем в состоянии 3d. Начиная со скандия SC заполняется 3d подоболочка (энергия 4р оболочки больше, чем энергия 3d оболочки). У цинка Zn заполнение 3d подоболочки заканчивается. Далее заполняется N-оболочка (4р) до криптона Кr (z = 36), электронная конфигурация Кr: 1S2; 2S2; 2р6; 3S2; 3p6; 3d10; 4S2; 4р6. Рубидий Rb (z = 37) размещается в О-оболочке (п = 5), в то время как N-оболочка еще не достроена (d и b подоболочки). Начиная с иттрия Y (z = 39) и до палладия Pd (z = 46) заполняется подгруппа 4d, число электронов в состоянии 5s у иттрия – 2 (затем оно уменьшается), у палладия – 0.
У серебра Ag (z = 47) и кадмия Cd (z = 48) вновь застраивается подгруппа 5s.От индия In (z = 49) и до ксенона Хе (z = 54) завершается 5-й период, подгруппа 5р. Цезий Cs (z = 55) начинает заполнение Р-оболочки (п = 6).
От лантана La (z = 57) до лютеция Lu (z = 71) расположена группа лантанидов (лантаноиды). Это элементы со сходными свойствами. У лантана подгруппы 5s, 5р, 6s целиком заполнены, 57-й электрон находится в состоянии 5d, в то время как подгруппа 4b не заполнена. От церия Се (z = 58) до лютеция Lu (z = 71) происходит заполнение 4b подоболочки, внешняя 6s подгруппа остается без изменения. Этим объясняется сходство свойств лантаноидов.
Начиная с гафния Hf (z = 72) происходит застройка подгруппы 5d и она завершается у золота Аи (z = 79).
У ртути Hg (z = 80) заканчивается заполнение 6s подгруппы; у элементов от таллия Tl (z = 81) до радона Rn (z = 86) заполняется подгруппа 6р; у франция Fr (z = 87) и радия Ra (z = 88) заполняется подгруппа 7s Q-оболочки.
У актинидов (от актиния Ac (z - 89) до лоуренсия Lr (z = 103)) заполняется 5b оболочка.
Таким образом, периодичность химических свойств элементов объясняется полярностью их электронных конфигураций.
При установлении вида термов, возможных при заданной электронной конфигурации, нужно иметь в виду, что принцип запрета Паули разрешает не все сочетания значений квантовых чисел атома L и S, которые вытекают из конфигурации. Так, например, при конфигурации пр2 (два электрона с главным квантовым числом п и  = 1) возможными значениями L будут 0; 1; 2, a спиновое квантовое число S может иметь значения 0; 1. В соответствии с этим возможны, казалось бы, термы
= 1) возможными значениями L будут 0; 1; 2, a спиновое квантовое число S может иметь значения 0; 1. В соответствии с этим возможны, казалось бы, термы
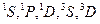 ,
,
однако согласно принципу Паули разрешены лишь такие термы, для которых значения хотя бы одного из квантовых чисел 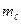 и
и 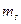 эквивалентных электронов (т.е. электронов с одинаковыми п и
эквивалентных электронов (т.е. электронов с одинаковыми п и  ) не совпадает. Этому требованию не удовлетворяет, например, терм
) не совпадает. Этому требованию не удовлетворяет, например, терм 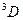 . Действительно, L = 2 означает, что орбитальные моменты электронов «параллельны», следовательно, значения
. Действительно, L = 2 означает, что орбитальные моменты электронов «параллельны», следовательно, значения 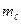 у них будут совпадать. Аналогично,
у них будут совпадать. Аналогично, 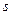 = 1 означает, что спины электронов также «параллельны», вследствие чего совпадают и значения
= 1 означает, что спины электронов также «параллельны», вследствие чего совпадают и значения 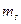 . В итоге все четыре квантовых числа (п,
. В итоге все четыре квантовых числа (п,  , т,
, т, 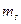 ) у обоих электронов оказываются одинаковыми, что противоречит принципу Паули. Таким образом, терм
) у обоих электронов оказываются одинаковыми, что противоречит принципу Паули. Таким образом, терм 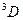 в системе из двух эквивалентных электронов реализоваться не может. Теперь возникает вопрос, какой из термов
в системе из двух эквивалентных электронов реализоваться не может. Теперь возникает вопрос, какой из термов 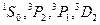 соответствует основному состоянию, т.е. состоянию с наименьшей энергией. Ответ на этот вопрос дают два эмпирических правила Хунда:
соответствует основному состоянию, т.е. состоянию с наименьшей энергией. Ответ на этот вопрос дают два эмпирических правила Хунда:
1. из термов, принадлежащих данной электронной конфигурации, наименьшей энергией обладает терм с наибольшим возможным при заданном S значением L;
2. мультиплеты, образованные эквивалентными электронами, являются правильными (это значит, что с увеличением 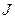 возрастает энергия состояния), если заполнено не более половины подоболочки, и обращенными (с увеличением
возрастает энергия состояния), если заполнено не более половины подоболочки, и обращенными (с увеличением 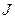 энергия убывает), если заполнено больше половины подоболочки.
энергия убывает), если заполнено больше половины подоболочки.
Из второго правила Хунда следует, что в случае, когда заполнено не более половины подоболочки, наименьшей энергией обладает компонент мультиплета с 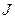 = L +
= L + 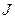 .
.
Согласно первому правилу Хунда из приведенных термов наименьшей энергией должен обладать один из термов Р (у этих термов наибольшее S). При конфигурации пр2 подоболочка Р заполнена только на 1/3, т.е. меньше, чем на половину. Следовательно, согласно второму правилу Хунда наименьшей энергией обладает терм с наименьшим значением 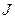 , т.е. терм
, т.е. терм 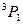 . Этот терм и является основным для конфигурации пр2.
. Этот терм и является основным для конфигурации пр2.
– Конец работы –
Эта тема принадлежит разделу:
Тепловое излучение
Лекция... Двойственная корпускулярно волновая природа... Частиц вещества Гипотеза де Бройля...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Лекция 14
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов