рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Электроника
- /
- Вид работы: Лекции
- /
- Ионная и ковалентная связь. Молекула водорода. Обменный интеграл
Реферат Курсовая Конспект
Ионная и ковалентная связь. Молекула водорода. Обменный интеграл
Ионная и ковалентная связь. Молекула водорода. Обменный интеграл - Лекция, раздел Электроника, Тепловое излучение Ограничимся Рассмотрением Только Двухатомных Молекул. Различают Два Вида Связ...
Ограничимся рассмотрением только двухатомных молекул. Различают два вида связи между атомами в молекулах. Один из них осуществляется в том случае, когда электроны в молекуле можно разделить на две группы, каждая из которых все время находится около одного из ядер. Электроны распределяются так, что около одного из ядер образуется избыток электронов, а около другого - их недостаток. Таким образом, молекула как бы состоит из двух ионов противоположного знака, притягивающихся друг к другу. Связь этого типа называется гетерополярной (или ионной). Примеры молекул с ионной связью: NaC1, КВr и т.д.
Второй вид связи наблюдается в тех молекулах, в которых часть электронов движется около обоих ядер. Такая связь называется гомеополярной (или ковалентной, или атомной). Она образуется парами электронов с противоположно направленными спинами. Среди молекул этого типа следует различать молекулы с одинаковыми ядрами (Н2, N2, O2) и молекулы с разными ядрами (СN). В молекулах первого рода электроны распределены симметрично. В молекулах второго рода имеется некоторая асимметрия в распределении электронов, благодаря чему молекулы приобретают электрический дипольный момент.
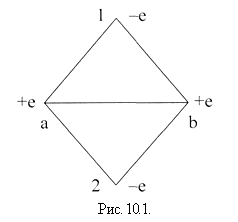 Простейшей молекулой с гомеополярной связью является молекула водорода. Вскоре после создания квантовой механики Гайтнер и Лондон (1927) предприняли успешную попытку квантово-механического расчета основного состояния молекулы Н2. Им удалось решить уравнение Шредингера для системы, состоящей из двух протонов (ядер атома водорода) и двух электронов (рис.10.1).
Простейшей молекулой с гомеополярной связью является молекула водорода. Вскоре после создания квантовой механики Гайтнер и Лондон (1927) предприняли успешную попытку квантово-механического расчета основного состояния молекулы Н2. Им удалось решить уравнение Шредингера для системы, состоящей из двух протонов (ядер атома водорода) и двух электронов (рис.10.1).
Потенциальная энергия такой системы равна:
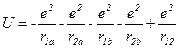 .
.
Ядра имеют массу, примерно в две тысячи раз превышающую массу электрона. Поэтому они движутся гораздо медленнее электронов, и в первом приближении их можно считать неподвижными. В первом приближении уравнение Шредингера имеет вид:
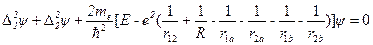 . (10.1)
. (10.1)
Здесь 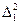 - оператор Лапласа, содержащий координаты одного электрона,
- оператор Лапласа, содержащий координаты одного электрона, 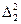 - оператор Лапласа, содержащий координаты другого электрона.
- оператор Лапласа, содержащий координаты другого электрона.
Рассмотрим механизм образования молекулы водорода Н2 при взаимодействии двух его атомов. Атом водорода в изолированном состоянии на внешней оболочке имеет 1s1 электрон, ему не хватает одного электрона для того, чтобы полностью заполнить эту s - оболочку. При постепенном сближении двух атомов водорода возможно перекрытие электронных оболочек и переход электрона от первого атома ко второму, а от второго атома — к первому. Это перекрытие может происходить без перехода электронов на более высокие энергетические уровни, т.к. электронные оболочки не полностью заполнены, и принцип запрета Паули разрешает такое перекрытие.
Если энергия системы двух взаимодействующих атомов при перекрытии ниже, чем энергия системы, в которой атомы изолированы, то за счет перекрытия могут возникать силы притяжения, которые при дальнейшем сближении атомов сменяются быстро возрастающими силами отталкивания ядер. При некотором расстоянии между ядрами, соответствующем минимуму энергии системы, силы притяжения уравновесятся силами отталкивания, и образуется молекула Н2, электронная оболочка которой подобна электронной оболочке атома гелия (инертного газа). В такой молекуле атомов водорода нет - в ней содержатся только составные части этих атомов - два протона и два электрона. Электроны, которые входили в состав атомов, стали общими для обоих ядер — электроны коллективизируются обоими ядрами. Т.к. электроны совершенно одинаковы, то при их обмене местами состояние системы не меняется.
С точки зрения квантовой механики поведение валентных электронов в атомах описывается волновой функцией ψ(r), где r - расстояние от центра ядра до места нахождения электрона.
Рассмотрим два изолированных атома а и b. Поведение валентных электронов этих атомов описывается соответственно волновыми функциями ψa и ψb. Пусть в изолированном состоянии Еа — энергия атома a, Eb — энергия атома b, так что Еа + Eb - полная энергия системы двух атомов. При сближении атомов на расстояние порядка суммы атомных радиусов начнется значительное перекрытие волновых функций взаимодействующих атомов. Когда валентные электроны находятся в межъядерном пространстве, электрические поля, действующие со стороны атомов, примерно одинаковы, и возможно обобществление валентных электронов, которые теперь движутся в поле обоих атомов (ядер).
Поведение обобществленных электронов описывается молекулярной волновой функцией ψ, которая включает в себя свойства невозмущенных волновых функций ψa и ψb.
Молекула вещества в большинстве случаев состоит из нескольких электронов и нескольких атомных ядер, поэтому кинетическая энергия молекулы состоит из двух частей - одна часть соответствует кинетической энергии движения ядер, другая - кинетической энергии движения электронов. Потенциальная энергия системы равна ее общей электростатической энергии.
При исследовании движения системы состоящей более чем из двух частиц, решение уравнения Шредингера может быть только приближенным. Так как масса ядер существенно больше массы электронов, ядра в молекуле движутся значительно медленнее электронов. Поэтому движение ядер и электронов можно описывать отдельно.
При решении уравнения Шредингера считают координаты ядер фиксированными параметрами (т.е. движением ядер можно пренебречь). В этом случае молекулярная волновая функция является функцией только координат электронов.
В качестве молекулярной волновой функции ψ выберем волновую функцию, которая описывает движение одного электрона в общем поле двух атомов а и b. Такая волновая функция называется молекулярной орбиталью (МО). Для одномерной молекулы МО является линейной комбинацией атомных орбиталей изолированных атомов:
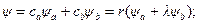
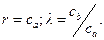
где ψa, ψb — невозмущенные атомные волновые функции; са, cb - постоянные коэффициенты, характеризующие долевое участие в молекулярной волновой функции каждой из атомных орбит. Из условия нормировки волновой функции
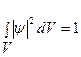
найдем: 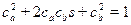 , где
, где 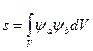 – интеграл перекрытия, характеризующий степень перекрытия атомных волновых функций при взаимодействии, обычно s < 1.
– интеграл перекрытия, характеризующий степень перекрытия атомных волновых функций при взаимодействии, обычно s < 1.
Для полной энергии системы получим выражение:
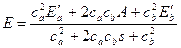 ,
,
где 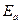 ,
, 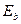 - энергии кулоновского электростатического взаимодействия электронов с ядрами, электронов между собой и ядер между собой; А - обменный интеграл, который представляет собой дополнительную энергию взаимодействия, возникающую в результате перераспределения электронной плотности при перекрытии атомных волновых функций:
- энергии кулоновского электростатического взаимодействия электронов с ядрами, электронов между собой и ядер между собой; А - обменный интеграл, который представляет собой дополнительную энергию взаимодействия, возникающую в результате перераспределения электронной плотности при перекрытии атомных волновых функций:
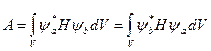 ,
,
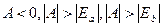 , Ĥ — оператор Гамильтона;
, Ĥ — оператор Гамильтона;  — функция , комплексно сопряженная с
— функция , комплексно сопряженная с 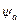 .
.
Решение уравнения Шредингера для симметричной двухатомной молекулы показало, что волновая функция принимает два значения:
1. симметричная 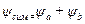 , для которой полная энергия равна
, для которой полная энергия равна
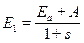 ,
,
2. антисимметричная  , для которой
, для которой 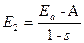 .
.
Из этих результатов вытекают два важных вывода:
1. При сближении атомов и перекрытии их волновых функций происходит расщепление энергетического уровня Еa – Eb на два молекулярных уровня энергии Ecим и Eант.. При этом уровень Ecим. понижается (s < 1, А < 0), а уровень Eант повышается относительно исходного уровня энергии в изолированном состоянии Еa - Eb.
Понижение уровня Ecим. соответствует возникновению сил притяжения, и так как 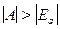 , то понижение уровня обусловлено в основном обменным интегралом А, поэтому такие силы и получили название обменных;
, то понижение уровня обусловлено в основном обменным интегралом А, поэтому такие силы и получили название обменных;
2. Понижение энергии Ecим. связано с повышением электронной плотности между ядрами взаимодействующих атомов из-за значительного перераспределения электронной плотности по сравнению с плотностями в изолированных атомах. В случае понижения энергии в пространстве между ядрами электронная плотность повышается по сравнению с электронной плотностью, которая могла бы получиться при простом сложении плотностей изолированных атомов.
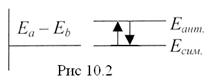 В возбужденном состоянии Eант электронная плотность в межъядерном пространстве значительно понижается, а в случае одинаковых атомов и вовсе становится равной нулю. Ядра оказываются менее экранированными электронами, и силы отталкивания между ними превышают силы притяжения. Молекулы не образуются (рис.10.2)
В возбужденном состоянии Eант электронная плотность в межъядерном пространстве значительно понижается, а в случае одинаковых атомов и вовсе становится равной нулю. Ядра оказываются менее экранированными электронами, и силы отталкивания между ними превышают силы притяжения. Молекулы не образуются (рис.10.2)
Итак, основной характерной особенностью ковалентных кристаллов является то, что количество ковалентных связей, образуемых каждым атомом со своими соседями, равно количеству неспаренных внешних электронов атома в свободном состоянии или в возбужденном валентном состоянии. В этом смысле ковалентная связь является насыщенной.
Атомы при взаимодействии могут возбуждать друг друга и производить распаривание электронов, т.е. переводить один из спаренных электронов в свободную ячейку на незанятый электрический уровень. Так, у элементов IV группы, имеющих 4 валентных электрона s2p2 (рис.10.3а), происходит переход в s1p3 состояние (Рис.10.3.б):
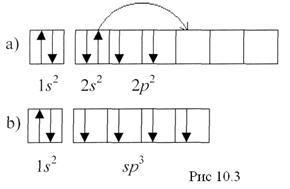 В результате взаимного возбуждения все четыре электрона снялись со своих орбит и находятся на смешанных (или гибридных) орбитах. Это явление называется гибридизацией s и р электронов.
В результате взаимного возбуждения все четыре электрона снялись со своих орбит и находятся на смешанных (или гибридных) орбитах. Это явление называется гибридизацией s и р электронов.
Характерная черта ковалентной связи - ее сильная направленность в пространстве. Она образуется в тех направлениях, в которых локализуется электронная плотность. Вследствие направленности связи ковалентные кристаллы обладают высокой твердостью и хрупкостью.
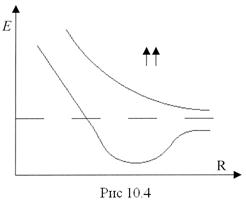
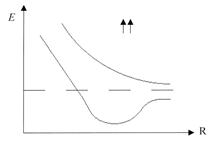 Собственные значения энергии, полученные из уравнения Шредингера (10.1), зависят от расстояния между ядрами R, причем в случаях параллельной и антипараллельной ориентации спинов электронов характер этой зависимости существенно различен.
Собственные значения энергии, полученные из уравнения Шредингера (10.1), зависят от расстояния между ядрами R, причем в случаях параллельной и антипараллельной ориентации спинов электронов характер этой зависимости существенно различен.
Так как образование молекулы возможно лишь при сближении атомов с антипараллельными спинами, молекуле соответствует нижняя кривая на рис. 10.4.
Аналогично обстоит дело и в случае других двух атомных молекул. Энергия, обусловленная электронной конфигурацией (электронная энергия) имеет минимум при некотором значении R и изображается кривой такого же вида, что и для водородной молекулы.
Изменение электронной конфигурации молекулы приводит к изменению кривой зависимости электронной энергии от расстояния между ядрами R. Асимптотическое значение энергии также становится другим - равным новой суммарной энергии изолированных атомов в новом квантовом состоянии (кривая 2 на рис.10.5):
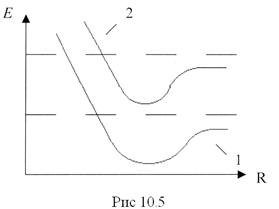 В основном изменение энергетического запаса молекулы происходит, как и в атоме, в результате изменений в электронной конфигурации, образующий периферийную часть молекулы, однако при заданной электронной конфигурации ядра молекулы могут различным образом колебаться и вращаться относительно общего центра масс. С этими видами движения связаны запасы колебательной и вращательной энергии, которые должны быть учтены в общем балансе.
В основном изменение энергетического запаса молекулы происходит, как и в атоме, в результате изменений в электронной конфигурации, образующий периферийную часть молекулы, однако при заданной электронной конфигурации ядра молекулы могут различным образом колебаться и вращаться относительно общего центра масс. С этими видами движения связаны запасы колебательной и вращательной энергии, которые должны быть учтены в общем балансе.
Введем обозначения:
Ес – энергия, обусловленная электронной конфигурацией (электронная энергия);
Еv – энергия, соответствующая колебаниям системы (колебательная или вибрационная энергия);
Еr – энергия, связанная с вращением молекулы (вращательная или ротационная энергия).
В первом приближении отдельные виды молекулярных движений - движение электронов, колебание и вращение молекулы — можно считать независимыми друг от друга. Поэтому полную энергию молекулы можно представить в виде:
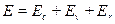
Энергия гармонического осциллятора определяется выражением
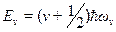 (v = 0,1,2,...) (10.2)
(v = 0,1,2,...) (10.2)
где v — колебательное квантовое число, ωv — классическая частота осциллятора. Для колебательного квантового числа имеет место правило отбора: 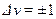 .
.
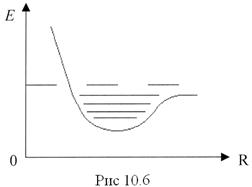
Кривая потенциальной энергии молекулы (рис.10.5) совпадает с параболой только при малых колебаниях. Ангармоничность, наступающая при увеличении интенсивности колебаний, приводит к тому, что с увеличением квантового числа 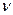 уровни сгущаются, имея своим пределом энергию
уровни сгущаются, имея своим пределом энергию 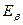 диссоциации молекулы (рис.10.6). Однако при небольших значениях
диссоциации молекулы (рис.10.6). Однако при небольших значениях 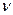 можно с достаточной степенью точности считать, что колебательная энергия молекулы определяется формулой (10.2).
можно с достаточной степенью точности считать, что колебательная энергия молекулы определяется формулой (10.2).
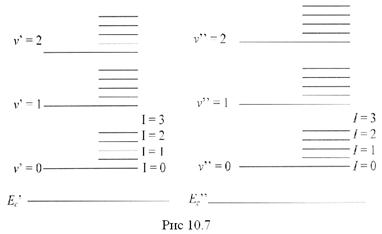
Вращательная энергия молекулы, имеющей момент инерции I и вращающейся с угловой скоростью ωr , равна:
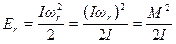
где М= Iωr - момент импульса системы, 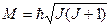 (
(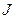 =0,1,2,...)
=0,1,2,...)
где 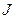 — квантовое число момента импульса.
— квантовое число момента импульса.
 Следовательно, вращательная энергия молекулы может иметь только квантованные значения
Следовательно, вращательная энергия молекулы может иметь только квантованные значения
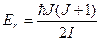
где I – момент инерции молекулы относительно оси, проходящей через ее центр инерции,
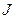 – вращательное квантовое число. Правило отбора для вращательного квантового числа
– вращательное квантовое число. Правило отбора для вращательного квантового числа 
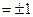 .
.
Расстояние между вращательными уровнями 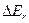 . значительно меньше расстояния между колебательными уровнями
. значительно меньше расстояния между колебательными уровнями 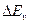 , которые в свою очередь значительно меньше, чем расстояние между электронными уровнями
, которые в свою очередь значительно меньше, чем расстояние между электронными уровнями 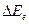 , тогда схема энергетических уровней двухатомной молекулы выглядит так, как показано на рис. 10.7.
, тогда схема энергетических уровней двухатомной молекулы выглядит так, как показано на рис. 10.7.
– Конец работы –
Эта тема принадлежит разделу:
Тепловое излучение
Лекция... Двойственная корпускулярно волновая природа... Частиц вещества Гипотеза де Бройля...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Ионная и ковалентная связь. Молекула водорода. Обменный интеграл
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов