рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Философия
- /
- Вид работы: Конспекты Лекций
- /
- Вычисление энтропии. Парадокс Гиббса.
Реферат Курсовая Конспект
Вычисление энтропии. Парадокс Гиббса.
Вычисление энтропии. Парадокс Гиббса. - Конспект Лекций, раздел Философия, Основные понятия термодинамики. Предмет термодинамики. Основные параметры состояния термодинамической системы Запишем Из Выражения (48) Выражение Для Дифференциала Энтропии: ...
Запишем из выражения (48) выражение для дифференциала энтропии:
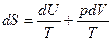 (48)
(48)
Из уравнения состояния идеального газа
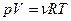 или
или 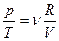 ,
,
откуда получаем 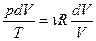 . Учитывая также, что dU =mcvdT перепишем выражение (49) в виде:
. Учитывая также, что dU =mcvdT перепишем выражение (49) в виде:
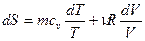 (49)
(49)
Интегрируя это выражение получим изменение энтропии в термодинамическом процессе:
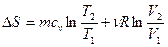 (50)
(50)
Пользуясь понятием энтропии можно определить количество тепла участвующего в термодинамическом процессе:
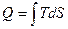 (51)
(51)
Из выражения (51) следует, что подобно тому, как по графику процесса в p – V диаграмме можно определить работу процесса, по графику процесса в T – S диаграмме можно определить количество теплоты. Как и работа, количество теплоты будет определяться площадью под кривой процесса в T – S диаграмме (рис. 10).
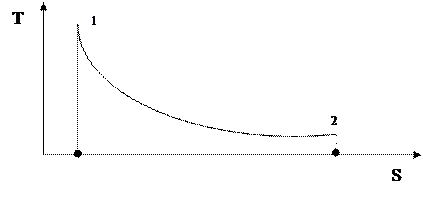 |
Рис. 10. График термодинамического процесса в T – S диаграмме
Очевидно, что адиабатический процесс в T – S диаграмме будет представлять собой отрезок вертикальной прямой (S = const). Поэтому адиабатический процесс называют еще изоэнтропным.
Записав неопределенный интеграл от выражения (50), получаем значение энтропии в любом произвольном состоянии термодинамической системы.
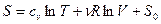 , (52)
, (52)
где S0 – константа интегрирования, представляющая собой значение энтропии при начальных параметрах термодинамической системы S0(T1,V1).
Если имеется смесь различных идеальных газов, то ее можно разделить, используя полупроницаемые перегородки, на составляющие компоненты, каждый из которых имеет объем смеси, без затрат работы или сообщения теплоты, а следовательно без изменения энтропии. Это приводит к теореме Гиббса об энтропии газовой смеси:
Энтропия смеси идеальных газов равна сумме энтропий этих газов, когда каждый из них в отдельности занимает при температуре смеси тот же объем, что и вся смесь.
Вычислим увеличение энтропии при смешении двух различных газов, разделенных вначале перегородкой, занимающих объемы V1 и V2 и имеющих одинаковую температуру Т (ν1 и ν 2 – число молей каждого газа). Энтропия газов до смешения
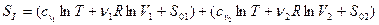
После смешения, когда каждый газ занимает весь объем V1 + V2
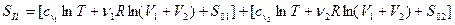
Изменение энтропии системы после смешения равно
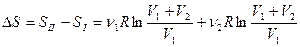 , (53)
, (53)
откуда видно, что изменение энтропии при изотермическом смешении идеальных газов определяется только конфигурационной (зависящей от объема) частью энтропии
Sk = ν R lnV (54)
В случае равных количеств газов (ν1 = ν2 = ν), находящихся до смешения в одинаковых объемах (V1 = V2 = V), для конфигурационной части системы получаем:
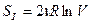 ,
,
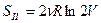 . (55)
. (55)
Изменение энтропии после смешения
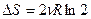 . (56)
. (56)
Из соотношения (54) видно, что возрастание энтропии при смешении двух идеальных газов зависит только от количества молей газов, но не зависит от их природы. В предельном случае смешения двух идентичных газов увеличения энтропии не должно быть, так как при этом после удаления разделяющей перегородки никакого термодинамического процесса в системе не происходит. Следовательно, смешение двух идентичных газов нельзя рассматривать как предельный случай смешения двух различных газов и при переходе от смеси сколь угодно близких по своим свойствам и разделимых из этой смеси газов к смеси одинаковых газов величина ΔS испытывает скачок – парадокс Гиббса.
Для вычисления изменения энтропии при смешении двух порций одного и того же газа надо пользоваться или непосредственно выражением (52) для энтропии химически однородного газа, или видоизмененной теоремой Гиббса, согласно которой энтропия газовой смеси двух одинаковых порций одного и того же газа равна сумме энтропий обеих порций, когда каждая из них в отдельности занимает весь объем без величины 2 ν R ln2, или же учитывать в формуле (55) для энтропии смеси различных газов скачок изменения их плотности в предельном случае смешения тождественных газов, т. е. при переходе к смешению тождественных газов надо в формуле (57) заменить V на V/2.
Разрешить парадокс Гиббса означает установить физическое обоснование скачка энтропии при переходе от смеси сколь угодно близких газов к смеси одинаковых газов. Существует точка зрения, согласно которой парадокс Гиббса о разрывном поведении ΔS связывается с объективной невозможностью непрерывного сближения параметров, характеризующих смешиваемые газы.
Физическим обоснованием парадокса Гиббса является невозможность разделения на первоначальные порции смеси тождественных газов в отличие от допускаемого термодинамикой разделения смеси сколь угодно мало отличающихся друг от друга газов.
Физический смысл энтропии.Однозначная функция состояния– энтропия, существование которой у равновесной системы устанавливает второй закон термодинамики, является величиной не наглядной: ее можно вычислить, но нельзя измерить.
Физический смысл энтропии можно выяснить при анализе нестатических процессов. Изменение энтропии является мерой необратимости процессов в замкнутой системе и характеризует направление естественных процессов в такой системе.
 |
– Конец работы –
Эта тема принадлежит разделу:
Основные понятия термодинамики. Предмет термодинамики. Основные параметры состояния термодинамической системы
На сайте allrefs.net читайте: Конспект лекций Дисциплина по учебному плану направления подготовки: 260901 Технология швейных изделий. Омск СОДЕРЖАНИЕ...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Вычисление энтропии. Парадокс Гиббса.
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов