рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Философия
- /
- Вид работы: Конспекты Лекций
- /
- Характеристики водяного пара
Реферат Курсовая Конспект
Характеристики водяного пара
Характеристики водяного пара - Конспект Лекций, раздел Философия, Основные понятия термодинамики. Предмет термодинамики. Основные параметры состояния термодинамической системы Водяной Пар Используют В Качестве Рабочего Тела В Различных Процессах, Наприм...
Водяной пар используют в качестве рабочего тела в различных процессах, например, для вращения паровой турбины.
Обычно пар получают в процессе кипения жидкости. Если подводить теплоту к жидкости при постоянном давлении, температура жидкости растет до некоторого значения Ткип. При дальнейшем нагреве температура остается постоянной – происходит образование пара в процессе кипения жидкости.
Кипение– это процесс парообразования в объеме жидкости, тогда как испарение происходит лишь со свободной поверхности жидкости при условии, что парциальное давление пара над жидкостью меньше давления насыщенного пара.
Процесс кипения в p – V диаграмме изображается изобарой, которая одновременно является и изотермой.
Удельная теплота парообразования ( r, Дж/кг ) -это количество теплоты, необходимое для перевода 1 кг жидкости в пар.
В соответствии с первым законом термодинамики:
q = r = (u//- u/) + p(v//- v/), (69)
где u//, v// - удельная внутренняя энергия и удельный объем сухого насыщенного пара; u/, v/ – то же для воды.
(u//- u/) – изменение внутренней энергии, связанное с преодолением сил притяжения между молекулами при переходе жидкости в пар. p(v//- v/) – работа расширения пара.
Пар может быть влажным, сухим, насыщенным и перегретым.
Влажный пар– это смесь кипящей жидкости и сухого насыщенного пара. Отношение массы пара к массе смеси называется степенью сухости пара -х.
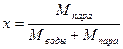 (70)
(70)
Используется и другая величина (1-х), называемая степенью влажности пара:
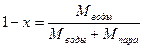 (71)
(71)
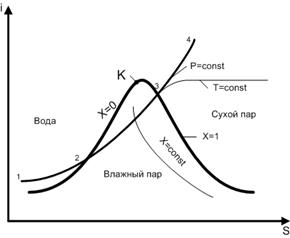 Для анализа процесса парообразования и определения параметров водяного пара используются i – S диаграммы водяного пара.
Для анализа процесса парообразования и определения параметров водяного пара используются i – S диаграммы водяного пара.
|
Основной кривой на i – S диаграмме являетсякривая насыщенияс указанной на ней критической точкой К, которая делит кривую на две линии. Слева от точки К линия кипения воды. На этой линии х = 0, то есть пар отсутствует. Справа от критической точки располагается линия конденсации, для которой х = 1, что соответствует отсутствию воды. Кривая насыщения совместно с критической точкой на ней делит всю диаграмму на три области. Под кривой насыщения находится область влажного пара со степенью сухости 0 < x < 1. Над кривой насыщения слева от точки К имеет место состояние воды. Справа от критической точки над кривой насыщения расположена область сухого пара. Кроме кривой насыщения на i – S диаграмме проводятся изобары (p = const), изотермы (t = const) и линии постоянной степени сухости пара (x = const). Под кривой насыщения изотермы и изобары совпадают.
Рассмотрим процесс нагрева воды при постоянном давлении, двигаясь по изобаре 1-2-3-4 (рис. 12). На участке 1-2 происходит нагрев воды до температуры кипения. Количество тепла, которое нужно для этого подвести, определяется разностью энтальпий i2 и i1:
qводы= i2 – i1
На участке 2-3 происходит кипение воды при постоянной температуре. Разность энтальпий здесь определяет удельную теплоту парообразования:
r = i3 – i2
На участке 3-4 происходит перегрев сухого пара. Температура на этом участке возрастает. Увеличение энтальпии определяет затраты тепла на перегрев пара:
qперегрева= i4 – i3
i – S диаграмма позволяет определить общие затраты тепла, необходимого для получения перегретого пара:
q = qводы+ r + qперегрева= ∆iводы+ ∆iпарообр.+ ∆iперегрева
– Конец работы –
Эта тема принадлежит разделу:
Основные понятия термодинамики. Предмет термодинамики. Основные параметры состояния термодинамической системы
На сайте allrefs.net читайте: Конспект лекций Дисциплина по учебному плану направления подготовки: 260901 Технология швейных изделий. Омск СОДЕРЖАНИЕ...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Характеристики водяного пара
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов