рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Философия
- /
- Вид работы: Конспекты Лекций
- /
- Второй закон термодинамики для нестатических процессов
Реферат Курсовая Конспект
Второй закон термодинамики для нестатических процессов
Второй закон термодинамики для нестатических процессов - Конспект Лекций, раздел Философия, Основные понятия термодинамики. Предмет термодинамики. Основные параметры состояния термодинамической системы Существование У Равновесной Системы Однозначной Функции Состояния – Энтропии ...
Существование у равновесной системы однозначной функции состояния – энтропии выражает второй закон термодинамики для квазистатических процессов. Сформулируем этот закон применительно к нестатическим, необратимым процессам.
Пусть переход системы из состояния 1 в состояние 2 (рис. 11) происходит нестатически. При этом системе сообщается некоторое количество теплоты δQнест и она совершает работу δLнест. Согласно первому закону термодинамики
δQнест = dU + δLнест. (59)
Если же система переходит из состояния 1 в состояние 2 квазистатически, то
δQ = dU + δL. (60)
Первый переход является необратимым, поэтому вернуть систему в исходное состояние без компенсации невозможно. Второй переход обратим и систему можно вернуть в исходное состояние без всяких изменений в окружающих телах.
Вычитая из уравнения (59) уравнение (60), получим для кругового процесса:
δQнест – δQ = δLнест – δL. (61)
Эта разность не может быть равной нулю, так как это бы означало, что необратимый процесс перехода системы из одного состояния в другое можно обратить квазистатическим путем без изменения в окружающих телах (отдав теплоисточнику количество теплоты δQ = δQнест и произведя работу δL = δLнест). Эта разность не может быть положительной, так как это означало бы, что при квазистатическом возвращении системы после необратимого процесса в начальное состояние за весь круговой цикл системой была произведена работа δLнест – δL > 0 только за счет теплоты теплоисточника δQнест – δQ > 0 без всякой компенсации. Разность (61) может быть только отрицательной. Отсюда следует, что
δQ > δQнест (62) и
δL > δLнест (63)
Поскольку δQ = T dS, то из (63) получаем T dS > δQнест, а следовательно:
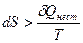 (64) и
(64) и
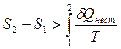 (65)
(65)
Из выражений (64) и (65) можно сделать выводы:
1. Переход системы из одного состояния в другое, совершаемый адиабатически квазистатически (δQ = T dS = 0), невозможно осуществить адиабатически нестатически (δQнест= 0, dS > 0) и наоборот.
2. При нестатическом адиабатическом переходе (δQнест = 0)
dS > 0 и S2 – S1 > 0, (66)
то есть система переходит в состояние с большей энтропией: при нестатических адиабатических процессах энтропия системы возрастает.
Это закон возрастания энтропиив адиабатически замкнутой системе при нестатических процессах выражает второй закон термодинамики для нестатических процессов.
Поскольку все естественные процессы протекают с конечной скоростью, т. е. нестатичны, следовательно, при этих процессах в замкнутых системах энтропия всегда возрастает. Таким образом, второй закон термодинамики указывает направление естественных процессов: естественные процессы в изолированных системах проходят в направлении роста энтропии.
Для нестатического кругового процесса из формулы (67) получаем неравенство Клаузиуса:
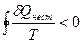 . (67)
. (67)
Это неравенство как и формула (65) выражает второй закон термодинамики для нестатических процессов в неизолированных системах.
Неравенства (65) и (66) не следует понимать так, что при нестатическом переходе системы из состояния 1 в состояние 2 изменение энтропии больше, чем при квазистатическом переходе. Энтропия есть однозначная функция состояния, и в каждом состоянии система имеет одну определенную энтропию. Следовательно, разность значений энтропии S2 - S1 не зависит от того, квазистатически или нестатически система перешла из состояния 1 в состояние 2. Знак неравенства в формуле (67) указывает на то, что интеграл в правой части формулы, взятый по нестатическому пути, не определяет разности энтропий конечного и начального состояний, а меньше ее. Аналогично неравенство (66) выражает то, что адиабатическая система может нестатически переходить в состояние с большей энтропией. Температура T в неравенствах (64) и (67) есть температура теплоисточника, а не температура тела.
При адиабатических квазистатических процессах достижимы лишь состояния с неизменной энтропией S = S0 = const и недостижимы все состояния как с S > S0, так и с S < S0. С помощью нестатических процессов можно достичь состояния с S > S0, но нельзя достичь состояний с S < S0.
Основное уравнение и основное неравенство термодинамики, выражающее первый и второй закон термодинамики для идеального газа можно теперь записать в виде:
T dS ≥ dU + p dV , (68)
где равенство относится к квазистатическим процессам, а неравенство соответствует неравновесным процессам.
– Конец работы –
Эта тема принадлежит разделу:
Основные понятия термодинамики. Предмет термодинамики. Основные параметры состояния термодинамической системы
На сайте allrefs.net читайте: Конспект лекций Дисциплина по учебному плану направления подготовки: 260901 Технология швейных изделий. Омск СОДЕРЖАНИЕ...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Второй закон термодинамики для нестатических процессов
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов