рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Образование
- /
- Термодинамика изохорического процесса: V=const.
Реферат Курсовая Конспект
Термодинамика изохорического процесса: V=const.
Термодинамика изохорического процесса: V=const. - раздел Образование, Основные положения молекулярно-кинетической теории. Масса и размер молекул Рассмотрим Закон, Описывающий Этот Процесс, И Его График В Координатах (P,v)....
Рассмотрим закон, описывающий этот процесс, и его график в координатах (P,V). Этот закон является частным случаем уравнения Менделеева-Клапейрона (уравнения состояния идеального газа) 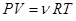 . Запишем это уравнение для состояний газа 1 и 2 и, разделив одно на другое, получим:
. Запишем это уравнение для состояний газа 1 и 2 и, разделив одно на другое, получим:
 . - закон Шарля.
. - закон Шарля.
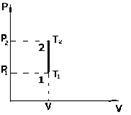
График изохорического процесса в координатах (P,V) представлен на рис. 1.2.
Так как 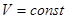 , то
, то 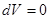 и
и 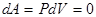 , т.е.
, т.е. 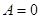 - работа, совершаемая газом при изохорическом процессе, равна нулю.
- работа, совершаемая газом при изохорическом процессе, равна нулю.
Тогда
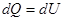 - первое начало термодинамики для
- первое начало термодинамики для
изохорического процесса.
Поскольку количество теплоты, сообщенное газу, равно
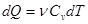 ,
,
где 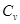 - молярная теплоёмкость газа при постоянном объёме, то мы получаем полезную формулу для подсчёта приращения внутренней энергии газа:
- молярная теплоёмкость газа при постоянном объёме, то мы получаем полезную формулу для подсчёта приращения внутренней энергии газа:
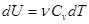 - изменение внутренней энергии газа. (1.6)
- изменение внутренней энергии газа. (1.6)
Сравнивая формулы (1.2) и (1.6), получим выражение для молярной теплоёмкости газа при постоянном объёме:
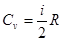 .
.
№ 44 Термодинамика изобарического процесса: P=const. Соотношение Майера.
Рассмотрим закон, описывающий этот процесс, и его график в координатах (P,V). Запишем уравнение состояния идеального газа для состояний 1 и 2 и, разделив одно уравнение на другое, получим:
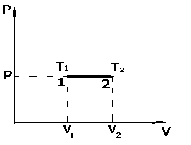 Рис. 1.3. График изобарического процесса (изобара)
Рис. 1.3. График изобарического процесса (изобара)
|
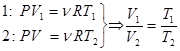 - закон Гей-Люссака.
- закон Гей-Люссака.
График изобарического процесса в координатах (P,V) представлен на рис. 1.3.
Работа, совершаемая газом, 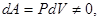
приращение внутренней энергии газа также не равно нулю 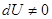 , и первое начало термодинамики сохраняет вид (1.1):
, и первое начало термодинамики сохраняет вид (1.1):
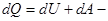 первое начало термодинамики для
первое начало термодинамики для
изобарического процесса.
Формула для подсчёта теплоты при изобарическом процессе принимает вид:
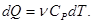
где 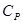 - молярная теплоёмкость газа при постоянном давлении.
- молярная теплоёмкость газа при постоянном давлении.
Воспользовавшись уравнением Менделеева-Клапейрона, представим работу, совершаемую газом, в следующем виде:
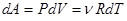 .
.
Из выражения для работы следует размерность и физический смысл универсальной газовой постоянной R:
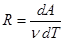 ,
, 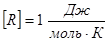 .
.
Универсальная газовая постоянная R численно равно работе, совершённой одним молем газа при изобарическом процессе при увеличении его температуры на один градус Кельвина.
Подставим выражения для dQ, dU (1.6), dA в первое начало термодинамики:
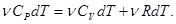
Сокращая на ndT, получим соотношение между молярными теплоёмкостями газа при постоянном объёме 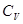 и постоянном давлении
и постоянном давлении 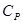 :
:
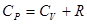 - соотношение Майера. (1.8)
- соотношение Майера. (1.8)
Учитывая, что 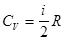 , выражение для
, выражение для 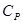 будет иметь вид:
будет иметь вид:
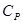 =
=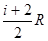 . (1.9)
. (1.9)
Приведем также выражение для отношения молярных теплоёмкостей 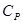 и
и 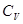 :
:
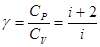 .
.
Например, для двухатомных молекул при невысоких температурах i = 5, тогда 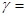 1,4.
1,4.
Вычислим работу, совершаемую газом при изобарическом процессе:
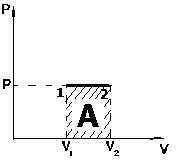 Рис. 1.4. Работа при изобарическом процессе
Рис. 1.4. Работа при изобарическом процессе
|
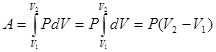 , т.е.
, т.е.
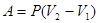 - работа, совершаемая газом при
- работа, совершаемая газом при
изобарическом процессе.
На графике изобарического процесса в координатах (P,V) работа, совершаемая газом, численно равна площади прямоугольника, построенного под изобарой (рис. 1.4).
– Конец работы –
Эта тема принадлежит разделу:
Основные положения молекулярно-кинетической теории. Масса и размер молекул
М К т Изучает свойства вещества давление температуру и так далее как суммарный результат действий молекул при этом пользуется статическим...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Термодинамика изохорического процесса: V=const.
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов