рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Образование
- /
- Максвелловское распределение энергии по степеням свободы молекул газа. Внутренняя энергия идеального газа
Реферат Курсовая Конспект
Максвелловское распределение энергии по степеням свободы молекул газа. Внутренняя энергия идеального газа
Максвелловское распределение энергии по степеням свободы молекул газа. Внутренняя энергия идеального газа - раздел Образование, Основные положения молекулярно-кинетической теории. Масса и размер молекул В Случае Идеального Газа Число Молекул В Единице Объема, Имеющих Значение Ком...
В случае идеального газа число молекул в единице объема, имеющих значение компоненты скорости в интервале от vx до vx + dvx может быть представлено в виде: 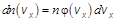 .
.
Это выражение, деленное на общее число молекул n в единице объема, дает вероятность того, что молекула имеет компоненту скорости в интервале от vx до vx + dvx 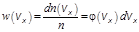 .
.
Таким образом, функция 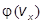 является плотностью данной вероятности. Поскольку для газа в целом направление движения молекул можно считать случайным, то функция
является плотностью данной вероятности. Поскольку для газа в целом направление движения молекул можно считать случайным, то функция 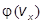 является гауссовой функцией распределения случайной величины и имеет следующий вид:
является гауссовой функцией распределения случайной величины и имеет следующий вид: 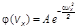 где A и j некоторые постоянные.
где A и j некоторые постоянные.
Аналогично определяются вероятности для двух других компонент 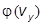 и
и 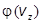 скорости молекулы:
скорости молекулы: 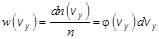
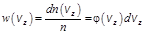
В силу равноправности всех направлений движения молекул вид функций 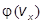 ,
, 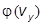 и
и 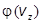 должен быть одинаковым, эти функции отличаются лишь обозначением аргумента.
должен быть одинаковым, эти функции отличаются лишь обозначением аргумента.
Максвелл предположил, что вероятность различных значений одной из компонент скорости, например vx , не зависит от того, какова величина двух других компонент (в данном случае vy и vz ). Поэтому вероятность того, что компоненты скорости некоторой молекулы имеют значения, лежащие в интервале от vx , vy , vz до vx + dvx , vy + dvy , vz + dvz равна произведению вероятностей  ,
, 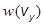 и
и 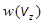 :
: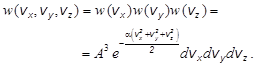
Для определения распределения молекул по значениям модуля скорости v возьмем в воображаемом пространстве прямоугольные координатные оси, по которым будем откладывать значения vx , vy , vz отдельных молекул (имеются в виду компоненты скорости по осям x, y и z, взятым в обычном пространстве). Такое воображаемое пространство будем называть v – пространством. Тогда скорости каждой молекулы будет соответствовать точка в этом пространстве. Из-за столкновений положение точек будут непрерывно меняться, но их плотность в каждом месте будет оставаться неизменной.
Вследствие равноправности всех направлений движения молекул расположение точек относительно начала координат будет сферически симметричным. Следовательно, плотность точек в v – пространстве может зависеть только от модуля скорости v .Тогда точки, изображающие скорости, величина которых заключена в интервале от v до v + dv , попадают в область, лежащую между сферами радиусов v и v + dv (рис. 2.2). Объем этой области равен  . Следовательно, вероятность того, что молекула имеет скорость в интервале от v до v + dv , равна
. Следовательно, вероятность того, что молекула имеет скорость в интервале от v до v + dv , равна
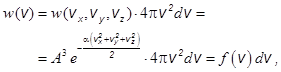
где
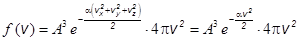 – (2.2)
– (2.2)
– плотность вероятности того, что молекула имеет скорость в интервале от v до v + dv.
Функция 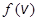 называется функцией распределения Максвелла молекул по скоростям.
называется функцией распределения Максвелла молекул по скоростям.
– Конец работы –
Эта тема принадлежит разделу:
Основные положения молекулярно-кинетической теории. Масса и размер молекул
М К т Изучает свойства вещества давление температуру и так далее как суммарный результат действий молекул при этом пользуется статическим...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Максвелловское распределение энергии по степеням свободы молекул газа. Внутренняя энергия идеального газа
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов